酶解对豆腐干凝胶结构和理化特性的影响
陈凡凡,滕 飞,韩 松,吴长玲,周 艳,郭增旺,王中江,李 杨
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
豆腐干是休闲食品中最具代表性的豆制品之一,其富含人体所必需的8 种氨基酸、不饱和脂肪酸、卵磷脂、矿物质(钙、铁、磷)及VB等,具有极高的营养价值[1]。与传统豆腐相比,豆腐干的保藏期更长,味道咸香爽口,硬中带韧,是常见于中国各大菜系中的一道美食[2],在豆制品中占据相当大的比重。
传统的豆腐干制作主要包括清洗、浸泡、制浆、煮浆、点卤、破脑、压坯、划坯和晾干等工序。其中,制浆是豆腐干生产的重要工序,直接影响豆腐干的出品率和产品特性。目前,制浆工艺主要包括干法和湿法两种。干法制浆主要利用高速旋转叶轮的冲击力,使物料以极高速率与静刀片产生碰撞、剪切、摩擦,从而实现对物料的粉碎,这种制浆工艺对设备要求高、能耗高、处理量小,粉碎后存在纤维颗粒粒度大、粉碎效率低以及引起豆浆口感不细腻等问题[3]。而湿法制浆工艺主要是借助胶体磨、超声波和高压均质进行制备,通过减小豆浆的粒径,使其分布更加紧密均匀。制浆工艺对豆浆的粒度、稳定性、大豆蛋白凝胶性以及后续凝胶成型、豆腐的口感、凝胶强度、硬度等都具有显著的影响。
研究表明,高疏水性基团的暴露量和低蛋白分子质量更有助于豆腐干(凝胶)的产品特性提升[4]。酶解技术是对蛋白资源进行高效转化利用的工艺技术,能够改变蛋白构象及分子间/内作用力,断裂肽键,水解大分子蛋白,形成各种功能性多肽[5]。该技术不仅能提升蛋白的消化吸收效率和营养价值[6-7],还能改善蛋白的功能和理化特性[8],因此在生产中得到广泛应用。而风味蛋白酶是一种微酸性环境下水解蛋白质的真菌蛋白酶/肽酶复合体[9],可以有效地将疏水性氨基酸从脯氨酸末端切除,不仅能够脱除蛋白水解物的苦味,增进和改善水解液风味[10],同时能够水解蛋白质。由于呈味氨基酸的增加和蛋白质的水解,使其风味和蛋白质消化吸收率均得到改善。酶解技术的催化反应条件温和、生产能耗低,是一种“绿色化学”的生产技术[11],适合工业化生产。但酶解过度又会造成一些功能性质的丧失,酶解时间的控制对蛋白制品的结构和功能起到至关重要的作用[12]。目前,酶解技术对蛋白影响的研究较多,其中关于豆腐干的研究主要集中在风味的改善[13-14]、质构的优化[15]和保藏方法[16]的探索,而酶解技术在豆腐干生产加工的应用和作用机制仍鲜有深入研究。
为进一步探究酶解与豆腐干结构特性的关系,本实验采用风味蛋白酶对制浆工艺中的浆液进行不同程度的酶解,分析酶解技术对浆液巯基含量、二硫键含量、表面疏水性的影响;再将豆浆加工制成豆腐干,通过物性测定仪测定其质构特性,扫描电子显微镜观察其微观结构,低频核磁共振仪测定其水分分布,从而分析酶解时间对豆腐干结构特性的影响;通过测定出品率、持水性、失水率、消化特性和感官特性进而分析酶解时间对豆腐干产品特性的影响,从而探究酶解技术对豆腐干结构和产品特性的影响及作用机制,为豆腐干品质改性和酶解技术在豆制品的应用理论参考。
1 材料与方法
1.1 材料与试剂
‘黑农84’大豆(蛋白质量分数40%) 哈尔滨佰盛粮油有限公司;食用氯化镁 安琪酵母股份有限公司;Flavourzyme500 MG风味蛋白酶(活力不小于20 U/mg) 丹麦诺维信公司;谷氨酰胺转氨酶 江苏一鸣生物股份有限公司;胰蛋白酶 上海翊圣生物科技有限公司;胃蛋白酶 甘肃天森药业有限公司。
1.2 仪器与设备
PQ-001核磁共振仪 上海纽迈电子科技有限公司;DK-S12数显恒温水浴锅 上海三发科学仪器有限公司;DM-Z80自动分渣磨浆机 河北铁狮磨浆机械有限公司;Quanta 200F扫描电子显微镜 美国FEI公司;TA.XT2i型物性测试仪 英国Stable Micro Systems公司;电磁炉佛山市顺德区格兰仕微波炉电器有限公司。
1.3 方法
1.3.1 豆腐干的制备
制备流程:清洗→浸泡→磨浆→过滤→酶解→煮浆→点卤→破脑→压坯→划坯→晾干
取一定质量的大豆,清洗去杂,浸泡,大豆和水的质量比为1∶5,在10~20 ℃下浸泡12~18 h,按大豆和水质量比1∶5磨浆,过滤3 次除渣,风味蛋白酶的添加量为0.12 mg/mL,酶解不同时间(0、10、20、30、40、50、60 min)后,搅抖加热保持沸腾5 min,待温度降至95 ℃时,添加质量分数0.6%的谷氨酰胺转氨酶,于90 ℃加入豆浆质量20%的卤水(1 g/100 mL),静置10~15 min,破脑、压坯、划坯,在105 ℃下进行风干30 min,得不同酶解时间的豆腐干。
1.3.2 浆液指标的测定
1.3.2.1 浆液水解度的测定
取不同酶解时间的样品浆液20 mL,加入质量分数为1%的胃蛋白酶,在37 ℃恒温水浴锅中反应1 h。用0.1 mol/L的NaOH溶液滴定,使其pH值为7,并记录NaOH的消耗量,浆液水解度按公式(1)计算。
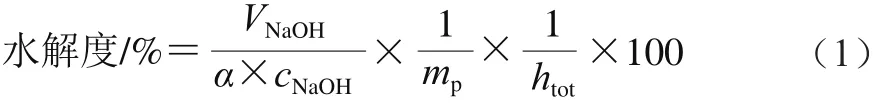
式中:VNaOH为NaOH消耗体积/mL;α为α-NH2基团的解离度;cNaOH为NaOH浓度/(mol/L);mp是蛋白质水解的质量/g;htot为底物蛋白质中肽键总数/(mmol/g)。根据Adler-Nissen[17]的研究结果,htot为7.75 mmol/g,α为0.44。
1.3.2.2 浆液表面疏水性的测定
参考Kato等[18]的8-苯氨基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针法测定蛋白表面疏水性并进行适当修正。用0.1 mol/L的中性磷酸盐缓冲溶液稀释,10 000 r/min高速离心处理0.5 h除去沉淀物,以Lowery法测定上清液中蛋白质量浓度,通过磷酸盐缓冲液的逐步稀释,调控蛋白溶液质量浓度为0.06、0.08、0.10、0.12、0.14 mg/mL,取40 μL浓度为8 mmol/L的ANS溶液滴加至4 mL不同质量浓度的蛋白溶液中,经振荡混匀后静置3 min,在荧光分光光度计下进行荧光强度测试,测试条件为激发波长λex=390 nm,发射波长λem=468 nm,扫描夹缝5 nm,扫描速率10 nm/s。将荧光强度与蛋白质量浓度作线性图,以初始段的斜率计为蛋白的表面疏水性。
1.3.2.3 浆液的巯基和二硫键含量测定
取150 mg蛋白加入10 mL 0.1 mol/L pH 8.0的磷酸盐缓冲液(含有1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和质量分数1% SDS),充分混匀后8 000 r/min离心30 min,利用Lowery法测定上清液蛋白质量浓度。量取3 mL蛋白溶液加入上述磷酸盐缓冲液后,滴入0.1 mL 5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DNTB)溶液(39.6 mg DNTB溶解于10 mL上述磷酸盐缓冲液中制得),充分振荡混合后室温水浴1 h,之后在4 ℃ 8 000 r/min下离心30 min,取上清液,以不加DNTB作为空白对照,在412 nm波长处测定吸光度,以摩尔消光系数13 600 L/(mol·cm)计算游离巯基含量(式(2))。取1 mL蛋白溶液,依次加入0.05 mL β-巯基乙醇及4 mL 0.1 mol/L尿素-盐酸胍混合溶液(5∶8,V/V),充分混合后进行室温1 h水浴处理,之后将10 mL三氯乙酸(12 g/100 mL)加入溶液中,室温水浴处理1 h,再以4 500 r/min离心10 min获取沉淀物,重复上述试剂和水浴处理两次后,将最终沉淀物溶解在10 mL上述磷酸盐缓冲液中,再加入0.08 mL DNTB试剂,剧烈振荡摇匀后在室温条件下水浴处理1 h,再加入10 mL 12 g/100 mL的三氯乙酸,室温条件下水浴处理1 h,将混合溶液在4 ℃、4 500 r/min下离心10 min。蛋白沉淀物再次分散于20 mL 12 g/100 mL的三氯乙酸溶液中,充分离心弃去三氯乙酸,重复3 次上述处理后,4 ℃、4 500 r/min离心30 min。以不加DNTB作为空白对照,测定上清液在412 nm波长处的吸光度,以摩尔消光系数13 600 L/(mol·cm)计算蛋白中总巯基含量(式(2))。二硫键含量按式(3)计算。

式中:A412nm为加Ellman试剂时样品的吸光度;D为稀释系数;ρ为样品蛋白最终质量浓度/(mg/mL)。
1.3.3 豆腐干质构的测定
参考刘铭[20]的方法,并稍作改动,豆腐干用TA.XT2i物性测定仪进行质构测定。用P5探头在豆腐干的中部取样并进行测定。具体参数为:测前速率为5.00 mm/s,测中速率为1.00 mm/s,测后速率为10.00 mm/s,模式为压缩比,压缩比为30%,两次间隔3.00 s,压力为5.0 g,测定豆腐干硬度、凝聚性、咀嚼性、弹性和回复力[21]。
1.3.4 豆腐干微观结构的观察
根据刘铭[20]的方法并略加修改,观察豆腐干微观结构。将待测样品用双面刀切成2 mm×5 mm薄片,用体积分数2.5%、pH 6.8的戊二醛于4 ℃浸泡2.0 h进行固定。然后用不同体积分数(50%、70%、80%、90%和100%)的乙醇脱水,每次10~15 min,之后分别用V(无水乙醇)∶V(纯叔丁醇)=1∶1混合溶液置换一次,每次15 min,用真空冷冻干燥机对样品进行干燥,最后进行喷金,观察时加速电压为20 kV,放大倍数为5 000[22]。
1.3.5 豆腐干保水性的测定
1.3.5.1 豆腐干持水性
根据Puppo等[23]的方法进行测定并稍加修改。称取2 g(精确到0.000 1 g)豆腐干,放入底部有脱脂棉的50 mL离心管中,以1 000 r/min转速离心10 min后称质量并记录(m1),置于105 ℃下干燥至恒质量(m0)[24],按式(4)计算持水性。

1.3.5.2 豆腐干失水率
根据李里特等[22]的方法进行测定,并稍加修改。称取2 g(精确到0.000 1 g)豆腐干,然后用利刃按十字均匀切成4 块,平放在底部为金属网的塑料盒中,每隔5 h称一次质量,共放置30 h。豆腐干每次称量的质量与豆腐干原样品的质量差同豆腐干原样品质量的比例,即为豆腐干的失水率[25]。
1.3.6 豆腐干水分状态的测定
根据Bertram等[26]的方法并稍加修改,采用低场核磁共振弛豫测定样品的横向弛豫时间T2。测定条件:质子共振频率为22.6 MHz,测量温度为32 ℃。豆腐干离心去掉的水分后直接放入直径为25 mm的核磁管中,随后立即放入PQ-001核磁共振仪中进行测定。测定参数为:时间(90°脉冲与180°脉冲之间的时间)为200 s,重复扫描4 次,重复间隔时间为1 000 ms,得到8 000 个回波,所得CPMG指数衰减曲线采用仪器自带的MultiExpInv Analysis软件进行反演得到T2图谱,对各峰面积进行累计积分得到峰面积记为S21、S22及S23,其分别代表T21、T22及T233 个组分水的比例[27-28]。
1.3.7 豆腐干的体外消化测定
根据Dupont等[29]的方法,稍作改动。用体积分数为38%的浓HCl溶液和去离子水配制pH 2.0的稀HCl溶液。将豆腐干压碎并称10 g置于90 mL上述稀HCl溶液中混合,在37 ℃恒温水浴锅中预热10 min,然后加入质量分数为1%的胃蛋白酶,并在37 ℃恒温水浴锅中反应1 h。之后用0.1 mol/L NaOH溶液调节pH值至7.0,加入质量分数为1%的胰蛋白酶,在37 ℃恒温水浴锅中反应2 h。每个样品的消化液取20 mL,在沸水浴中水浴10 min灭酶。实验平行3 组,重复两次。水解开始时,调节pH值为胃蛋白酶的最适值,在反应过程中不断搅抖。胃消化完后,用0.1 mol/L的NaOH溶液滴定,使其pH值为7,并记录NaOH的消耗体积,然后按式(1)计算出大豆蛋白的水解度。
1.3.8 豆腐干的感官评价
豆腐干感官评价见表1。感官评定的标准参考GB 2712—2014《食品安全国家标准 豆制品》[30],感官评价方法主要通过看、闻、尝进行。取4 cm2豆腐干放在90 mm平板中,观察豆腐干的色泽和组织状态,闻其气味,最后置于口中咀嚼豆腐干样品,品尝滋味。样品提供给10 位食品专业人员,按照制定的评分标准打分,计算平均分。

表 1 豆腐干感官评价标准Table 1 Criteria for sensory evaluation of dried tofu
1.4 数据处理与分析
每组实验均重复3 次,结果表示为 ±s,利用SPSS Statistics 22软件对数据进行单因素方差分析进行差异显著性分析,P<0.05为显著性差异。采用Origin 8.5软件对数据、图表进行处理。
2 结果与分析
2.1 酶解对浆液的水解度的影响
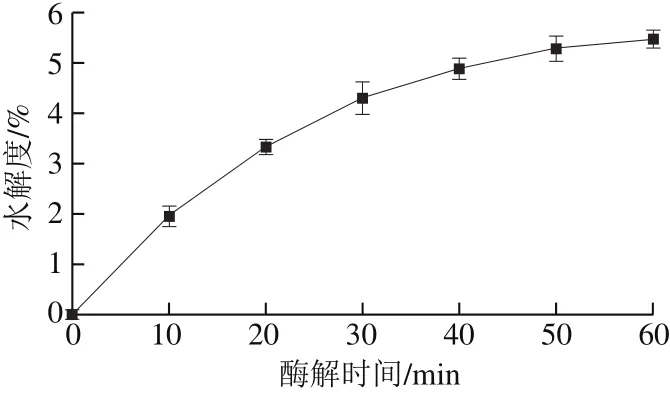
图 1 风味蛋白酶水解不同时间的浆液水解度Fig. 1 Effect of hydrolysis time on degree of hydrolysis of soymilk protein
由图1可知,随着酶解时间的不断延长,浆液的水解度呈逐渐增大的趋势,且当酶解时间达到30 min时,水解度增加趋势逐渐趋于平缓。风味酶作为一种生物催化剂,初期与反应底物充分接触后,能够有效催化蛋白质的分解反应;但随着反应的进行,水解产物不断增加,反应底物减少,酶解反应速率不再上升,并趋于一个极限值。
2.2 酶解对浆液表面疏水性的影响

图 2 不同酶解时间对浆液表面疏水性的影响Fig. 2 Effect of hydrolysis time on surface hydrophobicity of soymilk
由图2可知,随着酶解时间的延长,浆液的表面疏水性呈现先增大后减小的趋势,且在酶解时间为30 min时表面疏水性达到最大,这与适当酶解可暴露浆液的疏水性基团有关。研究表明,酶解过程对蛋白的影响具有双向性。在酶解初期,蛋白质发生解聚,掩盖在分子内部的疏水性基团暴露,疏水相互作用增强;当酶解时间为30 min时,蛋白结构充分打开,会暴露出大量的疏水性残基,表面疏水性达到峰值,蛋白处于展开与交联的临界点[31];而随着酶解时间延长,蛋白质的分子构象进一步发生改变,水解产物之间重新折叠形成能量较低的新构象,促使疏水性氨基酸被隐藏,进而导致水解产物表面疏水性降低[32-34]。
2.3 酶解对浆液的巯基和二硫键含量的影响
由图3可知,随着酶解时间的延长,二硫键、总巯基和游离巯基含量均呈现先增大后减小的趋势,且在酶解时间为30 min时,二硫键含量达到最大值,而总巯基和游离巯基含量在酶解10 min时达到最大值,这表明酶解时间对巯基含量具有显著影响。在酶解初期,蛋白部分结构发生变化,二硫键断裂形成巯基暴露到分子表面[35],总巯基和游离巯基含量增加。随着酶解时间的延长,蛋白分子可能发生聚集,蛋白质中的活性巯基易被氧化生成二硫键[36](形成二硫键或其他形式的物质)并发生脱巯基反应,造成游离巯基和总巯基含量减少[37],而二硫键含量增加。随着酶解的继续进行,重新聚集的网络结构会被破坏,形成了分子质量较大的肽段,且酶解时间越长肽键越短,同时,二硫键、总巯基和游离巯基含量降低[38],而二硫键的形成和浆液形成凝胶的质构特性密切相关。此结果和Zhao Guanli等[39]所研究碱性蛋白酶水解花生分离蛋白的结果相一致。

图 3 不同酶解时间对浆液巯基和二硫键含量的影响Fig. 3 Effect of hydrolysis time on the contents of sulfhydryl groups and disulfide bonds in soymilk protein
2.4 酶解对豆腐干质构特性的影响
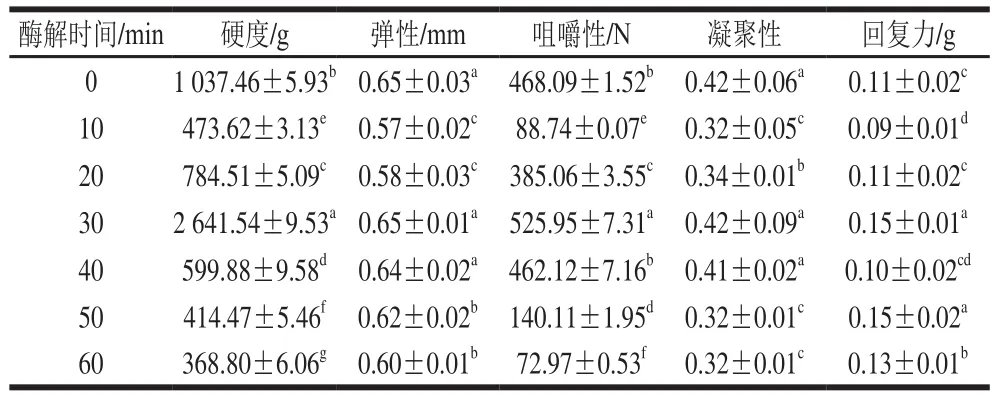
表 2 酶解时间对豆腐干质构特性的影响Table 2 Effect of hydrolysis time on texture of dried tofu
由表2可知,随着酶解时间的延长,豆腐干的硬度、弹性、咀嚼性、凝聚性和回复力呈现先增大后减小的趋势,且在酶解时间为30 min时达到最大,这表明酶解时间对豆腐干的结构特性影响是双向的。豆腐干结构特性的改善与凝胶弹性和硬度的增强取决于蛋白间的疏水相互作用、非共价相互作用强度[40],而疏水相互作用、非共价相互作用的增强需要提高疏水基团的暴露量和二硫键的形成量,研究表明酶解可使浆液中蛋白主链结构展开并发生断裂,促进疏水基团的暴露和二硫键的形成[41]。但当酶解时间过大,蛋白分子链断裂严重,其粒径过小,不易形成网状组织结构,并且分子间相互作用减小,进而导致豆腐干内部结构较差和质构特性减弱[6]。这和酶解时间对浆液的影响结果相一致。
2.5 酶解对豆腐干微观结构的影响

图 4 豆浆酶解不同时间后所制成豆腐干的扫描电子显微镜图Fig. 4 Scanning electron micrographs of dried tofu made from soymilk hydrolyzed for different durations
由图4可知,随着酶解时间的延长,豆腐干的网状结构孔径呈现先减小后增大的趋势,致密性先增大后减小,且在酶解时间为30 min时,孔径最小、网状结构均匀致密。蛋白分子链间的的疏水作用是形成凝胶网状结构的基础[42],蛋白质分子质量和体积可影响凝胶的微观结构[4]。经过适度酶解后,大豆蛋白的疏水相互作用力增强[43],巯基和二硫键含量增多,促进了凝固剂对蛋白质的诱导聚集和肽链间结合程度的增强,使豆腐干的网状结构更加致密和孔径减小[41]。但过度酶解会引起蛋白分子质量减小,肽链变短,破坏蛋白的内部结构,弱化分子间的作用,进而减弱维持凝胶结构的作用力[6],使豆腐干的组织结构松散。豆腐干网状结构的致密性和均一性可直接影响豆腐干硬度、弹性,蛋白结合越紧密,硬度越大且弹性越好,当凝胶结构的作用力减小时,组织结构松散,硬度和弹性也减小,这和质构的研究结果相一致。
2.6 酶解对豆腐干的持水性和失水率的影响
由图5可知,随着酶解时间的延长,豆腐干持水性呈现先上升后下降的趋势,且在30 min时达到峰值;由图6可知,随着酶解时间的延长,同一样品的失水率呈现增大趋势,且在酶解时间为30 min时增大趋势较为缓慢;不同样品在同一放置时间,样品的失水率随酶解时间的延长而呈现先减小后增大趋势,且在酶解时间为30 min时达到最低。持水性和失水率直接影响着豆腐干的卤制口感、加工特性和货架期[44]。豆腐干的持水性取决于网状结构中蛋白和水之间的水合作用和凝胶的空间结构。所失水分通常是部分自由水和不易流动水,这两种水分状态分别受凝胶网状结构的致密程度与蛋白-蛋白之间结合紧密程度的影响较大[45]。凝胶结构的致密程度取决于巯基和疏水性基团的数量[46],而蛋白-蛋白之间结合紧密程度与极性基团的暴露量密切相关。研究表明,浆液经过适度酶解后,促使蛋白结构被打开,进而提高巯基基团和疏水性基团的暴露量[41],促使蛋白疏水作用增强,进而增强豆腐干网状结构的致密性和均一性,提高豆腐干的弹性和回复性;巯基基团和疏水性基团暴露的同时游离出氨基和羧基,蛋白分子结合水的能力提高[47],进而影响部分不易流动水包埋量。当施加一定的外力时其空间容量不变,结构的扭曲挤压不能排出其中的水分,从而使豆腐干的持水性增强,失水率降低。但是过度酶解会导致网状结构遭到破坏,维持网状结构的作用力被弱化,持水性降低和失水率增多。

图 5 豆腐干在不同酶解时间下的持水性Fig. 5 Water-holding capacity of dried tofu made from soymilk hydrolyzed for different durations
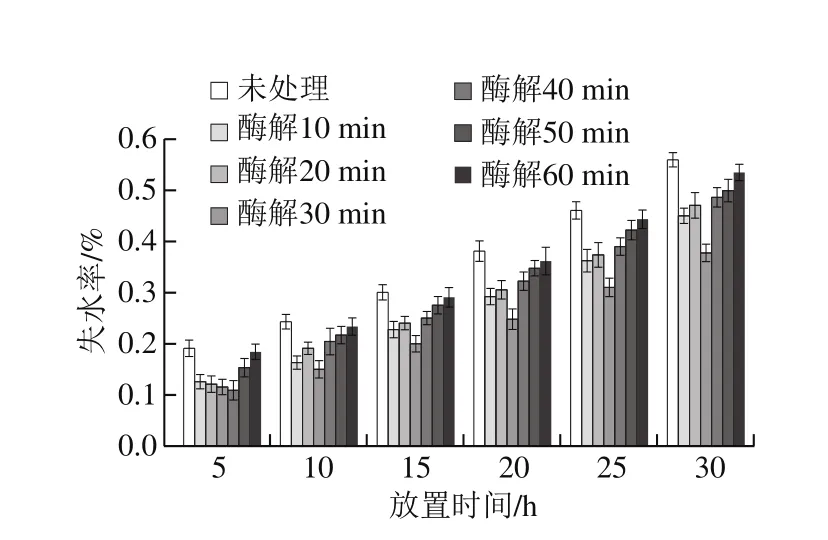
图 6 豆腐干在不同放置时间下的失水率Fig. 6 Water loss rate during storage of dried tofu made from soymilk hydrolyzed for different durations
2.7 酶解对豆腐干的水分分布状态的影响
低场核磁共振可通过检测豆腐干中氢质子的弛豫时间来表征豆腐干中的水分状态和水分分布,图7a为整体水分分布图,3 个峰分别对应为结合水(T21,0.50~0.92 ms)、不易流动水(T22,13.35~24 ms)和自由水(T23,132.08~240.1 ms)[20,48],峰面积为S21、S22、S23。弛豫时间表征豆腐干失去水分的能力,弛豫时间越长,质子的自由度越大[49],水分子组分与大分子的结合越松散[50],水分越容易被排出。峰面积表征不同水分状态下,水分的含量,且峰面积越大则水分含量越多。

图 7 豆腐干的低场核磁共振图像Fig. 7 Low-field nuclear magnetic resonance images of dried tofu made from soymilk hydrolyzed for different durations
由图7c可知,随着酶解时间的延长,弛豫时间T22和S22呈先减小后增大趋势,且当酶解时间为30 min时,T22最短、S22最大。不易流动水存在于微观结构中一些较小的间隙中,受蛋白质结构影响较大。不易流动水的变化趋势表明随着酶解时间的延长,蛋白-蛋白之间的交联作用增强,蛋白质网络结构逐渐致密,缩短蛋白质网络表面与水分子的距离,降低了T22,提高了不易流动水的禁锢量。但随着酶解时间持续延长,弱化了蛋白-蛋白间的作用力,进而使不易流动水的包埋量减少。
由图7d可知,随着酶解时间的延长,弛豫时间T23和S23呈先减小后增大趋势,且当酶解时间为30 min时,T23最短、S23最大。自由水存在于豆腐基质中较大孔径的孔洞之中,受蛋白质结构影响较小。豆腐干的网状结构由大小不一的孔洞和网孔组成,由扫描电子显微镜的观察结果可知,浆液经过适当的酶解后制成的豆腐干,其空洞和网孔形成更加紧密均一。豆腐干凝胶的形成与蛋白颗粒的大小、疏水相互作用与二硫键含量有关[51],随着酶解时间的延长,蛋白质逐渐解聚,疏水性基团的暴露促进了二硫键的形成或交换,致密的网状结构提供了较多自由水的储存空间,自由水含量增多。但随着酶解时间的逐渐延长,蛋白分子间的作用力逐渐弱化,网状结构不易形成,对自由水的禁锢能力减弱,自由水含量减少。以上结果进一步证明,适宜的酶解可显著改善豆腐干的持水性和失水率。
2.8 酶解对豆腐干的体外消化率的影响

图 8 酶解豆腐干的体外消化率Fig. 8 Effect of hydrolysis time on in vitro digestibility of dried tofu
由图8可知,随着酶解时间的延长,体外消化率呈增大趋势,当酶解时间超过30 min后,体外消化率增加程度减慢直至平缓,这表明经风味酶酶解后浆液制成的豆干,酶解时间越长体外消化能力越强,且在酶解时间超过30 min后体外消化率趋于一稳定数值不变。经过碾碎的豆腐干样品溶于消化液中体外模拟人体消化,消化液中的酶作用于形成凝胶结构的蛋白质中。与未经酶解相比,酶解预处理得到的豆腐干蛋白结构被打开,分子质量降低,更易被其他酶所酶解[13],因此增加了体外消化率,且更易被人体所消化吸收。不同酶解时间的蛋白随着水解度的增大,其体外消化率逐渐升高[52]。因此适度酶解对蛋白质产品的营养价值有明显的提高效果,而且更利于人体吸收,尤其是对消化功能较差的人群(如老人、小孩等),消化率的提高有利于其吸收优质蛋白质中的营养成分。
2.9 酶解对豆腐干感官评价的影响
由图9、表3可知,随着酶解时间的延长,豆腐干的感官评分呈现先上升后下降的趋势,且当酶解时间为30 min时,豆腐干总感官评分最高。收集感官评定人员信息得到,酶解30 min时的豆腐干形状规则,薄厚和颜色均匀,口感细腻光滑,弹性和韧性足,翻折不易断裂,有较好的咬合力,软硬适中,气孔细密均匀,结构细腻,质地均匀无凹陷,豆味较浓,无异味。而当酶解时间长于30 min时,豆腐干口感松散,弹性和韧性较差,易断裂。因此,当酶解时间为30 min时,豆腐干的感官效果最佳。这与2.4节中质构研究结果一致,表明豆腐干的口感与豆腐干内部结构和质构特性紧密相关。

图 9 不同酶解时间对豆腐干感官品质的影响Fig. 9 Effect of hydrolysis time on sensory evaluation of dried tofu

表 3 豆腐干的感官评分结果Table 3 Sensory scores of dried tofu made from soymilk hydrolyzed for different durations
3 结 论
本实验采用风味蛋白酶酶解技术调控制浆工艺制备豆腐干产品,研究酶解技术对豆腐干品质和结构特性的影响。结果表明:随着酶解时间的延长,浆液的水解度、表面疏水性、巯基含量和二硫键含量发生显著改变。且在酶解时间30 min时,较未酶解样品总巯基和游离巯基含量降低,水解度、表面疏水性和二硫键含量显著提高。这表明酶解使大豆蛋白迅速降解,形成小分子多肽,暴露了大量的内部疏水性基团和极性分子,增大了蛋白-蛋白之间的作用力,促使豆腐干凝胶的形成。
随着酶解时间的延长,豆腐干的质构特性、微观结构、水分分布和消化特性明显改善,且当酶解时间为30 min时,持水性和体外消化速率提高,而失水率降低。这表明酶解技术对豆腐干结构和品质具有明显的改善作用,从而为豆腐干的品质改性和酶解技术在豆制品的应用提供了理论参考。

