黄酒非生物稳定性的预测模型
谢广发,陆 健,孙军勇,,陆 胤,彭 祺,钱 斌,金建顺,王 兰,傅祖康,鲁振东,刘彩琴
(1.浙江树人大学生物与环境工程学院,浙江 绍兴 312028;2. 浙江树人大学绍兴黄酒学院,浙江 绍兴 312028;3.江南大学生物工程学院,江苏 无锡 214122;4.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;5.国家黄酒工程技术研究中心,浙江 绍兴 312000;6.会稽山绍兴酒有限公司,浙江 绍兴 312000)
黄酒是一种胶体溶液,在受到外界条件温度、光照、pH值、氧等因素影响时,胶体溶液稳定性容易受到破坏,从而使其中的某些物质析出,造成非生物混浊[1-2]。非生物混浊在酿造酒中普遍存在[3-4],而黄酒的混浊和沉淀问题比其他酿造酒更加严重[5]。蛋白质是已知影响黄酒非生物混浊的最大因素之一[6],瓶装黄酒沉淀中蛋白质量分数为50.56%[7],但有关研究认为,混浊的形成与总蛋白含量并没有直接的因果关系,而可能与黄酒中的某类特殊蛋白质相关[8],多酚和铁离子含量等也对酒体的非生物稳定性有影响[9],敏感多酚和敏感蛋白的相互作用是影响黄酒非生物混浊的主要原因[10]。
目前黄酒行业没有统一的非生物稳定性检测方法,文献报道用于黄酒非生物稳定性预测的方法有低温存放法[11]、热处理法[12-14]、冷热循环法[15]和乙醇-浊度法[16-17],其中研究最多的为冷热循环法。白少勇[15]采用冷热循环法测定酒样处理前后的浊度,条件为0 ℃放置24 h、60 ℃放置24 h,两个循环,恢复室温后进行测定;江超[18]通过60 ℃水浴12 h、4 ℃放置12 h,以循环3 次后的浊度差来判断黄酒非生物稳定性;高恩丽等[19]用60 ℃放置24 h、0 ℃放置24 h循环处理黄酒,4 d后在55~60 ℃下测定浊度;姬中伟等[20]采用-5、45 ℃交替存放50 d后,比较酒体的混浊程度来判断酒体的稳定性;陈玲等[21]采用85 ℃放置0.5 h、0 ℃放置0.5 h,20 个循环后观察混浊情况。实际应用中发现,这些预测方法与黄酒自然存放过程中的稳定性存在较大差异,不能很好地预测黄酒的稳定性。因此,通过对各种黄酒稳定性的评价及与稳定性相关的理化指标的分析,建立一种更准确实用的稳定性预测方法,有利于稳定性处理效果的评价和生产指导,避免货架期间因酒体混浊而引起退货返工。
1 材料与方法
1.1 材料与试剂
黄酒样品主要购自当地超市,产地主要为上海、浙江、江苏等,样品具体信息见表1。

表 1 黄酒样品基本信息Table 1 Information about Chinese rice wine samples tested in this study
乙腈、胰蛋白酶、α-氰基-4-羟基肉桂酸、碳酸氢铵、三氟乙酸 美国Sigma公司;30%丙烯酰胺单体储液、三羟甲基氨基甲烷、十二烷基硫酸钠(sodium dodecyl sulphate,SDS)、甲叉双丙烯酰胺、N,N,N’,N’-四甲基乙二胺、牛血清白蛋白、过硫酸铵、考马斯亮蓝R-250、β-巯基乙醇、丙酮、尿素、三氯乙酸、蛋白分子质量标准品、N-三(羟甲基)甘氨酸 生工生物工程(上海)股份有限公司;盐酸羟胺、邻菲啰啉、Folin-Ciocalteu试剂、聚乙烯吡咯烷酮、乙酸钠、没食子酸、单宁酸、硫酸亚铁铵 国药集团化学试剂公司。
1.2 仪器与设备
MPG-100H低温加热循环槽 上海一恒科学仪器有限公司;JD-801凝胶成像系统 江苏捷达科技发展有限公司;Mini-Protein 3 Cell蛋白电泳系统) 美国Bio-Rad公司;WGZ-2-PJ型浊度计 上海昕瑞仪器仪表有限公司;KT260凯氏定氮仪 丹麦Foss有限公司;Ultraflextreme基质辅助激光解吸/电离飞行时间质谱仪德国Bruker公司。
1.3 方法
1.3.1 黄酒混浊样品制备
将瓶装黄酒或经非生物稳定性处理后的黄酒静置5 d,采用虹吸法将上清酒液去除,留下底部约80 mL酒样,振荡混匀后,12 000 r/min离心30 min,收集混浊沉淀。再将收集的沉淀悬浮于超纯水,12 000 r/min离心30 min,重复上述过程。超纯水洗涤两次后的沉淀用体积分数2%氨水溶解,添加硫酸铵粉末达到80%饱和度,然后用1 000 Da的透析袋于4 ℃下脱盐48 h,最后冷冻干燥,即得到混浊蛋白样品[22]。
1.3.2 混浊蛋白的聚丙烯酰胺凝胶电泳
SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)按照文献[22-23]中的方法进行,将样品蛋白溶于pH 7.0的0.05 mol/L Tris-HCl溶液中,通过Bradford法测定蛋白质量浓度以确定上样量。采用的分离胶质量分数为12%,采用的浓缩胶质量分数为4%。电泳结束后将凝胶固定30 min后,在染色液(考马斯亮蓝R-250)中染色30 min,脱色液脱色至背景清晰,采用JD-801凝胶成像仪对凝胶拍照,图片通过捷达801图像分析软件3.3分析。
1.3.3 混浊蛋白的基质辅助激光解吸/电离飞行时间质谱分析
参考文献[24]对混浊蛋白进行基质辅助激光解吸/电离飞行时间质谱分析,切取凝胶上的蛋白条带,用含有100 mmol/L碳酸氢铵的体积分数30%乙腈溶液洗涤胶粒直至无色。加入50 μL无水乙腈使胶粒脱水呈现白色。向EP管中加入5 μL稀释后的胰蛋白酶溶液,使胶粒完全吸收酶液(置于4 ℃冰箱中30~60 min),吸掉多余胰蛋白酶溶液,加入25 mmol/L碳酸氢铵溶液20 μL,37 ℃保温16~20 h。将酶解液转移到新离心管中,旋转真空浓缩至约3 μL。取0.7 μL样品点样,干燥后加0.7 μL基质,干燥后通过质谱仪对点靶样品进行质谱分析。采用正离子反射模式与自动获取数据模式采集一级质谱数据,扫描范围为700~3 500 Da。选取信号强度好的一级质谱峰进行二级质谱分析,使用BioTools软件进行整合,用Mascot软件在美国国家生物信息中心(National Center for Biotechnology Information,NCBI)数据库中进行全物种质谱数据搜索。
1.3.4 黄酒非生物稳定性实验
冷热循环法:黄酒样品0 ℃放置12 h后80 ℃放置12 h,计为一个循环,每完成一个循环,测定样品浊度,记录浊度增加4 NTU所需循环数,记为∆4 NTU循环数。
热稳定性实验:根据Hsu等[25]的方法稍作修改,取酒样50 mL,90 ℃水浴6 h,冷却至室温,测定热处理前后的浊度,计算浊度增加量,以浊度的增加量表示,单位为NTU。浊度的增加量越大,酒体的稳定性越差。
冷冻实验参考文献[15]:将黄酒样品在0 ℃条件下存放12 h,测定冷冻后样品的浊度,单位为NTU。
乙醇-浊度测定参考文献[15]:取黄酒酒样50 mL,加入无水乙醇25 mL,振荡混匀,2 h后测定浊度,以添加乙醇前后浊度增加量表示,单位为NTU。
自然存放:将酒样存放于自然条件下,记录初始浊度以及自生产日期开始后第9、12个月的样品浊度。
1.3.5 混浊相关指标的测定
黄酒混浊相关理化指标敏感蛋白、敏感多酚、总酚、儿茶素、隆丁区分和铁离子的测定参照文献[24],其中敏感蛋白含量以添加单宁之后浊度的变化量表示,敏感多酚含量以添加聚乙烯吡络烷酮(polyvinyl pyrrolidone,PVP)之后浊度的变化量表示,单位均为NTU。
1.4 数据处理与分析
所有实验数据均测定3 次,取平均值。采用SPSS 18.0软件进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同非生物稳定性预测方法中析出蛋白质的SDS-PAGE分析结果
目前,用于酒类非生物稳定性快速预测的方法主要有冷热循环法、热处理法、乙醇浊度法和冷冻实验法。在本研究中,对不同的预测方法中析出的蛋白质与自然沉淀中的混浊蛋白进行对比,以选择能较准确预测非生物稳定性的预测方法。
采用不同的稳定性实验方法处理瓶装黄酒,处理结束后收集沉淀物,按照1.3.1节中的方法提取蛋白质,将不同稳定性实验方法中析出的蛋白与收集的瓶装酒中自然沉淀蛋白分别上样进行SDS-PAGE,结果见图1。
两种不同的酒样中,自然沉淀蛋白质都主要分布在14.4 kDa(条带b1和c2)和27 kDa(条带a1和b2),与孙军勇等[26]研究发现黄酒混浊蛋白主要分布在13~16 kDa和28~55.4 kDa之间的结果一致。Schulte等[27]研究发现形成啤酒混浊的蛋白,主要是分子质量为16.5 kDa和30.7 kDa的糖蛋白。通过对比发现,冷热循环法和热处理法沉淀蛋白与自然沉淀蛋白的分布相同,也集中在14.4 kDa和27 kDa处。冷冻实验法和乙醇-浊度法析出的主要蛋白分别是a2~c2和a1~c1。样品A中析出的蛋白比自然沉淀蛋白多出了条带c1(分子质量为8.0 kDa);在样品B中,多沉淀出了分子质量为34.4 kDa的条带a2。经软件计算,乙醇浊度法沉淀蛋白中的c1和a2,分别占总沉淀蛋白的40.2%和23.7%,这说明乙醇浊度法沉淀蛋白与自然沉淀蛋白的成分不同,并且各成分所占的比例也差异明显;冷冻实验法沉淀蛋白中的a2占总沉淀蛋白的38.6%,与自然沉淀蛋白成分相同的蛋白质总含量仅为61.4%,这与混浊蛋白的成分组成有很大差别。
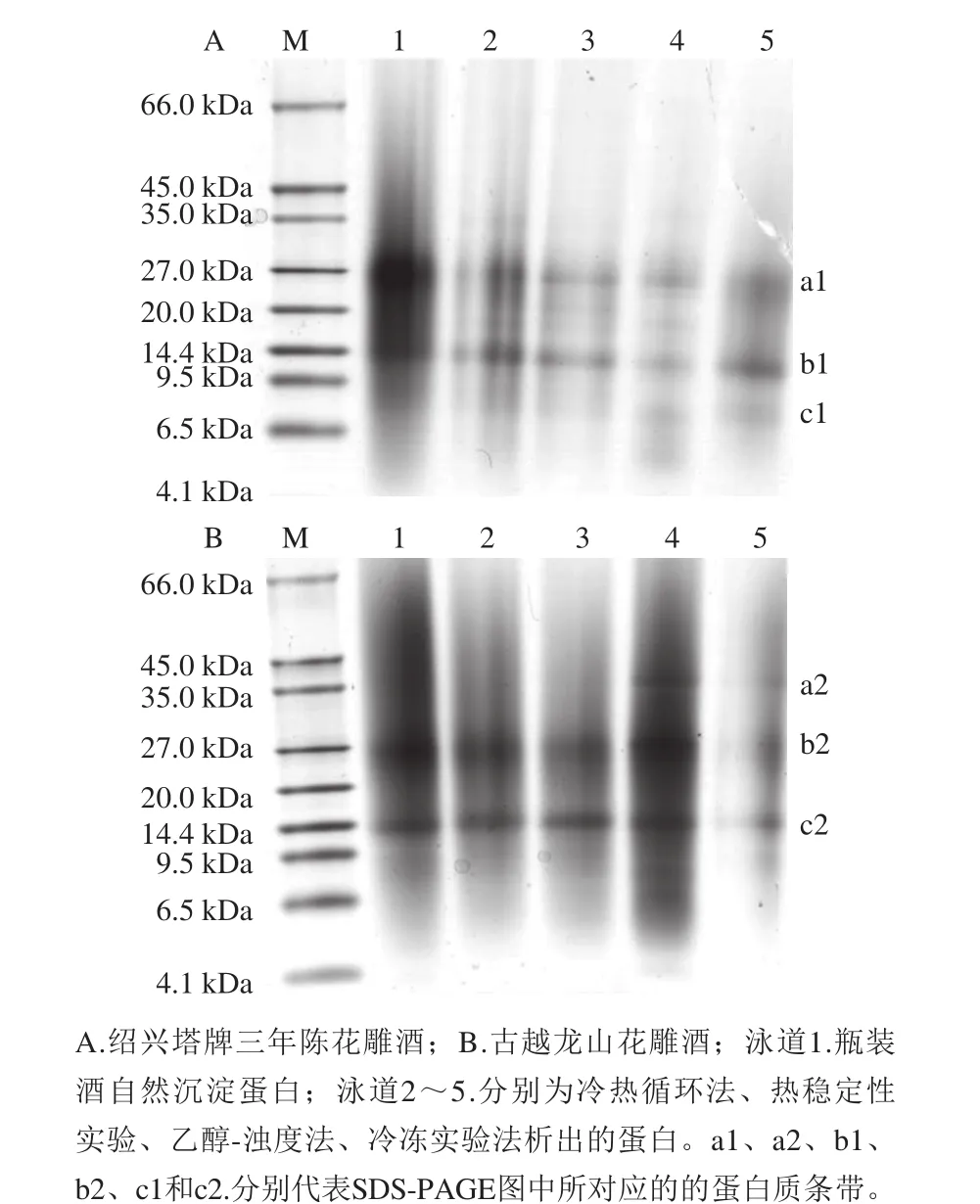
图 1 不同稳定性实验方法沉淀出的蛋白质Fig. 1 SDS-PAGE of precipitated proteins in different stability tests
挖取条带a2和c1进行质谱鉴定,鉴定结果分别为丝氨酸蛋白酶抑制剂-Z1C和病程相关蛋白-4(pathogenesis related protein-4,PR-4)。PR蛋白能抵抗糖苷酶、蛋白酶、尿素、重金属、高温(60 ℃)和低pH值[28-30],PR-4蛋白是一个具有保守Barwin结构域的病程相关蛋白家族,除了对病原微生物的应激反应外,水稻PR-4基因还涉及非生物应激反应和耐受性[29]。PR-4是混浊蛋白的组成成分之一[31-33],但是从混浊蛋白的电泳图谱可以看出,PR-4的条带颜色较浅,说明其在混浊蛋白中的含量很低,不是混浊蛋白主要的组成部分。丝氨酸蛋白酶抑制剂-Z1C来源于小麦,并不是混浊蛋白的组分,但在乙醇浊度实验和冷冻实验中析出,说明它可能是一种低醇溶性和低温下溶解度降低的蛋白质,它的存在说明这两种预测方法不能准确地预测黄酒的非生物稳定性。
综上,不同的稳定性实验方法沉淀出的蛋白质都含有14.4 kDa和27.6 kDa这两个条带,与混浊蛋白的分布相符,但乙醇浊度法和冷冻法所沉淀蛋白的种类和组成都与自然沉淀蛋白有较大差异,因此,这两种方法不能准确反映黄酒的非生物稳定性,而冷热循环法和热处理两种方法所沉淀蛋白质与混浊蛋白分布一致,可以用于预测黄酒的非生物稳定性。
2.2 黄酒蛋白非生物稳定性相关指标与不同预测方法相关性分析结果
黄酒在存储过程中发生蛋白质混浊,从而影响黄酒的外观和销售,黄酒中的一些成分与蛋白质混浊相关,例如一些蛋白类、多酚类和金属离子。为了更好地预测黄酒蛋白混浊情况,本研究通过对各黄酒样品的蛋白质混浊相关指标进行测定,并且采用冷热循环法和热处理法快速反映黄酒的非生物稳定性,分析各项混浊指标与非生物稳定性的关系。
2.2.1 黄酒样品蛋白类混浊指标及稳定性实验分析结果
选取20 种不同产地、不同类型的黄酒样品,测定其在生产日期1 个月内的各项蛋白质混浊相关指标并进行稳定性实验,结果见表2、3;各项指标的统计性描述结果见表4。

表 2 黄酒样品的敏感蛋白、总氮及隆丁分区Table 2 Concentrations of sensitive protein and total nitrogen and Lundin composition in Chinese yellow wine

表 3 黄酒样品多酚类指标、铁离子及稳定性实验的测定结果Table 3 Concentrations of polyphenols and iron ions and stability evaluation of Chinese yellow wine
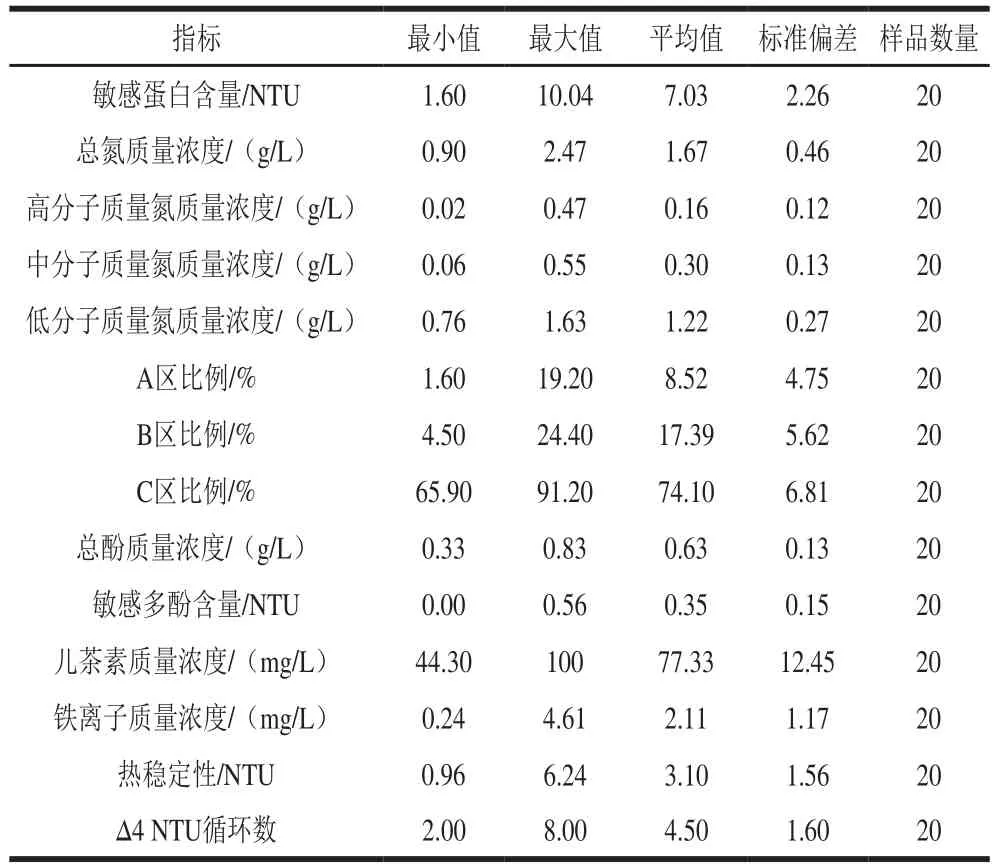
表 4 黄酒样品蛋白质混浊相关理化指标及稳定性实验统计性描述Table 4 Statistical description of physicochemical indexes related to turbidity and stability of Chinese yellow wine
2.2.2 黄酒样品蛋白类混浊指标与稳定性实验结果相关性分析结果
将购买的每一种黄酒分成两份,一份用于测定蛋白混浊相关指标及其初始浊度,并且进行稳定性实验,另一份存放于自然条件下,定时测定其浊度并观察混浊情况。利用SPSS 18.0软件对测定的各项指标、稳定性实验结果和自然存放后的浊度进行分析,以期建立更准确地预测黄酒非生物稳定性的方法。
采用SPSS 18.0软件对20 种黄酒的蛋白类混浊指标与不同稳定性实验的结果进行Pearson相关性分析。从表5可以看出,与冷热循环法相关性最显著的蛋白类混浊指标为中分子质量氮质量浓度,呈极显著负相关(r=-0.647,P<0.01),其次为中分子质量氮占总氮的比例(B区比例)(r=-0.559,P<0.05)和敏感蛋白含量(r=-0.477,P<0.05),均呈现为显著负相关;对黄酒样品的热稳定性进行分析,发现相关性最显著的蛋白类指标同样也是中分子质量氮质量浓度,呈极显著正相关(r=0.694,P<0.01),另外与总氮质量浓度呈极显著正相关(r=0.691,P<0.01),其次为低分子质量氮比例(C区比例)和低分子质量氮质量浓度(r=-0.645,P<0.01;r=0.632,P<0.01)。
由表5可知,冷热循环法与中分子质量氮相关指标和敏感蛋白含量显著相关,而热稳定实验法与总氮质量浓度、高分子质量氮质量浓度、中分子质量氮质量浓度、低分子质量氮质量浓度、C区比例等众多指标显著相关。混浊蛋白的分子质量分布在13~56 kDa,属于中分子质量氮(12~60 kDa)[26]。酒体中的大分子质量蛋白质经过发酵、压滤、澄清和煎酒过程,绝大多数已被去除,中、低分子质量的蛋白在受到外界环境影响时,是形成混浊的主要原因[4]。因此,冷热循环法能更准确地反映黄酒的非生物稳定性,并且中分子质量氮质量浓度与其显著相关,可以用于黄酒非生物稳定性预测模型的建立。

表 6 黄酒样品蛋白质混浊相关多酚类、铁离子及稳定性实验相关性分析Table 6 Correlation between turbidity-related polyphenols, iron ions and stability of Chinese yellow wine
从表6中可发现,∆4 NTU循环数与多酚类指标和铁离子质量浓度的相关性不显著,热稳定性与总酚质量浓度和敏感多酚浊度有一定的相关性。
2.3 自然存放酒样混浊情况统计结果
将购买的20 种酒样存放于自然条件下,定期观察其混浊情况并测定浊度,从生产日期开始计算至自然存放9 个月的和12 个月的浊度及混浊情况如表7所示。在存放的过程中,黄酒的浊度越来越大,混浊程度越来越严重。对样品的混浊情况分布进行分析(图2),存放9 个月时,约30%的样品出现严重混浊,存放到12 个月时,50%的样品出现严重混浊,在瓶底形成一层沉淀,严重影响外观品质。

表 7 自然存放不同时间黄酒的混浊情况Table 7 Change in turbidity of Chinese yellow wine during ambient storage
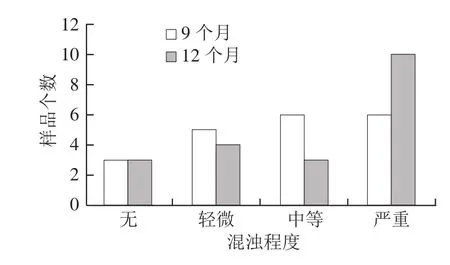
图 2 黄酒混浊情况频数分布图Fig. 2 Turbidity distribution of Chinese yellow wine during ambient storage
在本研究中,将黄酒混浊程度共分为4 个等级:无混浊、轻微混浊、中等混浊及严重混浊。为了更好地将浊度与混浊情况对应起来,对表7中酒样的浊度与混浊情况进行统计分分类,结果见表8。
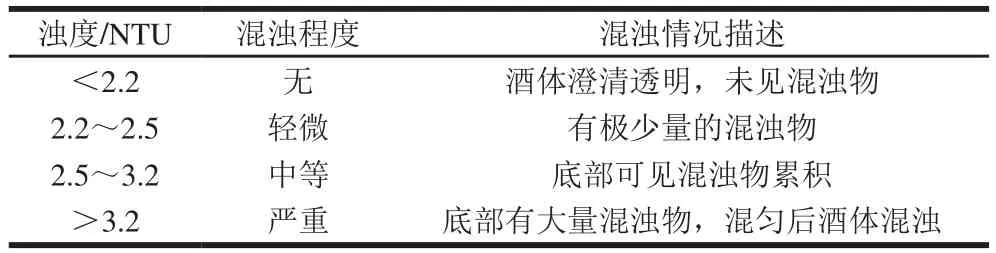
表 8 黄酒混浊程度分类Table 8 Turbidity rating of Chinese yellow wine
2.4 黄酒非生物稳定性预测方法的建立
2.4.1 黄酒样品浊度与各项混浊指标和稳定性实验相关性分析结果
黄酒在存放的过程中除了受到温度变化、振动、光照和氧化等因素影响外,酒体成分中的混浊相关物质也会影响黄酒的浊度变化。将20 种酒样自然存放9 个月和12 个月的浊度与稳定性实验及各项蛋白混浊指标进行相关性分析,结果如表9~11所示。
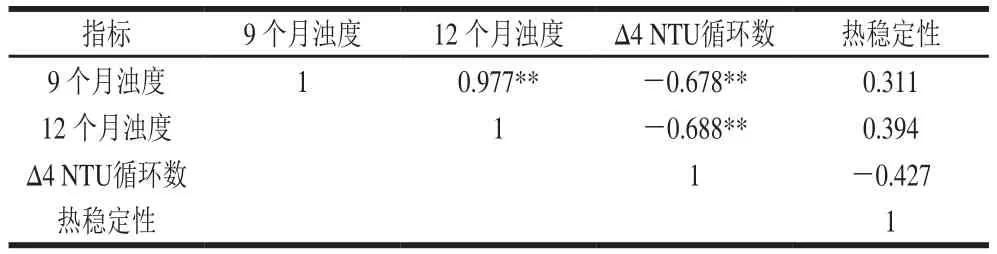
表 9 自然存放酒样浊度与稳定性实验相关性分析Table 9 Correlation analysis between stability and turbidity of Chinese yellow wine
从表9中可以看出,自然存放9、12 个月酒样的浊度与冷热循环法∆4 NTU循环数极显著负相关(r=-0.678,P<0.01;r=-0.688,P<0.01),而与热稳定性相关性不显著。因此,∆4 NTU循环数可以用于非生物稳定性预测模型的建立。

表 10 自然存放酒样浊度与蛋白类混浊指标相关性分析Table 10 Correlation analysis between protein and nitrogen indexes and turbidity of Chinese yellow wine stored under ambient conditions
根据表10可知,黄酒样品存放9 个月浊度与敏感蛋白含量、总氮质量浓度、低分子质量氮质量浓度呈显著相关,存放12 个月浊度与敏感蛋白含量、总氮质量浓度、中分子质量氮质量浓度和低分子质量氮质量浓度显著正相关,因此敏感蛋白含量、总氮质量浓度、中分子质量氮质量浓度和低分子质量氮质量浓度也能够用于非生物稳定性预测模型的建立。
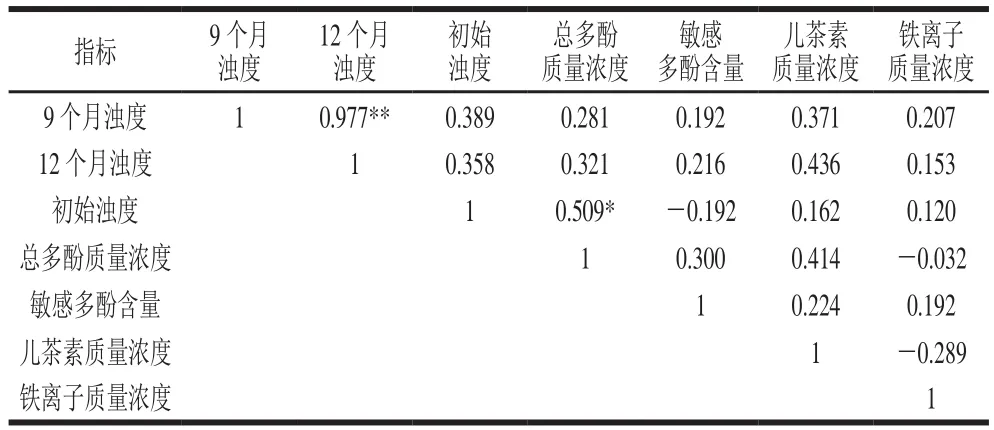
表 11 自然存放酒样浊度与初始浊度、多酚类指标和铁离子含量相关性分析Table 11 Correlation analysis between initial turbidity, polyphenols contents and iron ion content and turbidity of Chinese yellow wine stored under ambient conditions
从表11可知,黄酒样品分别存放9 个月和12个月后的浊度与样品的初始浊度相关性并不显著,因此不能根据初始浊度来判断黄酒的非生物稳定性,并且其与多酚类指标和铁离子质量浓度的相关性也不显著,因此不用于预测模型的建立。
2.4.2 黄酒非生物稳定性多元回归预测模型的建立
通过对黄酒样品自然存放浊度与各蛋白质混浊相关指标和稳定性实验之间的相关性进行分析,选取与自然存放酒样浊度显著相关的指标和稳定性实验方法,利用SPSS 18.0软件进行多元线性回归分析,建立预测黄酒自然存放12 个月后浊度的模型,模型分析结果如表12所示。模型的相关系数0.805,决定系数R2为0.648。模型的F检验值为5.155,P值为0.007,达到极显著水平,符合统计学意义上的要求。

表 12 模型的方差分析Table 12 Analysis of variance of the regression model
根据上文对自然存放9、12 个月浊度与各蛋白质混浊相关指标和稳定性实验之间的相关性分析,选取与浊度显著相关的∆4 NTU循环数、敏感蛋白含量、总氮质量浓度、低分子质量氮质量浓度、中分子质量氮质量浓度为模型自变量,以存放12 个月的浊度为因变量,建立多元线性回归方程,预测存放12 个月后黄酒的浊度,模型的相关参数如表13所示。最终模型的回归方程如下式所示。
Y1=2.79-0.485X1+0.663X2+0.327X3+1.577X4-3.864X5
式中:Y1为自然存放12 个月浊度/NTU;X1为∆4 NTU循环数;X2为敏感蛋白含量/NTU;X3为总氮质量浓度/(g/L);X4为低分子质量氮质量浓度/(g/L);X5为中分子质量氮质量浓度/(g/L)。

表 13 建立模型的回归参数分析Table 13 Coefficient analysis of the regression model
将各参数代入模型给出的回归方程,计算出黄酒存放12 个月浊度预测值,与实际测得的浊度值进行比较分析,验证模型的准确度。从图3可以发现,黄酒存放12 个月的浊度预测值与实测值具有较好的对应性,除少数样品外,均位于直线y=x附近。因此,该模型可用于预测黄酒存放12 个月后的浊度。了解黄酒存放12 个月后的混浊情况,有助于提前发现非生物稳定性差的黄酒,避免其流入市场,对于黄酒生产企业生产和销售的可持续发展具有重要意义。

图 3 存放12 个月浊度实际值与模型预测值偏差Fig. 3 Deviation between actual values and model predicted values of turbidity after 12 months of storage
3 结 论
通过分析20 种不同产地、不同类型黄酒样品的混浊相关指标、稳定性实验与黄酒自然存放后样品浊度之间的相关性,利用SPSS 18.0软件进行多元线性回归分析,发现瓶装黄酒浊度与增加4 NTU所需冷热处理循环数、敏感蛋白含量、总氮质量浓度、低分子质量氮质量浓度和中分子质量氮质量浓度等指标显著相关,并以此为基础构建了它们之间的多元线性回归方程。该方程用于黄酒预测非生物稳定性的结果表明,预测值与实测值具有较好的对应性,采用该模型预测黄酒存放12 个月后的浊度,有助于提前发现非生物稳定性差的黄酒,避免其流入市场,对于黄酒生产企业生产和销售的可持续发展具有重要意义。

