差示扫描量热法测定对乙酰氨基酚原料药纯度
常伟伟,彭辉
(山东理工大学分析测试中心,山东淄博 255049)
对乙酰氨基酚(俗称扑热息痛),是一种类阿司匹林的解热镇痛药,可用于治疗感冒发烧,也可用于缓解疼痛,如头痛、关节痛、偏头痛、肌肉痛、牙痛、手术痛等。因其副作用小,疗效快,是常用感冒退烧药的主要成分,尤其广泛用于儿童药中[1–2]。对乙酰氨基酚原料药纯度直接影响其制剂的药效,因此严格检测和控制对乙酰氨基酚原料药纯度具有重要意义。目前,测定对乙酰氨基酚纯度的方法主要是《中国药典》2015 年版第二部中采用的紫外可见分光光度法。也有检测人员用高效液相(HPLC)法[3–4]进行定量分析。上述两种方法都需要标准品,且需要配制标准溶液,前期准备工作复杂,操作时间长,且产生废液试剂,造成浪费和环境污染。
差示扫描量热(DSC)法是20 世纪60 年代初发展起来的一种热分析技术。20 世纪80 年代逐渐发展成熟,并广泛用于药物分析领域[5–6]。DSC 法具有样品用量少、制样简便、检测速度快、无需其它试剂和对照品等优点。另外,DSC 技术还可以同时测定药品的熔点、熔融焓等物理化学性质。1980 年,《美国药典》正式将DSC 作为药品纯度的检测方法之一。近年来,国内用DSC 测定药物纯度的研究也日益增加[7–9],郭永辉等[10]采用DSC 测定了沙呵啶的纯度,并用高效液相(HPLC)法进行了对比,发现DSC 法与HPLC 法测定结果具有良好的一致性。王娟等[11]用DSC 法同时测定了衣康酸的纯度与熔点,结果表明DSC 法测定的纯度比传统的碘量法误差小,准确度高。笔者采用DSC 法测定了对乙酰氨基酚的纯度,并用紫外可见分光光度法对测定结果的准确性进行了验证。结果表明,DSC 法的测定结果与紫外可见分光光度法的测定结果基本一致,且DSC 法测定结果的相对标准偏差较小。该方法的建立为对乙酰氨基酚原料药纯度检测和质量监控提供了一种更加简便、快速的分析方法。
1 实验部分
1.1 主要仪器与试剂
差示扫描量热仪:Q2000 型,带有50 位自动进样器,美国TA 公司;
电子天平: XP6 型,感量为0.001 mg,瑞士梅特勒–托利多集团公司;
紫外可见分光光度计:Cary 60 型,美国安捷伦科技有限公司;
移液枪:热电F1 型,量程为1~10 mL,美国赛默飞世尔科技有限公司;
铝坩埚(带盖):Tzero密封铝坩埚(Φ5.4×2.0 mm),上海笛柏实验设备有限公司;
石英吸收池:1 cm×1 cm,美国安捷伦科技有限公司;
容量瓶:50,1 000 mL,天津市天科玻璃仪器有限公司;
铟标准物质:熔点为(156.52±0.26)℃(k=2),编号为GBW(E) 130182,国家标准物质研究中心;
蓝宝石:样品为无色,参比为红色,美国TA 仪器公司;
对乙酰氨基酚标准品:纯度不小于99.5%,上海阿拉丁生化科技股份有限公司;
对乙酰氨基酚原料药:纯度大于99%,山东新华制药有限公司;
氢氧化钠:分析纯,国药集团化学试剂有限公司。
1.2 溶液配制
对乙酰氨基酚系列标准工作溶液:准确称取50.0 mg 对乙酰氨基酚标准品,用质量分数为0.4%的氢氧化钠溶液溶解,并定容至1 000 mL,摇匀。用移液枪分别移取1.0,2.0,4.0,6.0,8.0,10.0 mL 上述溶液于50 mL 容量瓶中,用0.4%氢氧化钠溶液定容至标线,摇匀,配制成对乙酰氨基酚的质量浓度分别为1,2,4,6,8,10 μg/mL 的系列标准工作溶液。避光保存。
对乙酰氨基酚样品溶液:5 μg/mL,精确称取对乙酰氨基酚样品5.0 mg,置于1 000 mL容量瓶中,用0.4%氢氧化钠溶液溶解,并定容至标线,摇匀。
1.3 仪器工作条件
(1)差示扫描量热仪。炉体气氛:高纯氮气(N2的体积分数不小于99.99%),流量为50 mL/min;称样量:2.0~2.2 mg;升温速率:1.0℃/min;升温区间:150~180℃;冷却装置:机械冷却。
(2)紫外可见分光光度计。开机,预热10 min,仪器自检完成后,即可进行测试。
1.4 实验方法
1.4.1 DSC 仪器校准
(1)炉子热电阻、电容的校准。用高纯N2吹扫炉体,流量为50 mL/min,在–90~400℃范围内,分别以10℃/min 速率升温,检测空炉子和蓝宝石的DSC 曲线,实验完成后,软件自动校准炉子热电阻和电容,以消除因参比和样品传感丝热电阻和电容的差别引起的实验误差。
(2)温度和炉子常数校准。称取铟标准物质(5.0±0.01) mg,置于DSC 铝坩埚中,参比为空坩埚。用高纯N2吹扫炉子,流量为50 mL/min,在100~180℃范围内,以10℃/min 速率升温,测定铟的熔化曲线。测试完成后,软件自动校准仪器温度和炉子常数。
1.4.2 对乙酰氨基酚纯度测定
称取2.0~2.2 mg 样品于坩埚中,经压样器压样后,按一定次序置于自动进样器的样品盘中,采用与样品坩埚相同类型的空坩埚为参比盘,自动进样器按照设定的程序依次将样品与参比送入加热炉中进行测定。实验程序:用高纯N2吹扫炉子,流量为50 mL/min,快速升温至150℃,恒温2 min ,然后以1.0℃/min 升温至180℃(对乙酰氨基酚熔程为168~172℃)。测试完成后,通过TA 仪器公司的universal 软件自动计算其纯度。
2 结果与讨论
2.1 升温速率与称样量的选择
升温速率和称样量是DSC 法测定药品纯度的主要影响因素[10–12]。分别设置4 个水平条件的升温速率(0.5,1.0,2.0,4.0℃/min)和4 个水平条件的称样量(1.0~1.2,2.0~2.2,3.0~3.2,4.0~4.2 mg),在不同水平组合条件下,按1.4.2 实验方法对样品进行测定,考察不同升温速率与称样量对测定结果的影响,结果见表1 和图1。
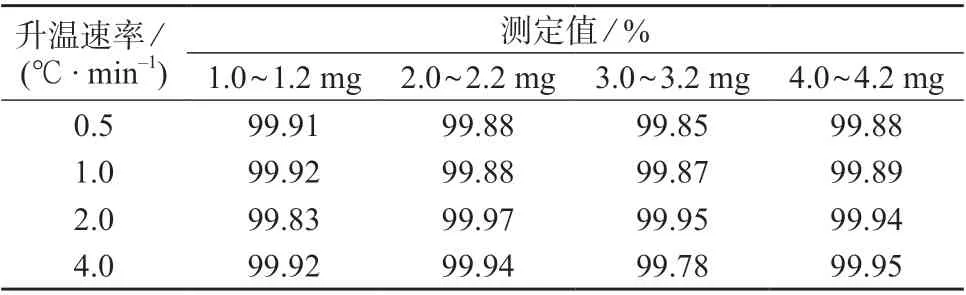
表1 不同升温速率与称样量试验结果
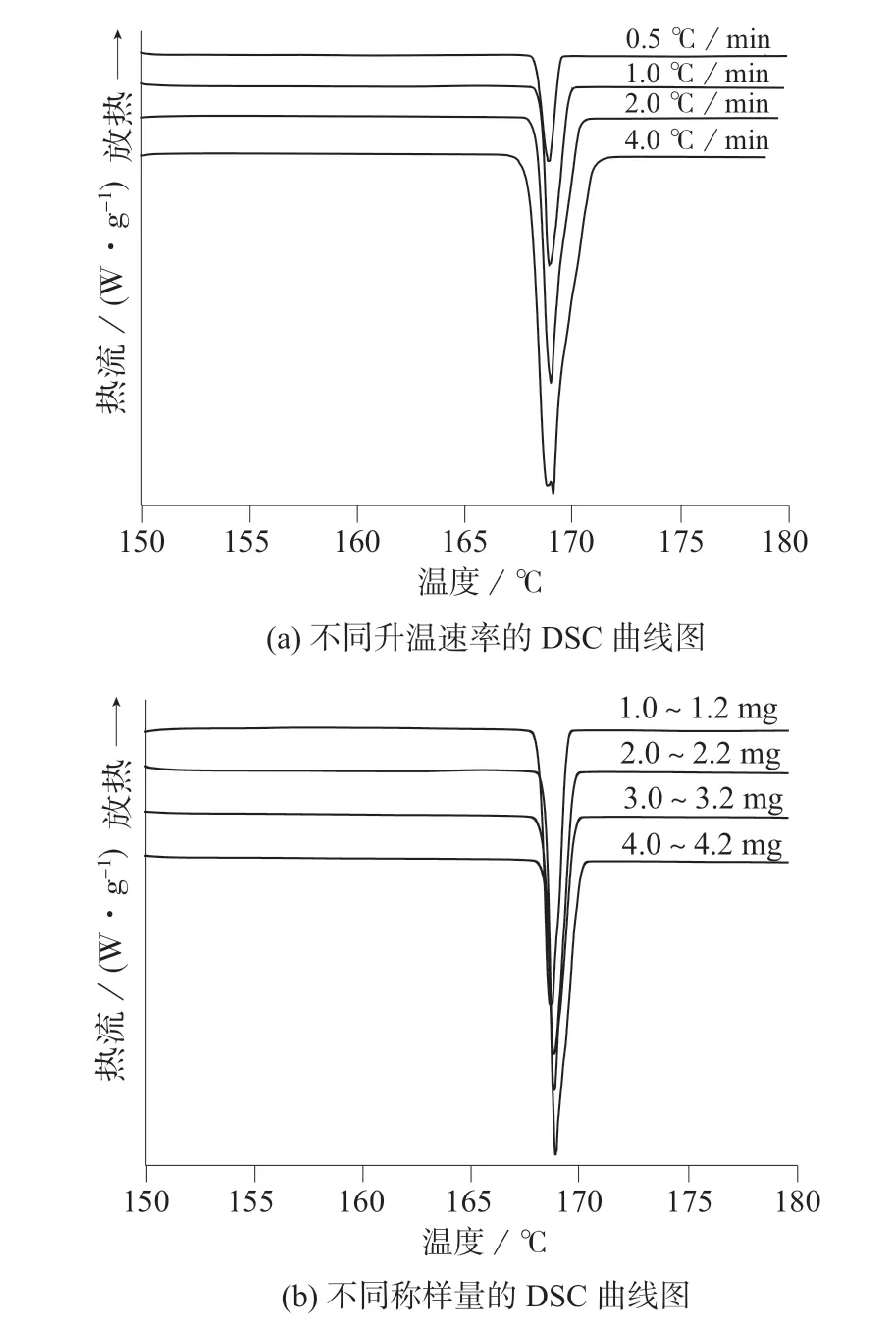
图1 不同升温速率和不同称样量的DSC 曲线图
图1(a)为称样量为2.0~2.2 mg 时,不同升温速率的DSC 曲线对比图,从图中可以看出,升温速率越大,样品与炉体间的热滞后越明显,样品熔融峰越宽,且峰发生变形(如4.0℃/min),影响测定结果的准确性;升温速率过低,不但延长测定时间,且基线波动引起的实验误差变大。综合考虑实验结果的准确性和测定时间,选择升温速率为1.0℃/min。图1(b)为升温速率为1.0℃/min 时,不同称样量的DSC 曲线对比图,从图中可以看出,称样量对熔融峰形和测试结果的准确度及精密度影响不明显。但称样量太少,称量误差明显;称样量太多,影响样品内部热传导速度及温度梯度[13],导致分辨率下降,且造成浪费。因此在保证准确度的前提下,尽量减少称样量。最终选择实验条件:称样量为2.0~2.2 mg,升温速率为1.0℃/min。
2.3 坩埚类型选择
不同坩埚作为样品盘,也会对测定结果产生一定影响[14]。分别选用TA 公司的Tzero密封铝坩埚(Φ5.4×2.0 mm)、Tzero非密封铝坩埚(Φ5.4×2.0 mm)、普通非密封铝坩埚(Φ6.65×1.7 mm)和普通密封铝坩埚(Φ6×2.5 mm)作为样品盘,称取2.0~2.2 mg 对乙酰氨基酚样品,对应的空坩埚为参比盘,在升温速率为1.0℃/min 条件下进行测定,结果见表2 和图2。
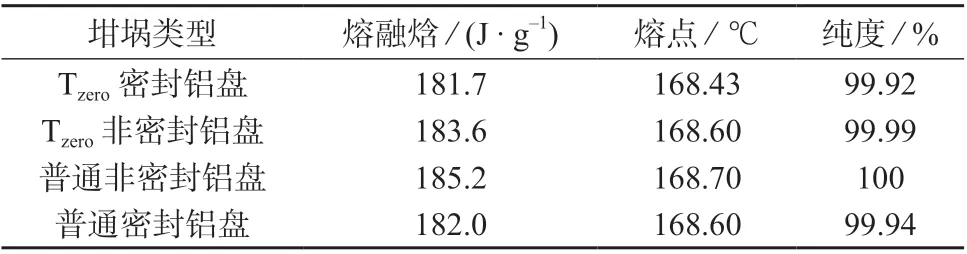
表2 不同类型坩埚作为样品盘的试验结果

图2 不同类型坩埚作为样品盘的DSC 曲线
由图2 可以看出,4 种不同类型坩埚作为样品盘测定的对乙酰氨基酚的熔融峰形无显著差异。但用非密封盘测得的样品纯度比密封盘高,且用非密封盘测得的熔融焓偏高,可能是由于采用密封盘时,整个测定过程在密封环境中进行,抑制了挥发性物质的挥发。采用非密封盘时,少量挥发性杂质在挥发过程中产生汽化热,导致所测的熔融焓偏高。为消除汽化热的干扰,选择Tzero密封铝盘作为样品盘。
2.4 线性关系
精确称取6 份不同质量(1.0~4.0 mg)的对乙酰氨基酚样品,按1.4.2 方法对样品进行测定,结果见表3。由表3 可知,6 份对乙酰氨基酚样品的纯度平均值为99.92%,测定结果的相对标准偏差为0.05%。以对乙酰氨基酚称样量(x)为横坐标,以熔融热(y)(熔融焓×称样量)为纵坐标,绘制标准工作曲线。计算得线性方程为y=181.52x+0.340 2,相关系数r=0.999 9。表明在对乙酰氨基酚称样量为1.0~4.0 mg 范围内与熔融热成良好的线性关系。

表3 DSC 测定对乙酰氨基酚纯度测定结果
2.5 精密度试验
精确称取6 份对乙酰氨基酚样品(2.0~2.2 mg),按1.4.2 方法对样品进行测定,结果见表4。

表4 精密度试验结果
由表4 可知,测定结果的相对标准偏差为0.03%,表明DSC 法测定对乙酰氨基酚纯度具有良好的精密度。
2.3 方法比对试验
按照文献[15]和《中国药典》,采用紫外可见分光光度法测定对乙酰氨基酚系列标准工作溶液在257 nm 处的吸光度。以对乙酰氨基酚的质量浓度(x)为横坐标,以吸光度(y)为纵坐标,绘制标准工作曲线。计算得线性方程为y=0.078 6x–0.007 78,相关系数r=0.999 9。分别对样品溶液进行3 次平行测定,由线性方程计算得对乙酰氨基酚纯度分别为99.83%,99.94%,99.79%,平均值为99.85%,测定结果的相对标准偏差为0.08%。由此可见,DSC 法与紫外可见分光光度法测定的对乙酰氨基酚纯度具有较好的一致性,且RSDDSC<RSDUV。
3 结语
采用差示扫描量热法测定了对乙酰氨基酚原料药的纯度,考察了实验条件对测定结果的影响,并用紫外可见分光光度法进行了对比。结果表明,DSC 法具有精密度、准确度、重现性高等优点,且样品用量少,操作简便,不会造成溶剂浪费。DSC 法与紫外可见分光光度法测得的对乙酰氨基酚的纯度基本一致,且DSC 法测定结果的相对标准偏差较小。该方法的建立为对乙酰氨基酚原料药纯度检测和质量监控提供了一种更加简便、快速的分析方法,并为其它原料药纯度的检测和质量监控提供参考。

