顺铂耐药宫颈癌细胞中沉默交配型信息调节因子2同源蛋白1的表达及其对细胞增殖的影响 ▲
夏小艳 叶 枫 彭桂元 周小明
(1 长沙卫生职业学院, 湖南长沙市 410017,电子邮箱:274228692@qq.com; 2 湖南中医药大学第一附属医院内科, 长沙市 410017)
宫颈癌是女性常见恶性肿瘤之一,据国际癌症研究所最新统计资料显示,2012年全球有52.8万宫颈癌新发病例,26.6万死亡病例,其中我国宫颈癌的新发病例和死亡病例约占全世界的1/3[1]。目前,手术切除并辅以放化疗是宫颈癌的主要治疗方法[2]。但化疗可使肿瘤细胞出现耐药性而导致疗效不佳,疾病复发乃至死亡。沉默交配型信息调节因子2同源蛋白 1(silent mating-type informator regulator 2 homolog 1,SIRT1)是Sirtuin家族成员之一,是酵母沉默信号调节因子2在人体中的类似物,是一种依赖于烟酰胺腺嘌呤二核苷酸的Ⅲ型去乙酰化酶。SIRT1基因定位于人类染色体10q21.3,基因组序列长度约为33 kb,共有9个外显子编码747个氨基酸,翻译后蛋白质量为81.7 kDa,其参与了体内多种生理功能的调节,还参与肿瘤、糖尿病等疾病以及增龄相关性疾病的发生过程[3-4]。有研究表明,SIRT1在宫颈癌HeLa/MMC耐药细胞亚系中高表达[5],但机制尚未完全明确。本研究探讨耐顺铂(DDP)宫颈癌细胞中SIRT1表达情况及其对细胞增殖的影响,现报告如下。
1 材料与方法
1.1 细胞来源与培养 宫颈癌HeLa和SiHa细胞购自美国模式菌种收集中心。细胞均用含10%小牛血清、100 U/L青霉素、100 μg/L链霉素的杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)在温度37℃、湿度95%、5%CO2条件下培养。
1.2 主要试剂、仪器 SIRT1抗体(圣克鲁斯生物技术公司,CA,美国,批号:sc-74504),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(Abcam公司,批号:ab2785)。辣根过氧化物酶标记的二抗(Abcam公司,批号:ab6785)。TRIzol 试剂(Invitrogen公司,批号:10033-21)。反转录试剂盒(赛默飞世尔科技公司,批号:4374876),细胞计数检测(cell counting kit-8,CCK-8)试剂(赛默飞世尔科技公司,批号:A13261),脂质体 2000转染试剂(赛默飞世尔科技公司,批号:11668019),Wellscan MK3型酶标仪(芬兰雷勃公司),siRNA由苏州吉玛基因股份有限公司合成。
1.3 细胞分组及干预 将HeLa和SiHa细胞分别分为耐药组和敏感组。敏感组细胞不做任何处理,而耐药组在培养过程中逐步增加培养液中顺铂的浓度来诱导SiHa和HeLa细胞产生耐药性,建立对顺铂耐药的SiHa和HeLa细胞系,即HeLa/DDP和SiHa/DDP细胞系,其中顺铂浓度从0.5~20 nmol(0.5、1,2、4、8、10、12、14、16、18、20 nmol)逐渐增加,直到细胞增殖稳定,无明显凋亡。再将稳定增殖的耐药细胞分为HeLa/DDP-NC组、HeLa/DDP-siRNA组,以及SiHa/DDP-NC组、SiHa/DDP-siRNA组,每组取100 μL密度为1×105个/mL的细胞悬液接种于96孔板上,37℃、5%CO2条件下培养过夜,次日按照转染试剂盒说明书进行siRNA转染。siRNA组加入合成序列:TGATGAAGCGCTGTAACTCTT;NC组加入合成序列:ACGTGACACGTTCGGAGAATT。实验重复3次,设3个副孔。
1.4 免疫印迹试验法 收集敏感组、稳定增殖的耐药组以及转染后的耐药组细胞(转染组的细胞转染4~6 h后收集细胞),用磷酸缓冲盐溶液洗涤后加入适当裂解液,裂解离心提取细胞总蛋白,蛋白定量后用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(上样量为40量/孔),将蛋白转移到硝酸纤维素膜,用5%低脂奶粉在室温下封闭2 h,阻断膜的非特异性斑点。然后用SIRT1抗体(体积比为1 ∶1 000)或GAPDH(体积比为1 ∶500)孵育,室温下于摇床上平缓摇动2 h。TBS洗涤3次,5 min/次,然后用辣根过氧化物酶标记的二抗(1 ∶2 000)室温下孵育1 h,TBS洗涤3次,5 min/次,用增强化学发光试剂显示信号,于AX-II X射线摄影暗匣进行显影。根据显影条带计算条带灰度值,进而计算目的蛋白的表达。
1.5 实时定量聚合酶链式反应 收集敏感组、稳定增殖的耐药组及转染后的耐药组细胞(转染组的细胞转染4~6 h后收集细胞),用TRIzol法提取细胞总RNA。测定纯度及浓度后采用反转录试剂盒将RNA反转为cDNA,操作按说明书进行。以GAPDH为内参基因,进行实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测SIRT1 mRNA相对表达量。20 μL反应体系:BestarⓐSYBRGreen qPCRMaster Mix 10μL,PCR上下游引物各0.5 μL,cDNA模板1μL,ddH2O 8 μL,反应条件:94 ℃ 2 min,94℃ 20 s,58 ℃ 20 s,72 ℃ 20 s,40个循环。所有引物由上海生工生物有限公司进行设计。GAPDH引物:正向5’- CCTCGTCTCATAGACAAGATGGT-3,反向5′-GGGTAGAGTCATACTGGAACATG-3′;SIRT1的引物:正向5′-GAGTGGCAAAGGAGCAGA-3′,反向5′-TCTGGCATGTCCCACTATC-3′。用2-△△Ct法计算目的基因的相对表达量。其中,△Ct=(目的基因Ct-内参基因Ct),△△Ct=(待测样品中目的基因△Ct-参照样品中目的基因△Ct)。
1.6 细胞增殖检测 取HeLa/DDP-NC组、HeLa/DDP-siRNA组细胞,以及SiHa/DDP-NC组、SiHa/DDP-siRNA组细胞,以2×105个细胞/孔接种于6孔板,分别在培养0 h、24 h、48 h及72 h后每孔加入10μL CCK-8试剂,在37℃下孵育3 h后于酶标仪450 nm处读取吸光度值(A值)。实验重复3次,设3个副孔。
1.7 统计学分析 采用SPSS 13.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 耐药组与敏感组细胞SIRT1蛋白及mRNA相对表达水平比较 敏感组SiHa细胞、HeLa细胞的SIRT1蛋白及mRNA相对表达水平均低于耐药组细胞(均P<0.05)。见表1及图1。

表1 耐药组与敏感组SiHa、HeLa细胞SIRT1蛋白及mRNA相对表达水平比较(x±s)

图1 耐药组与敏感组SiHa、HeLa细胞SIRT1蛋白表达情况
2.2 抑制SIRT1的表达对顺铂耐药细胞增殖的影响 SiHa/DDP-NC组和HeLa/DDP-NC组细胞SIRT1蛋白及mRNA相对表达水平分别高于Siha/DDP-siRNA组和HeLa/DDP-siRNA组细胞,提示转染成功,见表2及图2。CCK-8结果显示,SiHa/DDP-NC组和HeLa/DDP-NC组细胞培养后24 h、48 h及72 h的A值分别高于SiHa/DDP-siRNA组和HeLa/DDP-siRNA组细胞(P<0.05),见表3及表4。

表2 DDP-NC组与DDP-NC组细胞SIRT1蛋白及mRNA相对表达水平比较(x±s)

表3 两组SiHa细胞增殖情况比较(x±s)

表4 两组HeLa 细胞增殖情况比较(x±s)
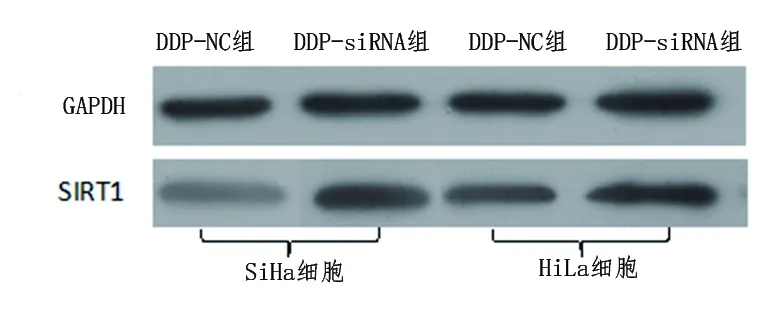
图2 转染后两种细胞SIRT1蛋白表达情况
3 讨 论
宫颈癌细胞耐药性与许多因素有关,有研究表明,多重耐药基因1、P糖蛋白过量表达以及P53突变等相互影响、共同作用,可导致宫颈癌细胞对抗肿瘤药物产生耐药[6]。SIRT1是Sirtuin家族成员之一,其在诸多生理过程中,包括应激反应、细胞新陈代谢、细胞衰老、细胞凋亡及增殖等,发挥重要作用。大多数研究表明,SIRT1在肿瘤形成过程中主要起促癌基因的作用,但在特定组织中也可有抑癌基因的作用,而促癌基因与抑癌基因的平衡极为重要[7-8]。还有研究表明SIRT1与肿瘤耐药性密切相关,其过表达能增强肿瘤的耐药性[9]。Shuang等[9]研究发现,在乳腺癌患者中SIRT1的过表达和化疗耐药性密切相关,检测SIRT1表达水平可以预测患者的预后情况。还有学者发现,SIRT1能上调肝癌患者YAP2蛋白的表达而增强肝癌的耐药性;而抑制SIRT1的表达能降低肿瘤的耐药性[10]。如采用微小RNA-494抑制胰腺癌患者的SIRT1和c-Myc的表达,可以降低胰腺癌细胞的耐药性,并抑制胰腺癌细胞增殖[11]。而有学者研究发现,SIRT1 表达下调能明显降低HeLa/MMC 细胞对丝裂霉素的耐药性,其作用可能与P糖蛋白有关[5]。
为进一步研究SIRT1对宫颈癌顺铂耐药的影响,本研究建立了两个顺铂耐药的宫颈癌细胞模型,结果显示,耐药组SiHa细胞及HeLa细胞的SIRT1蛋白及mRNA表达水平均高于敏感组(均P<0.05),提示顺铂耐药宫颈癌细胞株的SIRT1表达上调;而SiHa/DDP-siRNA组、HeLa/DDP-siRNA组细胞A值分别低于SiHa/DDP-NC组、HeLa/DDP-NC组(均P<0.05),即抑制SIRT1的表达后,耐药细胞的增殖明显受到抑制,这与吴琦等[12]的研究结果相似,提示SIRT1可能在宫颈癌细胞对顺铂耐药的调控中起到了不可或缺的作用。但顺铂耐药细胞株SIRT1表达水平升高的机制尚不明确,Chen等[13]研究发现,激活β2-肾上腺素受体信号通路可上调SIRT1表达,从而可能影响p53依赖性化疗药物对宫颈癌细胞产生的毒性。本研究未能通过体内实验分析抑制SIRT1表达后肿瘤细胞增殖的情况,而SIRT1调控宫颈癌细胞对顺铂耐药性的途径也仍需进一步研究。SIRI1能否作为宫颈癌耐药、预后预测的标志物,逆转宫颈癌耐药性的靶点,还有待进一步探索。
综上所述,顺铂耐药的HeLa、SiHa细胞中SIRT1表达水平升高,抑制SIRT1表达可以抑制顺铂耐药的宫颈癌细胞的增殖。SIRTI或可作为宫颈癌化疗耐药患者的分子靶标,SIRTI抑制剂或可成为对顺铂耐药的宫颈癌患者的新治疗方向。

