水通道蛋白PIP1基因过表达杨树的光合生理过程对干旱和复水的响应*
刘文鑫 陈志成 代永欣 万贤崇
(1.中国林业科学研究院林业新技术研究所 北京100091; 2.山西农业大学林学院 太谷 030800)
随着全球气候变化,气温的升高及降水格局的改变导致干旱或季节性干旱的频发。近年来越来越多的研究报道干旱影响植株的正常生长,甚至导致植株死亡(Swensonetal.,2017;Hartmannetal.,2018;王凯等,2018)。叶片在植物生长和发育过程中起重要作用,它们需要不断地补充水分和CO2来实现光合作用。光合作用期间,CO2从叶片周围大气通过气孔到达气孔下腔,然后扩散到细胞壁周围,需要克服细胞壁、细胞膜、细胞质、叶绿体膜及叶绿体基质的阻力,最后到达叶绿体基质的羧化部位。CO2从气孔下腔到达羧化位点扩散的流畅程度称为叶肉导度(gm)。过去几十年的大量证据证明叶肉导度很小,致使叶绿体中CO2浓度小于细胞间CO2浓度,因此叶肉导度也常常成为光合作用碳循环的限制因子(Flexasetal.,2002;Centrittoetal.,2003;Ethieretal.,2004)。叶肉导度的大小受到水通道蛋白(AQP)(Flexasetal.,2006;Perez-Martinetal.,2014)和碳酸苷酶(Hoetal.,2016)的调节。在植物体内,水通道蛋白主要是质膜水通道蛋白(PIPs)和液泡膜内在蛋白(TIPs)。质膜水通道蛋白(PIPs)家族分为2个亚族:PIP1和PIP2。PIP2蛋白作为主要的水分运输通道起作用(Chrispeelsetal.,2001),而PIP1蛋白既协助CO2的扩散(Uehleinetal.,2003)还与PIP2协作促进水分的渗透(Fetteretal.,2004)。近年来的研究发现PIP1水通道蛋白的表达还会改变质膜对CO2的透性(Heckwolfetal.,2011)。水通道蛋白在叶片中对CO2的扩散起促进作用,提高了光合作用;当水通道蛋白基因的表达受抑制时植株的光合作用降低(Heckwolfetal.,2011;Flexasetal.,2006)。用氯化汞抑制水通道蛋白导致光合作用和叶肉导度降低(Miyazawaetal.,2008)。另外许多研究发现,在逆境条件下水通道蛋白基因的上调在维持植物生命活动中扮演重要的角色(Moshelionetal.,2015;Sreedharanetal.,2013)。因此,推测PIP1基因表达上调会导致叶肉导度的增加进而促进光合作用。
用水通道蛋白超表达或抑制表达的植株能更精确地探明水通道蛋白的功能(Heckwolfetal.,2011)。前期,作者所在实验室获得了转PtPIP1;3(GenBank登录号:MN795092 ptopip1.3)基因的84K杨(Populusalba×P.glandulosa‘84K’)过表达植株。对野生型84K杨木质部薄壁细胞、根、叶片及叶柄中质膜内在蛋白基因(PIPs)的相对表达量进行测定发现,PIP11;3基因的相对表达量最高。而且应用生物信息学工具对PtPIPs的功能位点进行预测分析,发现PtPIP1;3含有1个微体C-末端定位信号,其结构特异性可能意味其功能的特异性(冷华妮,2012)。因此,本研究选定PtPIP1;3基因进行其参与功能调节的研究。
植物光合作用是最容易受到干旱影响的生理活动,不管应对短期干旱还是长期干旱,气孔关闭是植物必然采取的保护措施(Trenberthetal.,2013)。但气孔并不是限制光合作用的唯一因素,在植物中光合作用受到气孔导度(gs)、叶肉导度(gm)(Flexasetal.,2012;Galmésetal.,2013;Grassietal.,2005;Zhouetal.,2013;2014)或与最大羧化速率(Vcmax)(Zhouetal.,2013;2014)、最大电子传递速率(Jmax)有关的光合生物化学过程的限制(Tosensetal.,2016;Veromann-Jürgensonetal.,2017;Zhouetal.,2014)。在干旱及复水过程中究竟是哪些因素限制了光合作用,目前并没有定论(Camposetal.,2014;Chenetal.,2015;Flexasetal.,2009;2014),这限制了对植物应对干旱胁迫生理响应的全面了解。因此,本研究利用杨树转基因植株研究PIP1s对光合参数和叶肉导度的影响,比较转基因植株和野生型植株在干旱期间的光合参数和叶肉导度下降幅度及复水后的恢复速度,分析干旱及复水期间气孔导度、叶肉导度和光合作用中生物化学过程对光合作用的限制程度。
1 材料和方法
1.1 试验材料
转PtPIP1;3基因过表达(PB13)和野生型(WT)84K杨的组培苗由中国林业科学研究院林木遗传育种国家重点实验室培育,于2018年6月底,选取生长健壮、长势一致的组培苗转移至规格为19 cm(上口)×17 cm(下口)× 21 cm(高)的花盆中继续培养。
1.2 转基因材料检测
根据Qiagen RNAeasy Mini Kit试剂盒的说明书提取杨树叶片总RNA。用Promega SuperScriptTM Ⅲ第1链合成试剂盒用于反转录来合成cDNA第1链。反转录后的cDNA溶液稀释20倍后用于荧光定量PCR(RT-qPCR)分析。荧光定量PCR反应根据TaKaRa SYBR Premix Ex TaqTM试剂盒的说明书进行操作(刘文鑫,2015)。在LightCyler480荧光定量PCR仪上完成PCR的扩增。
PtPIP1;3基因引物序列,上游引物:5′-CATC AGCTCAAACAGACAAGGAC-3′;下游引物:5′-CAG GCTTAGTAACACCCATGACAAT-3′。内参基因ACT引物序列,上游引物:5′-AAACTGTAATGGTCCTCC CTCCG-3′;下游引物:5′-GCATCATCACAATCACTC TCCGA-3′。
1.3 干旱胁迫及复水处理
2018年11月中旬,选取株高(123±4.8)cm的野生型84K杨(WT)、(125±6.1)cm的转PtPIP1;3基因的过表达植株(PB13)的苗木,在温室内进行水分控制试验,试验期间在夜晚进行补光2 h。通过预试验确定干旱处理时间,使植物的光合作用降到尽可能低之后再进行复水。共设置2个处理:对照组(正常浇水,保持土壤含水量为田间持水量的75%左右);胁迫组(利用称重法观察水量变化,同时少量多次补水以保证各盆达到预定的含水量,即达到田间持水量的35%,然后复水到75%左右的田间持水量)。控水期间,对照组保持设定的水分含量,胁迫组在干旱处理10天后复水至75%左右的田间持水量。分别于干旱处理后1、2、3、4、5、6、7、8、9、10天和复水后1、2、3、4天测定光合参数、土壤含水量,测定干旱第10天和复水第1、2、3天的荧光参数和CO2响应曲线。每处理18盆,6次重复。
用铝盒烘干法测定土壤含水量,每个基因型测6盆,取完后立刻称取鲜质量(FW)。之后,土样在烘箱中105 ℃烘48 h,称干质量(DW)。土壤含水量=(FW-DW)/DW×100%。在试验开始前期测定最大田间持水量,土壤含水量最终表示为占最大田间持水量的百分比。
1.4 参数测定和计算
1.4.1 光合参数测定 使用Li-6400光合作用系统(带红蓝光源叶室)于每天的10:00—11:00测定气体交换,所有测定叶片均选取第4片完全展开叶,光强为1 500 μmol·m-2s-1,叶室温度控制在25 ℃左右。记录净光合作用速率(Pn)、气孔导度(gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、大气温度(Tair)、叶片饱和水汽压亏缺(VPDL)等参数。
在每个取样日(停止浇水的第10天及复水的第1、2、3天)用带有荧光叶室的Li-6400测定CO2曲线和叶绿素荧光。
在光强为1 500 μmol·m-2s-1、大气CO2浓度(Ca)在50~1 800 μmol·mol-1变化时测定Pn-Ci曲线,设定CO2浓度为400、300、250、200、150、120、100、50、400、600、800、1 000、1 200、1 300、1 500、1 800 μmol CO2·mol-1,2个相邻点的时间间隔为2 min。Pn-Ci曲线用于估算Rubisco的最大羧化速率(Vcmax)和最大电子传递速率(Jmax)(Sharkeyetal.,2007),用非直角双曲线模型(Farquharetal.,1980)拟合Pn-Ci曲线。
1.4.2 叶绿素荧光参数的测定 暗适应一夜后,于凌晨6:00测定最小初始荧光(Fo)。计算光系统Ⅱ的最大光化学量子效率(Fv/Fm)=(Fm-Fo)/Fm。式中:Fv为暗适应叶片可变荧光,Fm为暗适应叶片最大荧光。
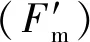
1.4.3 叶肉导度(gm)的计算 采用J变量方法计算叶肉导度(gm)(Harleyetal.,1992),公式如下:
(1)
式中:Pn和Ci从Pn-Ci曲线获得,Jflu为同一叶片的叶绿素荧光数据,Г*为无线粒体呼吸时CO2补偿点(Bernacchietal.,2002),Rd为光下线粒体呼吸速率(Flexasetal.,2009)。用变化范围在100~300 μmol·mol-1的Ci对应的净光合速率计算叶肉导度(gm)。估算叶绿体内CO2浓度(Cc)=Ci-(Pn/gm)。
考虑到叶室内部和外部CO2浓度差异,采用沸水煮叶片法来校准Pn(Flexasetal.,2007)。经测定CO2渗漏值较小(Pn<0.5 μmol·m-2s-1),因此不采用此校准值。
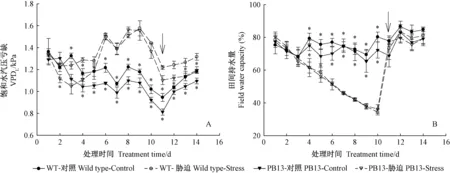
图1 PB13植株和WT植株饱和水汽压亏缺和土壤含水量在试验期间的变化Fig.1 Variations in leaf saturated vapor pressure deficit (VPDL) and soil moisture content of PB13 and wild type poplar during experimentPB13:PtPIP1;3过表达的转基因84K杨;WT:野生型84K杨。箭头代表复水第1天。*表示各自的处理与对照组间存在显著差异(P<0.05)。下同。PB13:PtPIP1;3 overexpression of poplar 84K;WT:Wild type of poplar 84K.The arrow indicates the first day of re-watering.Asterisks indicate statistical significant difference between control and treatment for the same gene type (P<0.05).The same below.
1.4.4 光合作用限制分析 光合作用限制分析有助于确定胁迫下影响光合作用的因素(Buckleyetal.,2015;Grassietal.,2005)。因此,为了比较干旱胁迫及复水期间光合作用的限制因素,采用Grassi等(2005)定量限制分析的方法,对光合作用的限制分为气孔限制(ls)、叶肉限制(lm)和叶片生物化学限制(lb),公式如下:
(2)
(3)
(4)
(5)
式中:gt是总导度,gsc=gs/1.6,∂A/∂C是Pn-Cc曲线在Cc变化范围为50~100 μmol CO2·mol-1时的斜率。
1.5 数据分析
采用SPSS21.0对所得数据进行独立样本t检验,在0.05水平上检验同一天处理和对照间的差异显著性。用Sigmaplot 12.5进行图表绘制。
2 结果与分析
2.1 转基因植株叶片质膜内在蛋白基因表达量
水分胁迫处理前对转基因84K杨叶片中PtPIP1;3基因表达量进行RT-qPCR分析,以ACT基因为内参基因。检测发现,转PtPIP1;3基因84K杨(PB13)叶片中PtPIP1;3的相对表达量是野生型植株(WT)的2.02倍,差异显著。
2.2 叶片饱和水汽压亏缺和土壤含水量在试验期间的变化
试验期间对照和胁迫植株的叶片饱和水汽压亏缺(VPDL)维持在0.8 kPa以上,野生型(WT)和转PtPIP1;3基因植株(PB13)最大的VPDL值分别出现在停止浇水的第8天和第9天,分别为1.58、1.56 kPa(图1A)。试验期间土壤含水量在干旱第10天降到田间持水量的35%左右,此时开始进行复水,复水到田间持水量的80%左右(图1B)。
2.3 PtPIP1;3上调表达杨树的光合作用对干旱和复水的响应
试验期间正常浇水条件下,PB13植株的净光合速率(Pn)(13.8~20.5 μmol CO2·m-2s-1)显著高于WT(10.4~13.1 μmol CO2·m-2s-1)。干旱处理的最初5天PB13和WT的处理与其对照之间的Pn均无明显差异,干旱至第6天,Pn均快速降低;到第10天 WT和PB13的Pn分别只有其对照的15%和7%(图2A)。复水1天后恢复到对照的36%(WT)和64%(PB13),复水4天后恢复到对照的79%(WT)和96%(PB13),PB13已经恢复到对照水平。
PB13植株的气孔导度(gs)(0.36 mol CO2·m-2s-1)总体上明显高于WT植株(0.265 mol CO2·m-2s-1)。干旱至第4~5天,gs开始缓慢降低,分别降到对照的78%(WT)和83%(PB13);到第7~10天,气孔几乎完全关闭,gs降到0.05 mol CO2·m-2s-1左右(图2B)。复水1天后WT的gs恢复到对照的25%,PB13恢复到对照的32%;复水4天后分别为对照的66%和76%。干旱胁迫后2种植株gs的下降速度快于Pn,但复水后的恢复速度较慢。
干旱期间胞间CO2浓度(Ci)的下降幅度相对较小,前5天逐渐降低,第6天迅速降低,在第10天迅速增加,甚至高于对照;复水后恢复(图2C)。蒸腾速率(Tr)的变化规律(图2D)与gs基本一致。
在干旱第10天后叶肉导度(gm)分别降到对照的7%(WT)和1%(PB13)。复水1天后WT植株恢复到对照的41%,而PB13植株的gm超过对照;复水3天后分别为对照的73%和76%(表1)。干旱期间,gm的降低导致叶绿体CO2浓度(Cc)也受到抑制。干旱第10天Cc为对照的41%(WT)和28%(PB13)。复水后由于gm的恢复,复水1天后2种植株的Cc恢复到对照水平,PB13高于对照;复水3天后WT的Cc显著高于对照,而PB13的低于对照(表1)。
与对照相比,Rubisco的最大羧化速率(Vcmax)在干旱10天后降为对照的35%(WT)和19%(PB13)(表1)。复水3天后,Vcmax和最大电子传递速率(Jmax)分别为对照的70%和66%(WT)、66%和92%(PB13),其中PB13的Jmax已经恢复到对照水平(表1)。
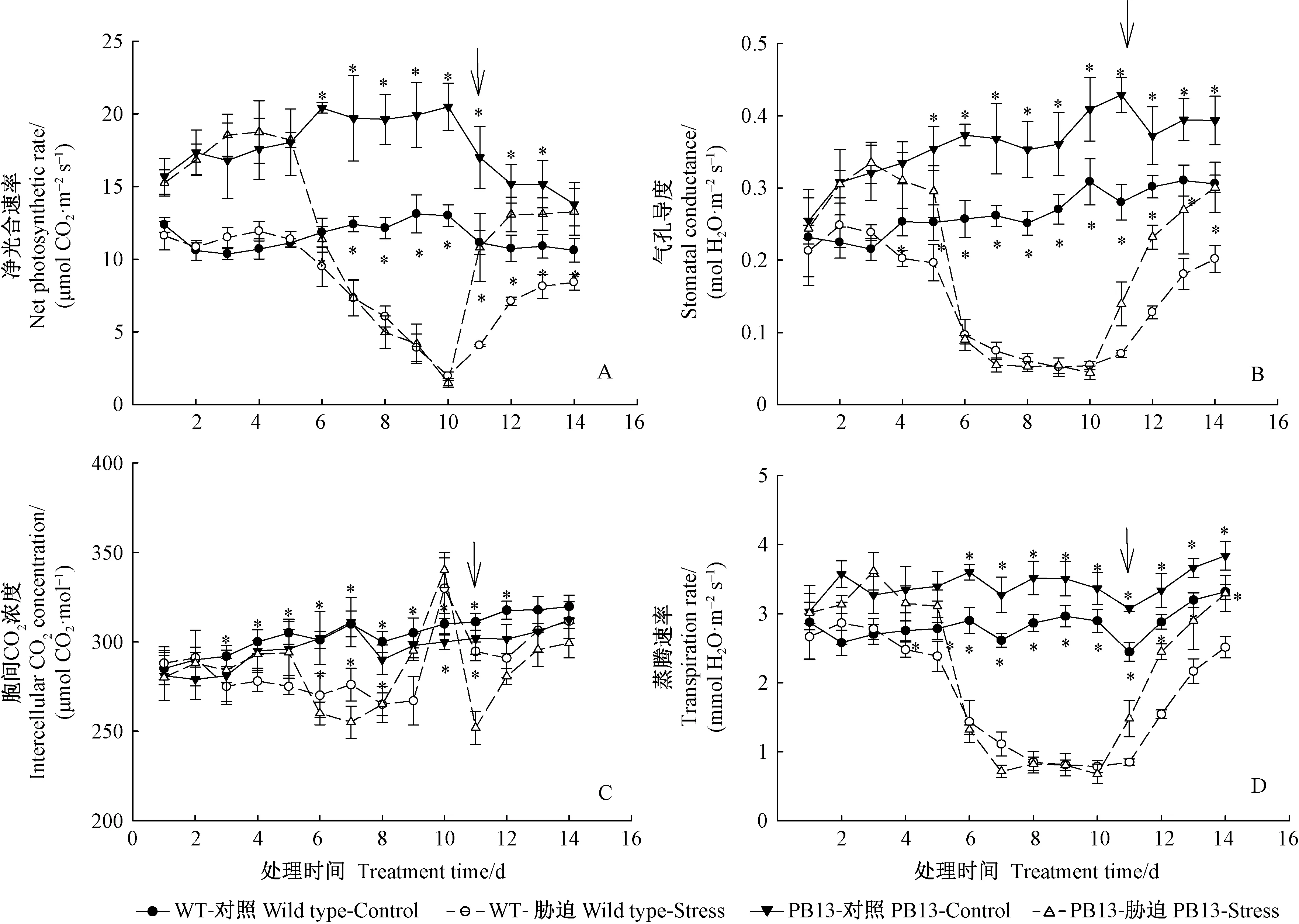
图2 PB13植株和WT植株光合参数在试验期间的变化Fig.2 Variations in photosynthetic parameters of PB13 and WT during the experiment
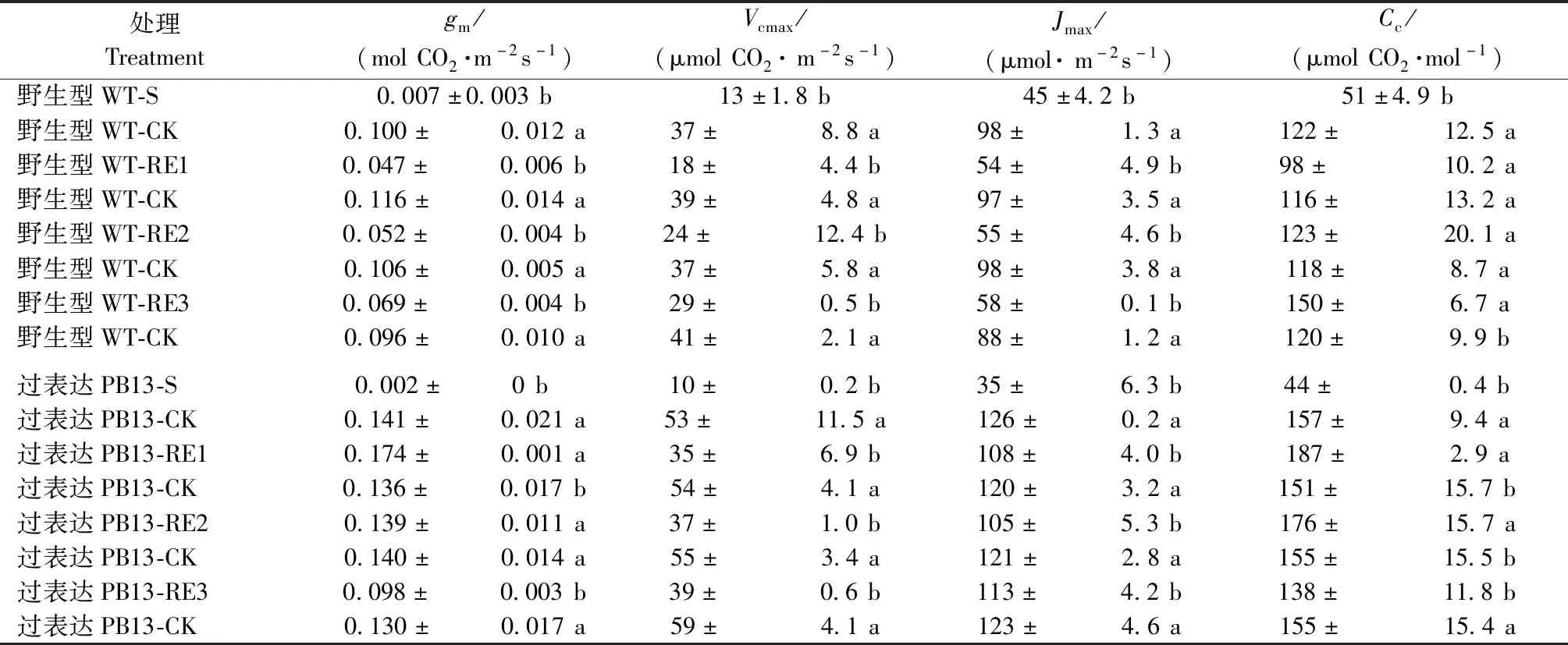
表1 胁迫和复水期间PB13和WT的叶肉导度(gm)、Rubsico最大羧化速率(Vcmax)、最大电子传递速率(Jmax)和叶绿体CO2浓度(Cc)的变化①Tab.1 Variations in mesophyll conductance(gm),Rubisco maximum carboxylation rate(Vcmax),maximum electron transport rate(Jmax),and chloroplast CO2 concentration(Cc) of PB13 and WT under water stress and re-watering
① 数值为平均值±标准差。此处胁迫(S)是干旱处理10天,RE1、RE2、RE3分别代表复水1、2、3天。不同字母表示同一天对照和处理组间的统计学差异显著(P<0.05)。Data are means±SD.The stress(S) here is drought treatment for 10 days.The RE1,RE2 and RE3 refer to re-watering for one,two or three days.Different letters indicate statistical differences between control and treatment in the same day (P<0.05).
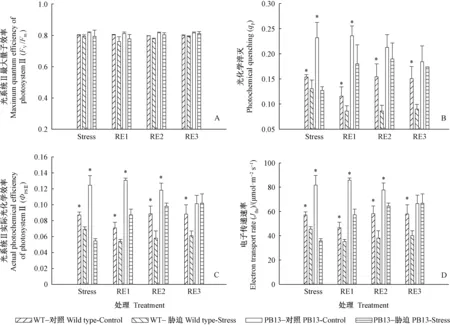
图3 PB13植株和WT植株叶绿素荧光参数在试验期间的变化Fig.3 Variations in chlorophyll fluorescence parameters of PB13 and WT during the experimentStress代表干旱胁迫10天,RE1、RE2、RE3分别代表复水1天、2天、3天。*表示各自的处理和对照组间存在统计学显著差异(P<0.05)。The “Stress” here is drought treatment for 10 days.The RE1,RE2 and RE3 refer to re-watering for one,two or three days.Asterisks indicate statistically significant difference between control and treatment for the same gene type (P<0.05).
2.4 叶绿素荧光对干旱和复水的响应
光系统Ⅱ最大光化学量子效率(Fv/Fm)的值在试验期间维持在0.78以上,与对照相比没有显著变化(图3A)。光系统Ⅱ实际光化学淬灭(qP)在干旱10天后降为对照的55%(PB13)和85%(WT)(图3B)。光系统Ⅱ实际光化学量子效率(ФPSII)在干旱处理后降为对照的43%(PB13)和80%(WT)(图3C)。电子传递速率(Jflu)降为对照的44%(PB13)和80%(WT)(图3D)。PB13植株在复水第3天时qP、ФPSII和Jflu都恢复到对照水平,而WT尚未明显恢复(图3B、C、D)。
2.5 光合作用的限制因素
从Pn和gs的变化来看,在干旱的前5天,气孔不是限制光合作用的主要因素,可能受到叶肉和生物化学的限制。随着干旱程度的加剧,叶肉限制(lm)成为主要的限制因素,甚至为气孔限制(ls)的4倍(WT)和13倍(PB13)(表2),其次为ls。复水后,光合作用的主要限制因素是叶肉导度(lm)和生物化学限制(lb),而且二者交替变化。复水1天后lb迅速增加并成为主要的限制因素。随后,lm逐渐增加,成为更主要的限制因素(表2)。
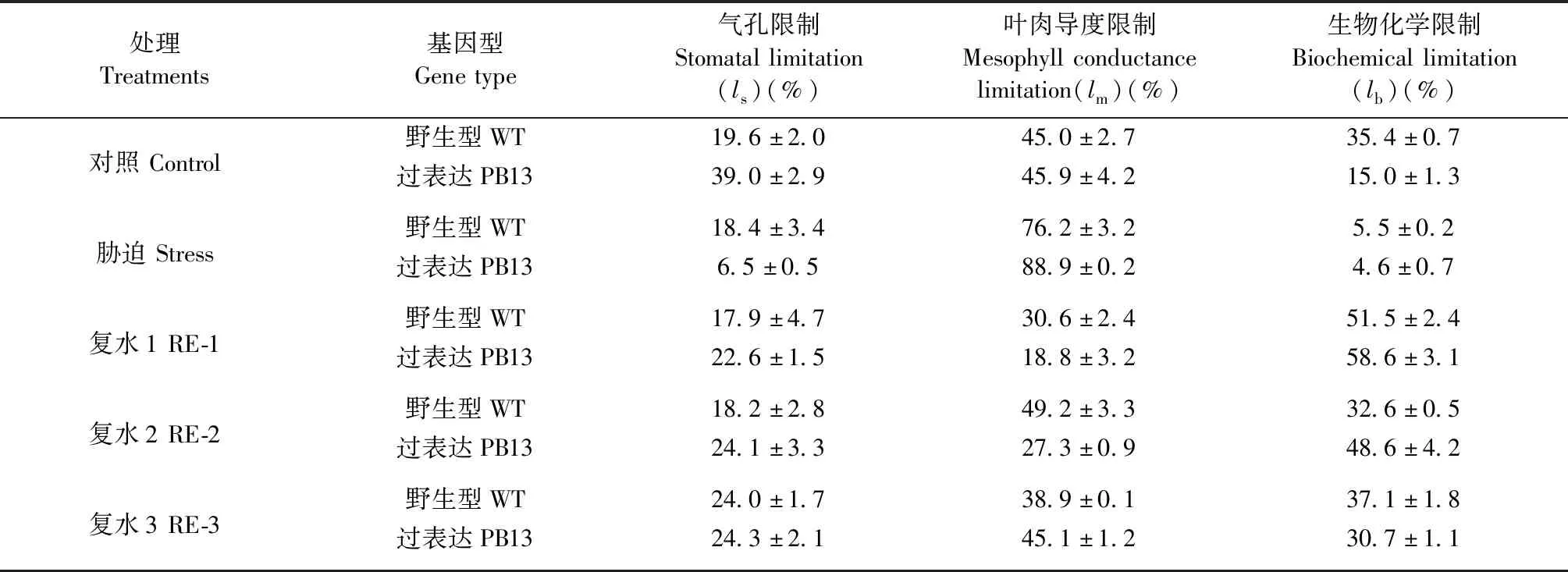
表2 干旱胁迫及复水后PB13和WT植株的光合作用限制因素分析①Tab.2 Limitation factors of photosynthesis of PB13 and WT under water stress and re-watering
① 数值为平均值±标准差。此处胁迫是干旱处理10 天,RE1、RE2、RE3分别代表复水1、2、3 天。Data are means±SD.The stress here is drought treatment for 10 days.The RE1,RE2 and RE3 refer to re-watering for one,two or three days.
3 讨论
水通道蛋白(AQP)除了具有运输水分的能力,其运输CO2的能力也在植物生长过程中起重要的作用。如烟草(Nicotianatabacum)中NtAQP1的表达促进了CO2在植物细胞中的运输,说明水通道蛋白能增加质膜对CO2的透性(Uehleinetal.,2003)。免疫学和翻译融合方法进一步证明了NtAQP1存在于保卫细胞和叶肉细胞中,在质膜和叶绿体内膜都有分布;后者的分布预示了水通道蛋白在CO2吸收方面的作用(Uehleinetal.,2008)。从正常浇水的转基因和野生型的84K杨的光合参数看,水通道蛋白过表达植株的净光合速率(Pn)、气孔导度(gs)和蒸腾速率(Tr)高于野生型植株,说明水通道蛋白过表达能促进植株的光合作用。在拟南芥(Arabidopsisthaliana)中发现敲除PIP1;2基因导致叶肉导度(gm)降低40%(Heckwolfetal.,2011);而本研究发现在正常浇水植株中,过表达植株叶肉导度比野生型的高40%左右。尽管叶肉导度还与细胞壁和碳酸苷酶有关(Evansetal.,2009),但从上述结果来看CO2的跨膜透性是叶肉导度的限制因子。
3.1 光合作用对干旱胁迫和复水的响应
干旱胁迫导致的Pn、gs和gm的降低速度比复水后的恢复速度慢。复水1天后PtPIP1;3过表达植株的gm恢复到对照水平之上。复水3天后,过表达植株的Pn恢复到对照水平。gs的降低导致CO2的扩散阻力增加,降低了叶绿体中CO2的可利用性,从而导致光合作用的降低(Flexasetal.,2002)。复水后,过表达植株光合作用的恢复程度大于野生型植株,说明水通道蛋白过表达后转基因植株的光合参数恢复速度更快。干旱胁迫除了导致气孔关闭外,非气孔因素的作用也扮演很重要的角色。在干旱胁迫期间气孔导度和叶肉导度都降低,这在其他物种中已经得到证实(Galmésetal.,2007;Flexasetal.,2008)。本试验中在干旱胁迫10天后,叶肉导度的下降幅度最大,其次为气孔导度。干旱胁迫后Rubisco最大羧化速率(Vcmax)降为对照的35%(野生型)和19%(转基因植株),这可能是由于Rubisco酶活性降低导致的(Lawloretal.,2009)。而Rubisco最大羧化速率(Vcmax)和最大电子传递速率(Jmax)的下降幅度没有气孔导度(gs)和叶肉导度(gm)的下降幅度大,说明光合作用的降低主要受到气孔导度和叶肉导度的制约。复水1天后转基因植株的叶肉导度迅速恢复,可能与其Vcmax和Jmax的恢复有关。有研究发现,Vcmax的增加以响应gm的降低可以促进光合作用能力的提升,有助于复水期间光合作用能力的维持(Galleetal.,2011)。
3.2 叶绿素荧光对干旱胁迫和复水的响应
干旱胁迫后PtPIP1;3过表达植株的光化学淬灭(qp)、光系统Ⅱ实际光化学效率(ФPSⅡ),以及电子传递速率(Jflu)的下降幅度大于野生型,而且在复水第3天恢复到对照水平,野生型则没有,反映了在复水条件下过表达植株光系统的恢复能力更强。结合气体交换的数据来看,光合作用降低,用于光化学消耗的能量减少,所以热量逐渐通过叶黄素(非光化学淬灭)消散(Demmig-Adamsetal.,2000)。如果干旱程度严重或持续时间很长,植物就难以安全地消散额外的热量,植物的光保护机制也会退化(Chavesetal.,2009),这可能导致光系统Ⅱ性能受损(Kalajietal.,2016),光合能力降低(Flexasetal.,2004),直接影响光合电子传递和CO2的同化(云菲等,2010)。本研究中在严重干旱的情况下野生型84K杨的qp、ФPSⅡ及Jflu都下降,表明光系统Ⅱ的性能可能受损,且复水后不能恢复;而PtPIP1;3过表达植株在干旱期间也有损伤,但复水后能很快修复,说明转水通道蛋白基因的植株在复水后光系统Ⅱ的恢复速度更快,其机制尚不清楚。
3.3 干旱胁迫和复水期间光合作用限制因素分析
转PtPIP1;3基因植株在复水后很快恢复了叶肉导度,使得叶绿体内CO2供应充足,光合作用的光反应和暗反应(碳还原)相对平衡;而野生型植株的叶肉导度没有及时恢复,CO2短缺,使得光反应产生的还原力不能及时消耗,导致产生光氧化(Kozakietal.,1996),使得光合系统受到损害,因而在复水期间恢复缓慢。之前笔者所在实验室的试验(刘文鑫等,2019)发现在干旱胁迫过程中野生型84K杨的光合速率降到最低时立即复水,叶肉导度完全恢复到对照水平,生物化学限制是复水期间光合作用的主要限制因素;而本研究在光合速率降到最低时少量补水,并继续维持在最低点附近干旱处理3天,导致转基因和野生型植株的叶肉导度没有完全恢复并成为限制光合的主要因素之一。
分析光合限制因素发现,在干旱第10天,叶肉导度限制(lm)成为主要的限制因素。气孔导度、叶肉导度和光合生物化学对光合的限制因物种而异,在干旱条件下光合作用的抑制首先是因为气孔导度和叶肉导度的降低,然后在更严重的干旱胁迫下光合作用中生物化学过程抑制增加(Flexasetal.,2009;Galleetal.,2009;Galmésetal.,2017;Grassietal.,2005)。而本研究中叶肉导度限制是干旱胁迫后期限制光合作用的主要因素。对复水的数据分析发现,光合作用的恢复受叶肉导度限制影响最大,其次为光合作用中生物化学限制(lb)。本研究的结果与Galmés等(2007)的结果一致,即叶肉导度(gm)是严重干旱后限制光合作用恢复的主要因素。目前关于叶肉导度是严重干旱胁迫后主要限制因素的报道比较少。本研究强调了叶肉导度在杨树干旱胁迫和复水后光合作用响应方面的重要性,因此有必要进一步了解叶肉导度的调节作用,尤其与环境和叶片解剖结构相关的方面。
3.4 复水后PtPIP1;3基因促进杨树光合能力的恢复
从干旱第6天起,PtPIP1;3基因过表达植株的gs下降和恢复速度均大于野生型植株。Wang等(2017)研究发现,MdPIP1;3基因增加番茄(Solanumlycopersicum)对干旱胁迫的忍耐,复水后转基因植株迅速恢复,野生型死亡;转基因番茄的气孔在正常生长条件下开放更大,干旱12天后,77%的气孔关闭,而野生型的有65%还在开放,说明转基因植株在响应干旱胁迫时气孔关闭比野生型快。转基因植株的气孔关闭迅速说明耐旱性的增加部分是因为减少了水分流失,与本研究结果相同。在干旱胁迫下,转PtPIP1;3基因植株保卫细胞迅速降低膨压来关闭气孔,以减少水分通过气孔的流失。在拟南芥中也发现NtAQP1和VfPIP1在盐胁迫和干旱胁迫下改变转基因植株的气孔导度(Cuietal.,2008;Sadeetal.,2014)。转MusaPIP1;2基因超表达的香蕉(Musaacuminata)在非生物胁迫(干旱、盐和寒冷)后的恢复能力比非转基因的更强(Sreedharanetal.,2013)。因此本研究的结果说明转PtPIP1;3基因的杨树可能通过有效的气孔关闭来减少蒸腾减少水分流失。另外,PtPIP1;3基因过表达也改变了复水后光合作用的恢复动态。转基因植株叶肉导度(gm)迅速恢复,使得复水初期主要是lb限制光合作用,随着CO2供应充足,叶绿体内光反应和暗反应过程趋于平衡,光氧化降低、光合化学机制逐渐恢复,lb限制减弱;而野生型的相反,gm恢复缓慢,所以叶肉导度限制(lm)一直是主要的限制因子,另一方面,光合化学机制恢复也较慢,至复水第3天,lb仍相对较大。
4 结论
通过对转水通道蛋白基因及野生型84K杨进行干旱及复水处理后发现,转PtPIP1;3基因84K杨的气孔导度和蒸腾速率对干旱胁迫反应更加敏感。在严重干旱时,转基因植株和野生型植株的光合作用都主要受到叶肉导度的限制。与野生型植株相比,转基因植株叶肉导度和光合作用在复水后恢复更迅速。在复水过程中,气孔导度持续恢复,而叶肉导度和光合作用的生物化学过程交替恢复。此时,光合作用除了受到叶肉导度的主要限制外,还受到与Rubisco最大羧化速率(Vcmax)有关的生物化学特性的限制。

