农杆菌介导的杜仲叶片愈伤组织遗传转化体系*
刘闵豪 徐郡儡 叶 靖 李周岐 范睿深 李 龙
(西北农林科技大学林学院 杨凌 712100)
杜仲(Eucommiaulmoides)是我国特有的重要经济树种。杜仲树皮为传统中药材,现代药理学研究表明,其主要药用成分为木质素、环烯醚萜类、黄酮类、苯基丙烷、多糖、氨基酸、其他萜类和脂肪族(张京京等,2014)。此外,杜仲树皮、树叶及果实中含有杜仲胶(反式聚异戊二烯),具有耐水性、耐腐蚀性、低温塑性、良好的韧性和溶解性,在化工领域具有巨大的潜力(Fang,2016)。
由于木本植物生长周期长与生长环境控制难等原因,传统的杜仲杂交育种要经过很长时间才能获得新的品种,严重制约了杜仲资源的开发利用。随着现代生物技术的发展,组织培养与农杆菌介导的遗传转化技术广泛运用于林木育种研究中,克服了传统育种的不足,具有良好的前景(Girietal.,2004)。杜仲组织培养的研究早在20世纪80年代就开始进行,到目前为止,已有以子叶和下胚轴为外植体的再生体系,以及叶和腋芽的组织培养研究报道(张朝成,1988;Chenetal.,1995;2008;李琰等,2006;袁云香,2012),在此基础上,对愈伤组织的继代条件进行了研究,初步构建了以叶片为外植体的再生体系(金晓玲等,2014)。尽管如此,杜仲组织培养仍存在愈伤组织不定芽诱导率低、不定芽再生困难等问题(刘慧敏等,2016),这导致杜仲目前没有以成熟植株组织为受体的遗传转化体系研究的报道,仅有以下胚轴为受体的遗传转化体系(赵丹等,2009;李岩等,2011),下胚轴属于子代材料,不能代表原优良品种的遗传背景(Sidorovaetal.,2017),这一局限性严重制约了杜仲基因功能与遗传改良的研究。
本研究以杜仲优良品种‘华仲4号’成年植株叶片为材料,优化了叶片愈伤组织的再生体系,并在此基础上研究了愈伤组织对抗生素与抑菌剂的敏感性。以获得的叶片愈伤组织受体系统为基础,通过正交试验探索不同转化因子对GUS瞬时表达率的影响。使用最适转化因子组合对约200个愈伤组织进行了遗传转化操作,共筛选获得3个抗卡那霉素(Km)的抗性芽,PCR检测证明这些抗性芽中存在NPTⅡ基因。本研究构建的体系使得在杜仲成熟材料中进行基因遗传转化的研究成为可能,为杜仲基因功能的研究与定向改良奠定基础,对杜仲资源的开发利用具有重要意义。
1 材料与方法
1.1 试验材料
杜仲成年植株叶片采集于西北农林科技大学林学院试验苗圃种植的‘华仲4号’(杜兰英等,2014),该优良品种于2005年从河南灵宝引种至西北农林科技大学试验苗圃,树龄14年。采集时间为4—5月,此时间段采集的外植体具有最低的污染率(罗丽,2009)。
遗传转化使用的植物表达载体为pBI121,含有该表达载体的农杆菌(Agrobacteriumtumefaciens)菌株EHA105 由西北农林科技大学刘雅莉教授惠赠。
1.2 杜仲叶片的表面灭菌
采集的叶片在自来水中冲洗3 h,然后使用75%(V/V)酒精清洗30 s,再浸泡在5%(M/V)次氯酸钠溶液中5 min进行表面灭菌,消毒后用无菌蒸馏水冲洗3次,放在无菌滤纸上干燥,切成约0.5 cm×0.5 cm的小片备用。
1.3 愈伤组织的诱导与增殖
将切成小片的叶片接种于愈伤组织诱导培养基,每瓶3到4片,叶片诱导愈伤组织培养基为MS + 8.1 μmol·L-1NAA + 4.4 μmol·L-16-BA。接种后在(24±2)℃的温度下暗培养4天,再在光照条件下培养30~40天,光照周期为每日16 h,温度为(24±2) ℃。获得的叶片愈伤组织采用MS + 0.27 μmol·L-1NAA + 6.7 μmol·L-16-BA的继代培养基(金晓玲等,2014),继代周期为18天。
1.4 不定芽诱导与复壮培养基的优化
将继代培养2个周期的愈伤组织接种于含不同浓度大量元素的MS(MS,3/4MS)培养基中,添加不同浓度的NAA(0、0.27、0.54 μmol·L-1)和6-BA(0、4.4、6.7、8.8 μmol·L-1),培养3周后,统计不定芽诱导率(诱导出不定芽的愈伤组织/所有愈伤组织)。将愈伤组织诱导的不定芽接种到含不同浓度NAA(0.054、0.27 μmol·L-1)和6-BA(4.4、8.8 μmol·L-1)的MS(MS,3/4MS)培养基上进行复壮,3周后测量不定芽伸长长度。每个处理50个愈伤组织,培养条件同1.3的光照培养条件,整个试验重复3次,使用SPSS17.0对数据进行处理,采用Tukey检验进行差异分析。
1.5 杜仲愈伤组织抑菌剂和抗生素敏感性试验
遗传转化的抗性芽选择培养基以不定芽诱导培养基为基础培养基,抑菌剂为头孢霉素(Cef),筛选用的抗生素为卡那霉素(Km)。将愈伤组织分别接种于含不同浓度Cef(0、50、100、200、300 mg·L-1)和Km(0、25、50、100、200 mg·L-1)的不定芽诱导培养基中,每个处理30块愈伤组织,培养条件同1.3的光照培养条件。3周后统计不定芽诱导率,分析愈伤组织对抑菌剂和抗生素的敏感性,以获得最适合的选择培养基。
1.6 农杆菌介导的杜仲叶片愈伤组织遗传转化转化因子正交试验设计
根据农杆菌介导的杜仲下胚轴遗传转化体系(赵丹等,2009;李岩等,2011)和其他植物愈伤组织为受体的遗传转化系统(Yangetal.,2010;Abdallatetal.,2011;Trivellini,2015;黄天带等,2010;陈子龙等,2014),本试验选择了4个可能影响农杆菌介导杜仲叶片愈伤组织遗传转化效率的转化因子(预培养时间、侵染时间、共培养时间和乙酰丁香酮浓度)进行研究,通过L16(45) 的正交试验表进行试验设计,转化因子的水平如表1所示。
1.7 遗传转化操作
将-80 ℃冰箱中保存的农杆菌甘油菌使用接种环接种于固体LB培养基上划线活化,28 ℃倒置培养16 h,再挑取平板上的单克隆接种于50 mL含50 mg·L-1卡那霉素的液体LB培养基中,于28 ℃、180 r·min-1的摇床震荡过夜培养,直到OD600值达到0.6~0.7。将农杆菌悬浮液在室温下以4 000 r·min-1离心10 min收集菌体,再使用不含激素的无菌液体MS培养基重悬农杆菌,重悬至OD600值达到0.6后加入不同水平浓度的乙酰丁香酮(AS)备用。
正交试验的每个处理均使用50块愈伤组织,接种于不定芽诱导培养基中进行预培养。将预培养后的愈伤组织置于农杆菌重悬液中进行侵染,侵染后使用无菌滤纸吸干菌液,接种于普通的不定芽诱导培养基,于(24±2)℃条件下进行暗培养。
1.8 GUS组织化学染色
使用GUS组织化学染色法(Jefferson,1987)检测GUS瞬时表达效率。具体为各处理的愈伤组织在共培养后,置于X-Gluc染色液(GUS染色液,Solarbio)中,37 ℃染色6 h,使用90%(V/V)和70%(V/V)的酒精分别脱色24 h,以除去叶绿素。统计愈伤组织的染色情况,进行染色强度的评级(孟妮等,2018),并以GUS组织化学染色结果代表GUS瞬时表达效率(含蓝色GUS染色位点愈伤组织/所有愈伤组织),使用SPSS17.0进行数据处理并进行方差分析。
1.9 抗性芽的筛选
使用获得的瞬时转化体系对愈伤组织进行遗传转化操作,将共培养后愈伤组织使用CEFO水(含200 mg·L-1Cef的无菌蒸馏水)冲洗3次,再在含100 mg·L-1Cef的液体MS培养基中浸泡10 min脱毒,使用无菌滤纸吸干多余液体后,接种于选择培养基上培养,筛选获得抗性芽,培养条件同1.3的光照培养条件。筛选出的抗性芽使用GUS组织染色法(同1.8)和PCR法进行检测。
1.10 抗性芽的PCR检测
使用CTAB法从获得的抗性芽叶片中提取总DNA,以没有进行遗传转化操作的不定芽叶片DNA和pBI121质粒作为对照进行PCR检测。以NPTⅡ基因为检测标准设计特异性引物:上游引物为5′-TCACTTCGCTCGCGGAGAA-3′,下游引物为5′-AGAGGVGATAGAGCGAGATGC-3′,扩增片段长度为465 bp。PCR反应体系为:94 ℃ 3 min预变性;98 ℃变性10 s,60℃退火20 s,72 ℃延伸70 s,共30个循环;再72 ℃延伸5 min。PCR产物通过1%琼脂糖凝胶电泳进行检测。
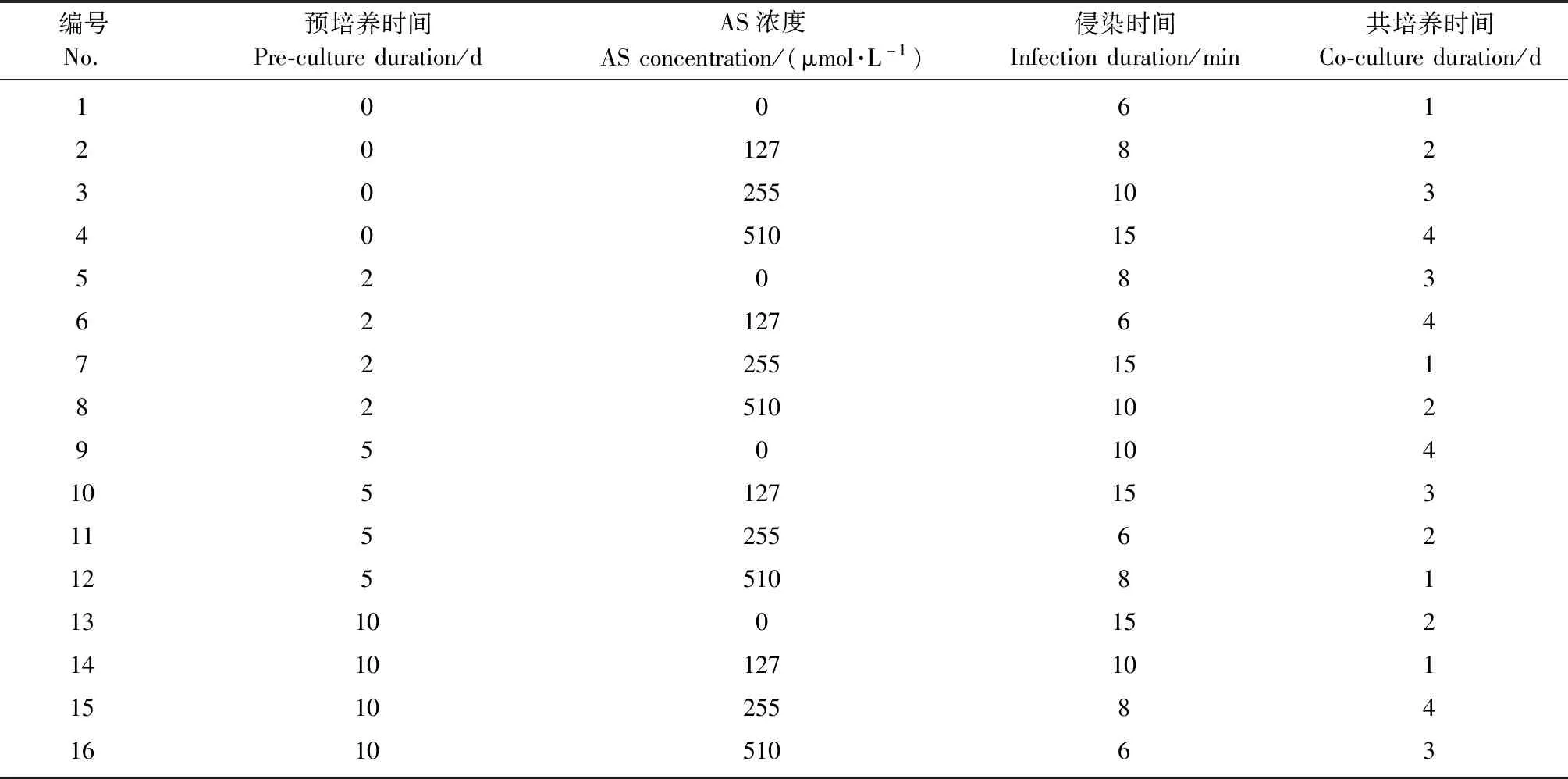
表1 转化因子正交试验①Tab.1 Factors and levels of L16 (45) orthogonal experiments
①AS:乙酰丁香酮 Acetosyringone.
2 结果与分析
2.1 大量元素与生长调节剂对杜仲叶片愈伤组织再生体系的影响
叶片接种到愈伤组织诱导培养基(MS + 8.1 μmol·L-1NAA+ 4.4 μmol·L-16-BA)上培养25天左右,叶片逐渐膨大,并在切口处出现小块愈伤组织,诱导率达90%,这些愈伤组织在几天内迅速生长(图1a),35天左右即需进行继代培养。愈伤组织接种到继代增殖培养基(MS + 0.27 μmol·L-1NAA+ 6.7 μmol·L-16-BA)进行增殖培养时,会在继代培养20天后出现褐化,因此适宜的继代培养周期为18~20天,胚性愈伤组织约在连续继代培养2次后形成(图1b),能够进行不定芽诱导。这些试验结果与金晓玲等(2014)的研究结果相似。
不定芽诱导和复壮培养基的优化试验结果(表2)表明:愈伤组织诱导不定芽的诱导率受到6-BA和NAA配比的影响,当6-BA与NAA浓度比为16∶1时,不定芽的诱导率最高。此外,3/4浓度大量元素的MS培养基的不定芽诱导率更高。在3/4MS + 0.27 μmol·L-1NAA + 4.4 μmol·L-16-BA的培养基上,不定芽诱导率最高(83%±10%),并且诱导的芽更加健康(图1c)。不定芽复壮的结果与不定芽诱导的结果相似,不定芽的伸长长度受大量元素浓度影响更显著,在3/4MS + 0.054 μmol·L-1NAA + 4.4 μmol·L-1的6-BA的培养基中芽伸长长度最长,为(2.47±1.33) cm(图1d)。
2.2 头孢霉素与卡那霉素对不定芽诱导的影响
抑菌剂与抗生素敏感性试验(表3)表明:在含有300 mg·L-1Cef和50 mg·L-1Km的MS培养基上,愈伤组织仍呈黄褐色,但是无法诱导不定芽;在含400 mg·L-1Cef和70 mg·L-1Km的MS培养基上,愈伤组织则完全褐化死亡。因此,遗传转化的选择培养基中,抑菌剂头孢霉素的浓度为200 mg·L-1,能抑菌并不会对愈伤组织产生过大影响;筛选用的抗生素卡那霉素浓度为70 mg·L-1,能够导致不含Km抗性的野生型愈伤组织死亡,从而筛选出有Km抗性的抗性芽。

图1 杜仲叶片诱导愈伤组织及其再生过程Fig.1 Callus induction and plant regeneration in E.ulmoidesa.叶片在愈伤组织诱导培养基(MS + 8.1 μmol·L-1NAA + 4.4 μmol·L-16-BA)上培养5周形成的愈伤组织;b.在继代增殖培养基(MS + 0.27 μmol·L-1 NAA + 6.7 μmol·L-1 6-BA)上继代培养2个周期的愈伤组织;c.愈伤组织在不定芽诱导培养基(3/4MS + 0.27 μmol·L-1 NAA + 4.4 μmol·L-1 6-BA)上培养2周诱导的不定芽;d.在不定芽复壮培养基(3/4MS + 0.054 μmol·L-1 NAA + 4.4 μmol·L-1)上复壮2周的不定芽;e.在不定芽复壮培养基上继代培养2次获得的植株。a.Callus induction on callus induction medium (MS with 8.1 μmol·L-1 NAA and 4.4 μmol·L-1 6-BA) after 5 weeks;b.Callus multiplication on callus subculture medium (MS with 0.27 μmol·L-1 NAA and 6.7 μmol·L-1 6-BA) after sub-cultured twice;c.Adventitious bud induction on shoot induction medium (3/4MS with 0.27 μmol·L-1 NAA and 4.4 μmol·L-16-BA) after 2 weeks;d.Shoot multiplication on shoot regeneration medium (3/4MS with 0.054 μmol·L-1 NAA and 4.4 μmol·L-1 6-BA) after 2 weeks;e.Plants on shoot regeneration medium after sub-cultured twice.
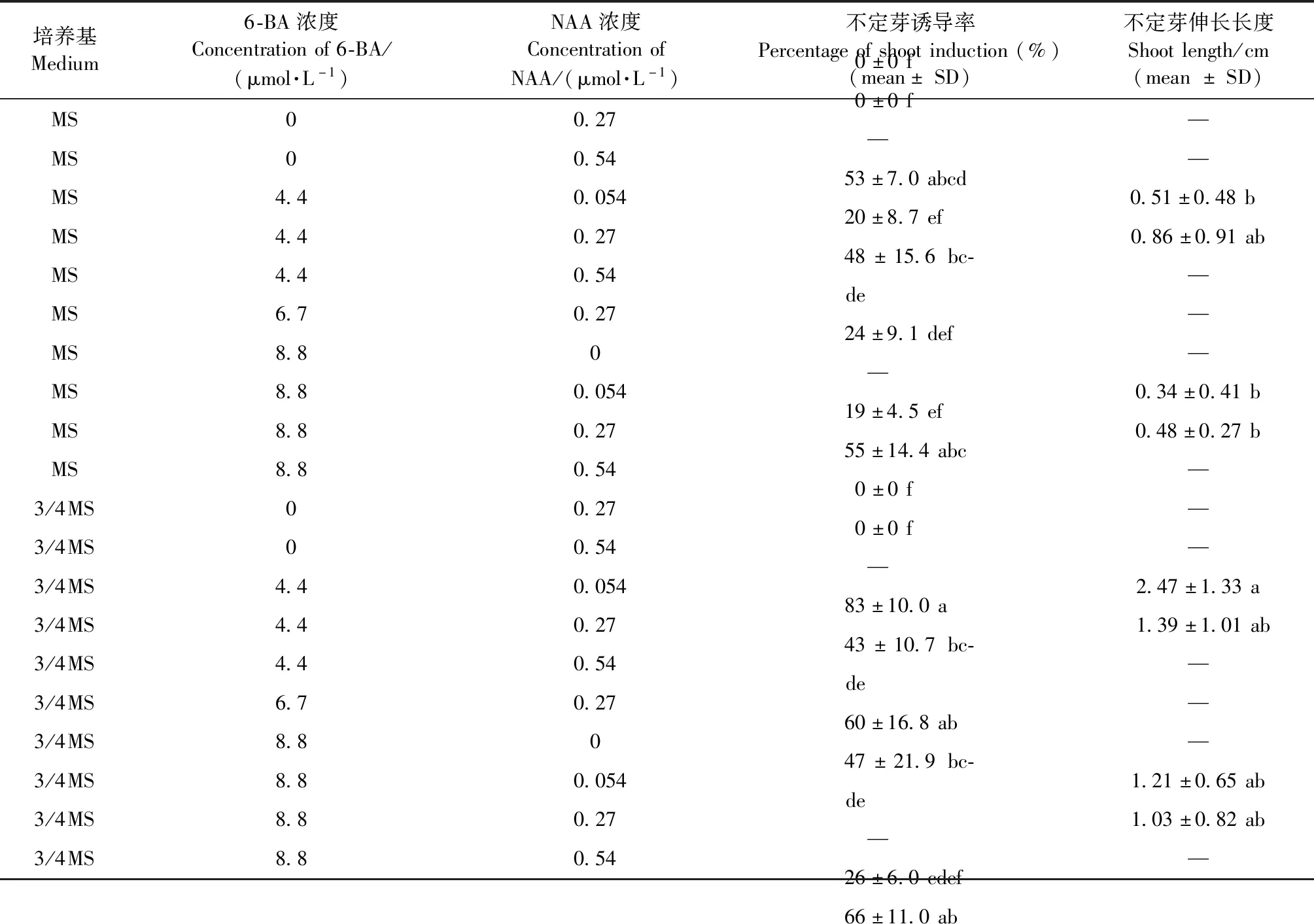
表2 不同浓度的大量元素、NAA、6-BA对杜仲不定芽诱导和复壮的影响①Tab.2 Effect of different concentrations of macro-element,NAA and 6-BA on shoot induction and regeneration
①SD表示来自3次试验重复的标准差。数据后的小写字母表示使用Tukey (P≤0.05)均值差异显著性检验所划分的差异显著性。Data represent means ± SD from 3 biological replicates.Means followed by different letters are signicantly different using a Tukey test (P≤0.05).
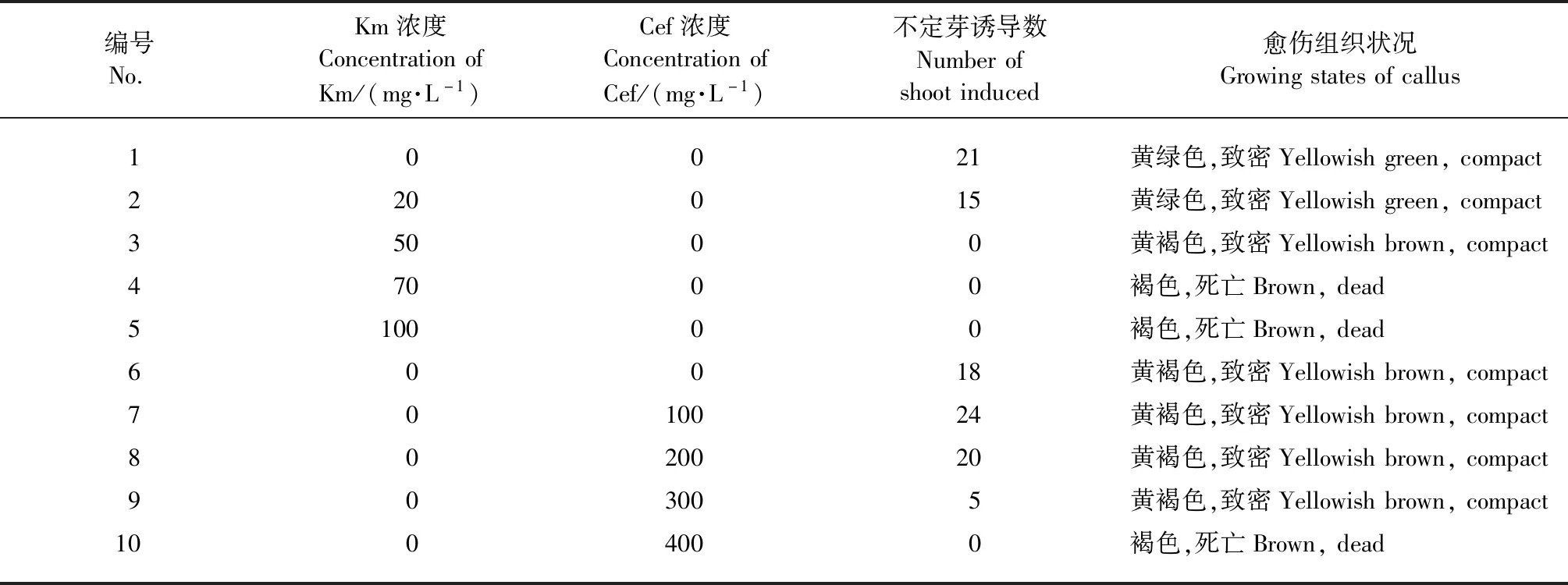
表3 头孢霉素(Cef)与卡那霉素(Km)对不定芽诱导的影响Tab.3 Effects of different concentrations of Cef and Km on shoot induction
2.3 农杆菌介导的杜仲叶片愈伤组织遗传转化的转化因子
通过L16(45)的正交试验设计(表1),共进行了16组不同水平处理的转化因子组合试验,试验结果表明:GUS瞬时表达率高的处理组合其愈伤组织染色程度(图2)也更强(表4),其中侵染时间与共培养时间对GUS瞬时表达率有显著影响(P≤0.05),即侵染时间与共培养时间显著影响农杆菌介导杜仲叶片愈伤组织遗传转化效率,而AS浓度和预培养时间的影响不显著(表5)。比较均值可以发现GUS瞬时表达率随着侵染时间和共培养时间的增加以“S形”曲线上升(侵染时间的GUS瞬时表达率均值为:6 min 22.0%、8 min 16.0%、10 min 35.0%、15 min 33.8%;共培养时间的GUS瞬时表达率均值为:1天10.8%、2天16.5%、3天38.5%、4天41.0%),侵染10 min和共培养3天的GUS瞬时表达率达到了高值;4天的共培养时间虽然瞬时表达率均值更高,但提升较小并且对愈伤组织伤害较大。此外,虽然预培养时间对GUS瞬时表达率没有显著影响,但预培养5天的GUS瞬时表达率均值高于其他预培养时间(预培养时间的GUS瞬时表达率均值为:0天24.0%、2天17.8%、5天37.5%、10天27.5%)。根据这些试验结果可以获得农杆菌介导杜仲叶片愈伤组织遗传转化的最佳转化因子组合是:预培养5天,侵染10 min,共培养3天。
2.4 抗性芽的检测
总计约200块愈伤组织进行了最适转化因子组合的农杆菌介导的遗传转化,在选择培养基上共获得3个抗Km的抗性芽(图3)。对抗性芽的叶片进行GUS组织化学染色,3个抗性芽叶片均呈蓝色,而未进行遗传转化操作的愈伤组织和不定芽叶片的GUS组织化学染色均为无色(图4),这表明GUS基因在抗性芽中得到了表达。使用NPTⅡ基因的特异引物对抗性芽、未进行遗传转化操作的不定芽叶片和pBI121质粒的PCR分析(图5)表明:在抗性植株和pBI121质粒中检测到NPTⅡ基因的465 bp扩增产物,而在未进行遗传转化的不定芽叶片中没有该扩增产物。GUS检验与PCR分析初步证明T-DNA已经整合到了这些抗性芽的基因组中。

图2 愈伤组织GUS组织化学染色评级模式Fig.2 Pattern of scoring for the histochemical GUS assay of callusa.空白对照;b.未染色;c.+(染色程度浅);d.++(染色程度中等);e.+++(染色程度强)。a.Blank control;b.Unstained;c.+(staining is shallow);d.++(staining moderate);e.+++(staining the strongest).
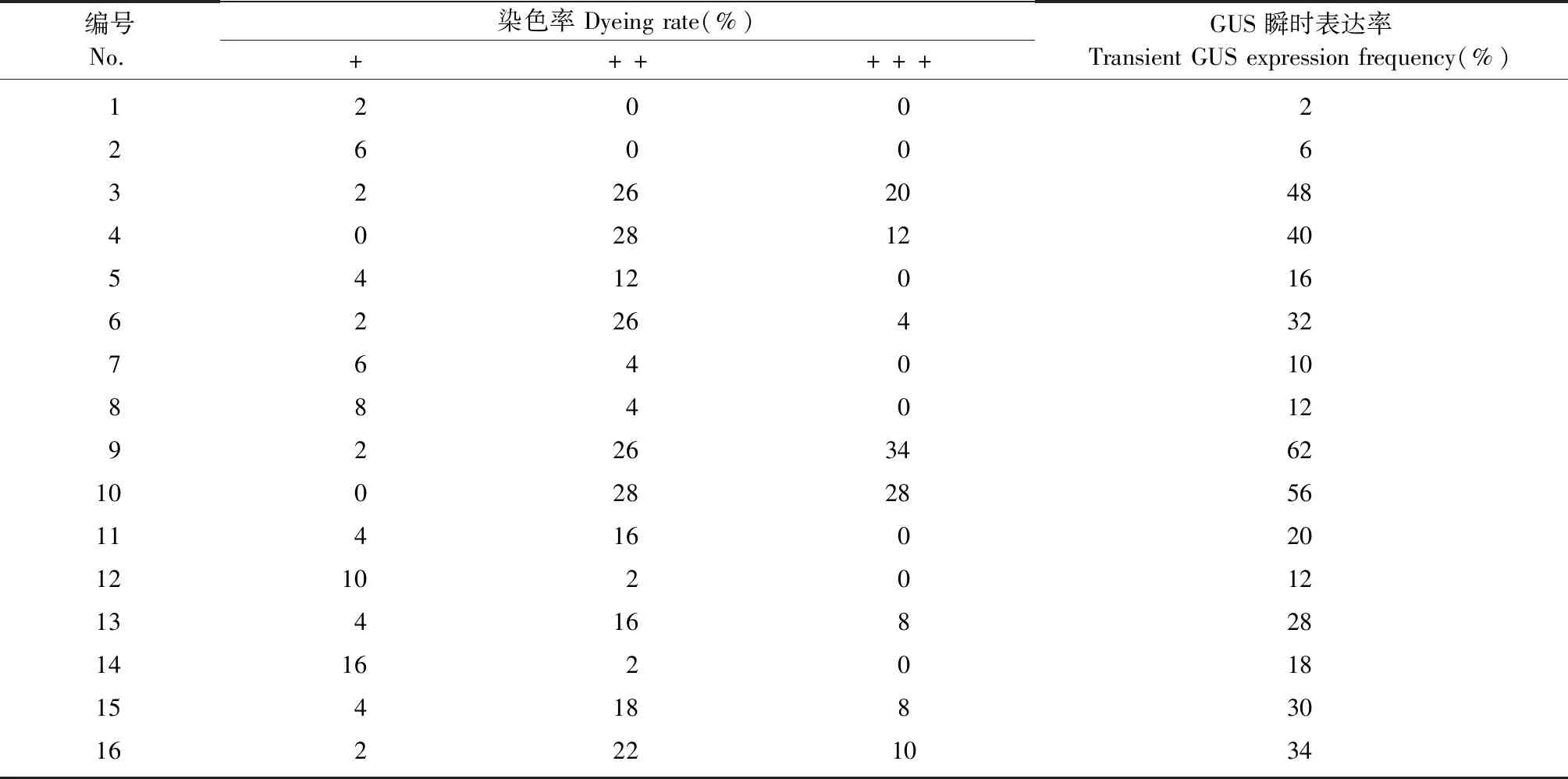
表4 转化因子正交试验的GUS瞬时表达①Tab.4 Transient GUS expression in L16 (45) matrix of factors of genetic transformation
① +、++和+++分别表示染色程度浅、中等和强的愈伤组织染色率(图2)。+,++,and +++ indicate the staining rate of the callus with a light,medium and strong level(Fig.2).
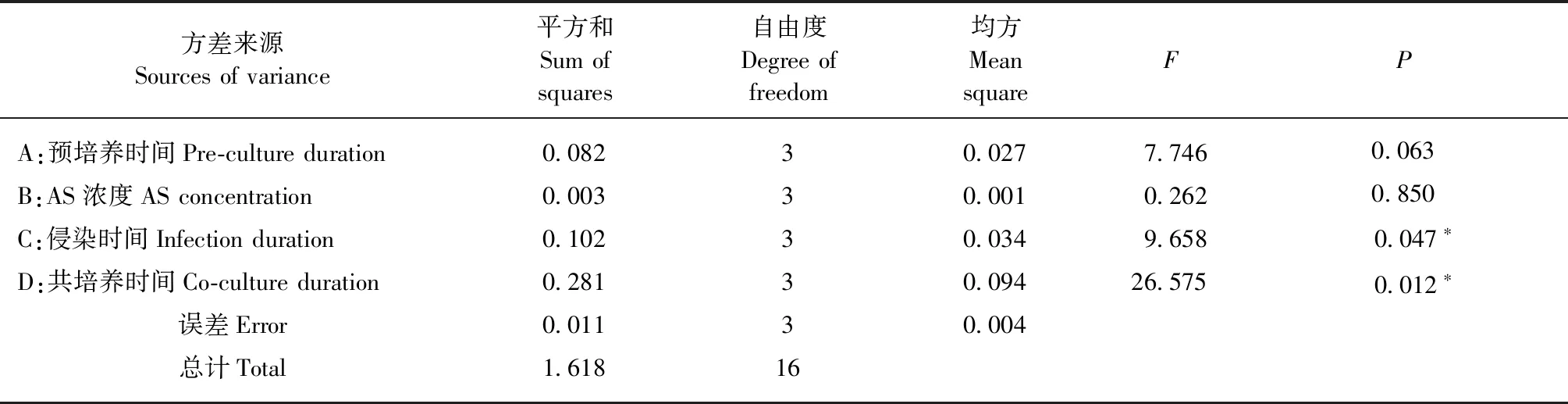
表5 转化因子正交试验GUS瞬时表达的方差分析①Tab.5 ANOVA of transient GUS expression frequency in L16 (45) matrix of factors of genetic transformation
①*:差异显著Significant difference(P<0.05).

图3 抗Km的抗性芽Fig.3 Km-resistant budsa,b,c.愈伤组织在筛选培养基上培养2周诱导出的3个抗性不定芽。a,b,c.A total of 3 Km-resistant buds induced on the selection medium (3/4MS + 0.054 μmol·L-1 NAA + 4.4 μmol·L-1 6-BA + 200 mg·L-1 Cef + 70 mg·L-1 Km) after 2 weeks.
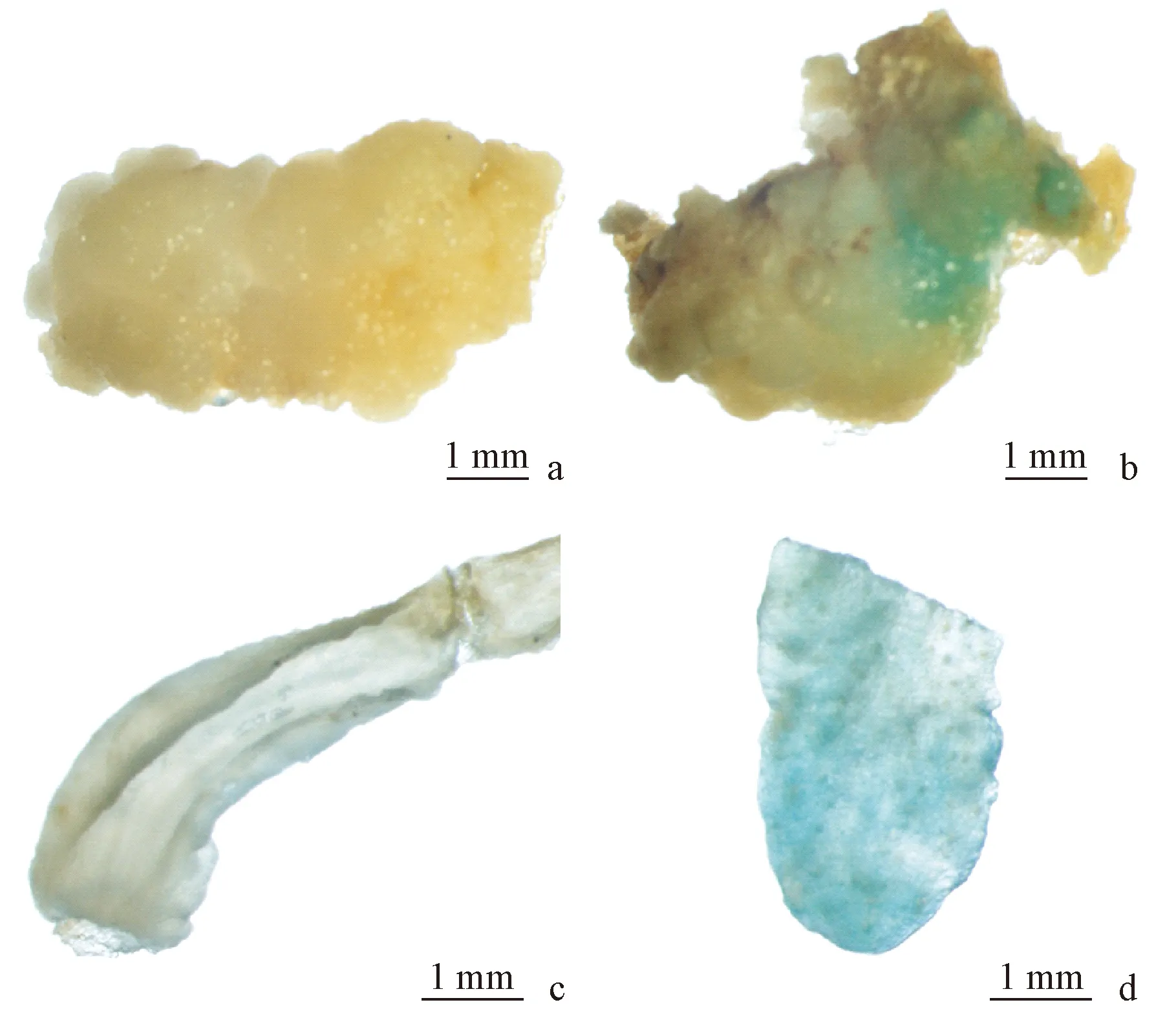
图4 愈伤组织和抗性芽叶片的GUS组织化学染色Fig.4 Transient GUS expression of callus and leaf tissues of Km-resistant budsa,c.对照组(未进行遗传转化操作)愈伤组织和不定芽叶片的GUS组织化学染色;b.最适转化因子组合进行遗传转化的愈伤组织的GUS组织化学染色;d.抗Km的抗性芽的GUS组织化学染色。a,c.GUS expression in callus and leaf tissues of controls (untransformed plants);b.GUS expression in callus of optimum transforming factors combination:pre-culture duration of 5 days,infection duration of 10 min and co-culture condition of 3 days;d.GUS expression in leaves of Km-resistant buds.
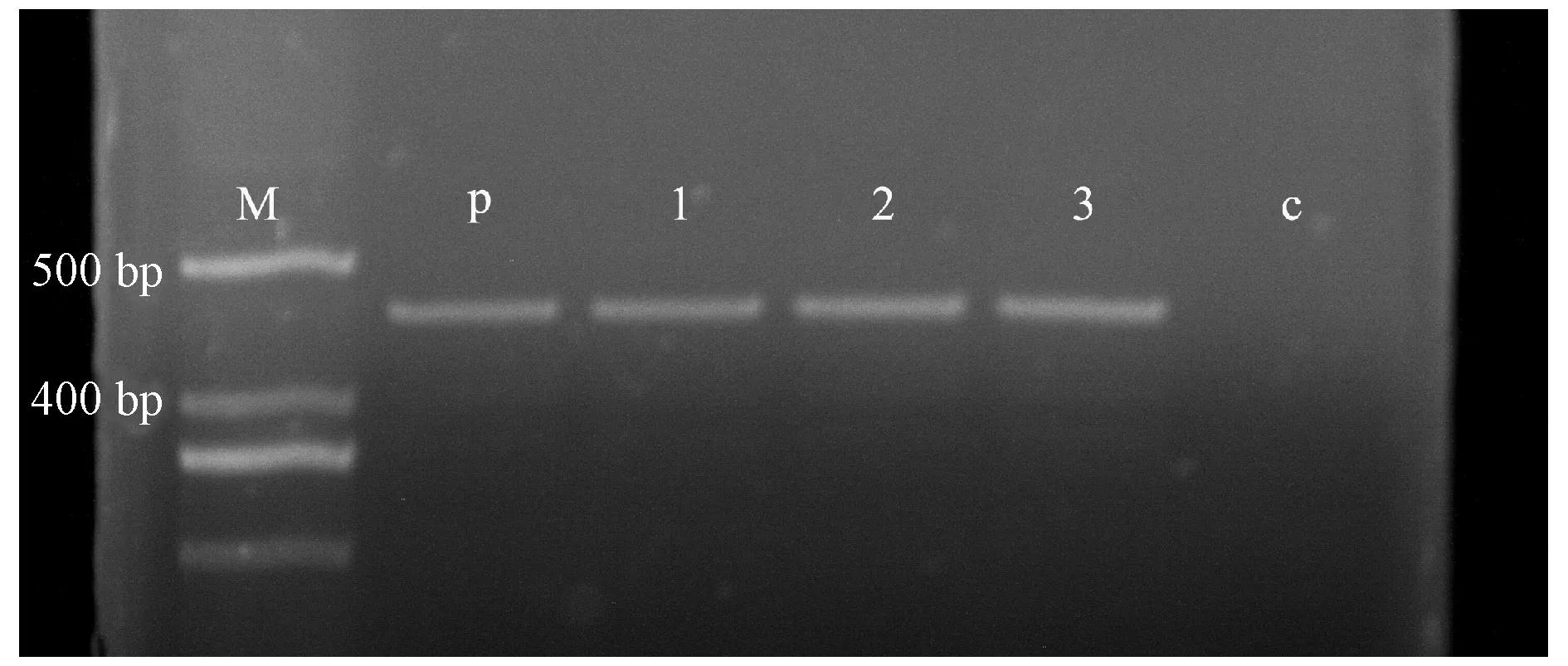
图5 抗性芽、未进行遗传转化操作的不定芽叶片和pBI121质粒的PCR分析Fig.5 PCR analysis of putative transformants, binary vector pBI121 and controlsp:pBI121质粒;c:未进行遗传转化操作的不定芽叶片;1,2,3:获得的3个抗性芽。p:Binary vector pBI121;c:Untransformed plant;1,2,3:Putative transformants.
3 讨论
本研究优化了杜仲叶片愈伤组织的再生体系,对影响农杆菌介导的杜仲叶片愈伤组织遗传转化的转化因子进行了研究。长期以来,杜仲只有一种以下胚轴为受体的遗传转化体系(赵丹等,2009;李岩等,2011),下胚轴为子代材料,无法代表该优良品种的遗传背景(Sidorovaetal.,2017)。如今,这一缺点可以通过使用成年杜仲叶片愈伤组织的遗传转化体系来克服。
构建农杆菌介导的遗传转化体系,建立受体系统的再生体系是前提条件(Gorpenchenkoetal.,2006)。本研究分析了NAA和6-BA对杜仲愈伤组织诱导不定芽以及不定芽复壮的影响,其结果与金晓玲等(2014)的研究结果相似;此外,本研究还发现MS培养基只添加3/4浓度的大量元素对杜仲叶片愈伤组织诱导不定芽以及不定芽的复壮有显著的促进作用。植物组织培养中,大量元素浓度是重要的影响因素之一,然而由于大部分试验中均使用MS培养基,大量元素浓度对杜仲再生体系的影响被忽视。一些研究表明,大量元素浓度能够显著影响不定芽的培养(Azadietal.,2010;Zhaoetal.,2014;周新华等,2017),甚至影响农杆菌介导的转化效率(Naiketal.,2011)。其原因可能是大量元素的减少使得培养基中盐浓度降低,促使酚的代谢减少,大大减轻褐化现象,而褐化是愈伤组织继代培养和不定芽诱导最主要的干扰因素之一。此外,早在1980年,Lloyd和McCown就发现山月桂(Kalmialatifolia)的茎尖培养更适合于低盐培养基,从而开发了WPM(woody plant medium)木本植物培养基(Lloydetal.,1980)。本研究的结果也表明,杜仲更加适合于低盐培养基中培养,这一结果值得进一步研究。
考虑到多因素研究的复杂性,本研究采用了正交试验研究4种转化因子(预培养时间、AS浓度、侵染时间、共培养条件)对GUS瞬时表达率的影响。结果表明侵染时间和共培养条件是影响农杆菌介导杜仲愈伤组织遗传转化的主要因素,而AS浓度和预培养时间对其影响不明显。与其他植物相同,侵染时间对杜仲愈伤组织的遗传转化至关重要,较长的时间能够提高转化效率。在本研究中,10 min的侵染时间达到了最高的GUS瞬时表达率并且有较低的愈伤组织死亡率,这一侵染时间与杜仲的下胚轴转化体系相同,但比大部分木本植物短,这可能是由于杜仲对农杆菌EHA105有更高的敏感性(李岩等,2011)。较长的共培养时间则有利于农杆菌将T-DNA转化到植物基因组中(Kondoetal.,2000)。不过,本研究的结果表明,4天共培养时间的GUS瞬时表达率均值虽高于3天,但提升较小并且对愈伤组织伤害较大,一些其他植物遗传转化的研究结果表明共培养时间不宜超过3天,长期的共培养会使农杆菌过度生长从而导致转化效率降低(Cerveraetal.,1998;Curtisetal.,1999;Yangetal.,2010)。
本研究中获得的3个抗性芽经PCR分析和GUS组织化学染色检验证明,T-DNA已整合到了抗性芽基因组中,表明这一遗传转化体系能够将基因导入成熟植株的组织培养材料中,为杜仲基因功能与遗传改良的研究奠定了基础。在今后的研究中可以进一步优化不定芽复壮后的再生体系,完善整个转化系统,获得转基因植株。
4 结论
本研究对杜仲以叶片为外植体的再生过程进行了优化,并对影响农杆菌介导的杜仲愈伤组织遗传转化因子进行了研究。结果表明,添加3/4大量元素浓度的MS培养基对不定芽诱导和复壮有显著的促进作用,愈伤组织诱导不定芽最适培养基:3/4MS + 0.27 μmol·L-1NAA + 4.4 μmol·L-16-BA,不定芽复壮的最适培养基:3/4MS + 0.054 μmol·L-1NAA + 4.4 μmol·L-16-BA。农杆菌介导杜仲叶片愈伤组织遗传转化最适合的转化因子组合为:预培养5天、侵染10 min和共培养3天,筛选培养基为3/4MS + 0.054 μmol·L-1NAA + 4.4 μmol·L-16-BA+200 mg·L-1Cef + 70 mg·L-1Km。利用此体系共获得了3个抗性芽,PCR分析和GUS组织化学染色都表明T-DNA已整合到抗性芽基因组中。

