不同生态环境下银中杨内生菌群落结构及生态位变异*
王颜波 张伟溪 丁昌俊 苏晓华
(1.林木遗传育种国家重点实验室 中国林业科学研究院林业研究所 北京 100091;2.南昌工程学院 南昌 330099)
植物内生菌是至少有一段生命周期存活于植物组织中,并对宿主没有负面影响的一类微生物群落,包括细菌、古菌和真菌等(Hallmannetal.,2011),它们在促进植物生长、营养物质积累和抵抗生物和微生物胁迫(如疾病、虫害、高温、盐或干旱等)方面发挥关键作用(Hardoimetal.,2008;Prischletal.,2012;Naveedetal.,2014)。了解微生物在植物生长发育过程中所起的作用,可以为人类开发利用微生物资源提供依据。植物内生菌群落的多样性或活性的任何变化都会对植物生长和对环境的适应产生显著影响(Redmanetal.,2011;Naveedetal.,2014;Vandenkoornhuyseetal.,2015),但也有研究表明,玉米(Zeamays)、水稻(Oryzasativa)和马铃薯(Solanumtuberosum)的内生菌更容易受到植物的不同发育阶段和病原菌的暴露时间的影响(Rascheetal.,2006;Janpenetal.,2009;Inceoluetal.,2010;Rangjaroenetal.,2014)。一些植物的内生菌是由根际微生物群落进入植物根部而形成,其多样性主要由土壤类型决定(Bulgarellietal.,2012)。植物不同部位的内生菌群落也不同,植物内生细菌与根际细菌相比,根、茎、叶中的内生细菌具有高度的差异性,每个植物器官都代表了内生细菌群落特有的生态位(Beckersetal.,2017)。
杨树(Populusspp.)是生长最快的林木之一,具有显著的经济效益,是生产生物燃料、纸浆和生物黏合剂等方面重要的原材料(Sannigrahietal.,2010)。杨树易于无性繁殖和遗传转化,具有丰富的基因组信息,也是多年生木本植物生物学研究以及植物与微生物互作研究的模式植物(Beckersetal.,2016;Beckersetal.,2017)。本研究使用16S rRNA 和内部转录间隔区 (ITS)扩增子Illumina MiSeq测序技术对分别生长在盐碱地区(大庆)和非盐碱地区(北京、齐齐哈尔)的银中杨(Populusalba×P.berolinensis)中内生细菌和真菌的多样性进行了评估,探究环境因素是否影响杨树内生菌群落结构,地上和地下部分内生菌群落是否具有差异,为植物和微生物工作研究提供参考。
1 材料与方法
1.1 试验区概况
3个试验点分别位于黑龙江省的盐碱区大庆市林源镇常围子村(46°34′N,125°08′E)(D)、非盐碱区齐齐哈尔市错海林场(47°27′N,122°51′E)(Q)和北京市房山区韩村河东营苗圃(39°37′N,115°58′E)(J)。其中,黑龙江省的2个试验点均位于松嫩平原,平均海拔146 m,属于温带大陆性季风气候,年平均气温4 ℃,降雨量415 mm;北京市试验点位于房山区东南部,属于暖温带半湿润季风大陆性气候,年平均气温11.6 ℃,降雨量602.5 mm。试验林种植密度为2 600株·hm-2,株行距为2 m。
1.2 取样方法
2017年7月于每个试验点选择3个区组,每个区组随机选择3棵银中杨植株的根和茎样本分别混合。去除凋落物层后,在距地面20 cm深度采集根系和土壤样本,同时采集地上部分枝条样本。共分析18个样本(3 × 3个根系样本DR、JR、QR;3 × 3茎段样本:DS、JS、QS)。选择直径0.3~0.5 cm的根和茎进行微生物多样性分析。此外,从每个地点随机抽取3份土壤样本进行土壤理化性质检测。根、茎和土壤样本使用冰盒保存并立即带回实验室,备用。
1.3 样品处理及DNA提取
无菌条件下,使用无菌水冲洗掉根和茎表面的灰尘和土壤,在70%的酒精中浸泡2 min,在次氯酸钠溶液(2.5%活跃Cl-)中浸泡5 min,用无菌水冲洗5遍(Beckersetal.,2016);用无菌吸水纸吸干样品表面的水分,以手术刀将根和茎段切成2~3 cm的小片段,然后保存于-80 ℃使用Power Soil DNA试剂盒(MoBio,Carlsbad,CA,USA) 提取根和茎段样品中微生物DNA。
1.4 PCR扩增和Illumina MiSeq测序
细菌16S rRNA扩增子文库的构建采用两步PCR法。第1轮PCR扩增引物序列为799F/1392R(5′-AACMGGATTAGATACCCKG-3′/5′-ACGGGCGG TGTGTRC-3′),使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)从凝胶切片中回收DNA(扩增子长度=593 bp)。第2轮PCR扩增引物序列为799F/1193R(5′-AACMGGA TTAGATACCCKG-3′/5′-ACGTCATCCCCACCTTCC-3′)。第2轮PCR产物经过纯化后使用QuantiFluor-ST (Promega,Madison,WI,USA)进行定量。同时,真菌扩增子文库构建使用特定引物ITS1F/ITS2R(5′-CTTGGTCATTTAGAGGAAGTAA-3′/5′-GC TGCGTTCTTCATCGATGC-3′)。纯化、定量步骤与细菌PCR第1轮保持一致。最后,纯化的扩增子文库由上海美吉生物医药科技有限公司的Illumina MiSeq平台双端测序[细菌(2×250 bp),真菌(2×300 bp)] (上海,中国)。
1.5 测序数据处理
测序产生的fastq原始文件使用Trimmomatic (Bolgeretal.,2014)和FLASH (Magoetal.,2011)进行质控过滤,去除低质量序列。然后计算所有剩余的唯一序列之间的两两距离,建立距离矩阵,并使用UPARSE (version 7.1 http://drive5.com/uparse/)对可操作分类单元(OTU)进行聚类(97%的序列相似性)。从数据集中删除单序列(Dickieetal.,2010)最小化测序的影响。使用UCHIME识别和移除嵌合序列(Edgaretal.,2011)。利用RDP分类器算法(http://rdp.cme.msu.edu/)和70%的置信阈值对细菌的16S rRNA和真菌的ITS序列进行分类,细菌采用Silva (SSU128) 16S rRNA数据库,真菌采用UNITE v.7 ITS数据库。随后从数据集中去除非细菌和非真菌序列。
1.6 土壤样品分析
首先通过1 mm网筛过滤土壤样品,然后采用电位法测定pH值,分别用碱解扩散法、钼锑抗比色法和乙酸铵浸提-火焰光度计法测定土壤总氮、总磷和总钾含量。土壤有机质量分数采用重铬酸钾容量法测定(Reeuwijketal.,1995)。
1.7 统计分析
各参数的差异显著性分析采用SPSS 17.0进行。采用方差分析(ANOVA)方法研究了植物不同器官(根、茎)和种植地点(北京、大庆、齐齐哈尔)对reads丰度的影响。使用FastTree(version 2.1.3 http://www.microbesonline.org/fasttree/)和 FastUniFrac(http://UniFrac.colorado.edu/)进行层级聚类(基于Bray-Curtis距离)。主坐标分析(PCoA)在R3.5.1 (http://www.R-project.org/)中进行。使用R(version 1.7.1)中indicspecies程序包多重函数进行指示种分析(Cáceresetal.,2009)。采用距离冗余分析方法(db-RDA)分析微生物与环境因子的关系。通过FastTree利用每个OTU的一个代表性序列生成系统进化树,并使用iTOL (Interactive Tree of Life)进行展示(Ivicaetal.,2011)。
2 结果与分析
2.1 Illumina测序的质量指标
细菌和真菌的扩增子文库分别测序获得有1 161 749个和1 333 593个原始reads,平均读取长度分别为502和602 bp。质控后,分别保留1 046 194个和1 068 323个高质量的reads,平均长度分别为395和281 bp。在优化PCR条件下,笔者筛选了非目标的共扩增序列(叶绿体、质体和线粒体序列),在细菌样本中发现少量线粒体序列,约占标准化后序列的0~0.03%,所有真菌样本中未发现共扩增产物。细菌和真菌扩增子序列中,能够对大部分reads进行分类,但仍有部分reads无法分类(细菌0~0.24%,真菌0.89~25.42%)。在进一步分析之前,从数据集中删除在门水平上无法分类的reads(表1)。
2.2 α多样性
α多样性的计算主要基于OTU丰富度、均匀度和Shannon指数(图1)。为了控制样品测序深度差异的影响,进一步分析之前,每个样品的序列数均进行标准化,抽平到序列数最少样本的序列数目。细菌和真菌的reads数分别标准化为35 310和1 885。根据97%的序列相似性水平,将细菌和真菌的reads分别归类为1 541和240个OTU。
除齐齐哈尔外,北京和大庆地区的植物内生菌的OTU丰富度均表现出依赖于植物器官的现象。尤其是北京地区,根中的内生细菌、真菌OUT丰富度均显著高于茎(P<0.05)(图1A、D)。对OTU均匀度的计算发现不同的植物器官(根和茎)、不同的生态环境(大庆、北京和齐齐哈尔)之间均保持在比较一致的水平(图1B、E)。对内生细菌OTU多样性的分析发现,不同器官间、不同地点间均无显著差异(图1C)。然而,除了齐齐哈尔外,北京和大庆地区的杨树根内生真菌OTU多样性高于茎。
2.3 β多样性
采用主坐标分析(PCoA)在OTU水平上对来自不同地点的银中杨根和茎样品内生菌的β多样性进行评估,分析不同样本内生菌组成结构的相似性和差异关系。基于Bray-Curtis距离算法,分别构建内生细菌和真菌的层级聚类树(图2)。在OTU水平上,北京、大庆和齐齐哈尔3个地点银中杨的茎内生细菌群落明显聚集,可以与根内生细菌清晰地区分开。主成分1解释了总变异的47.08%,主成分2解释了总变异的12.07%(图2A)。与内生细菌相同,根与茎中内生真菌可以明确区分,3个地点的银中杨茎内生真菌也无法区分,然而,北京和齐齐哈尔2个地点的根内生真菌明显聚集,可以与大庆区分开(图2C)。主成分1解释真菌总变异的25.00%,主成分2解释真菌总变异的19.64%。基于Bray-Curtis距离的层次聚类也显示相同的结果(图2B、D)。
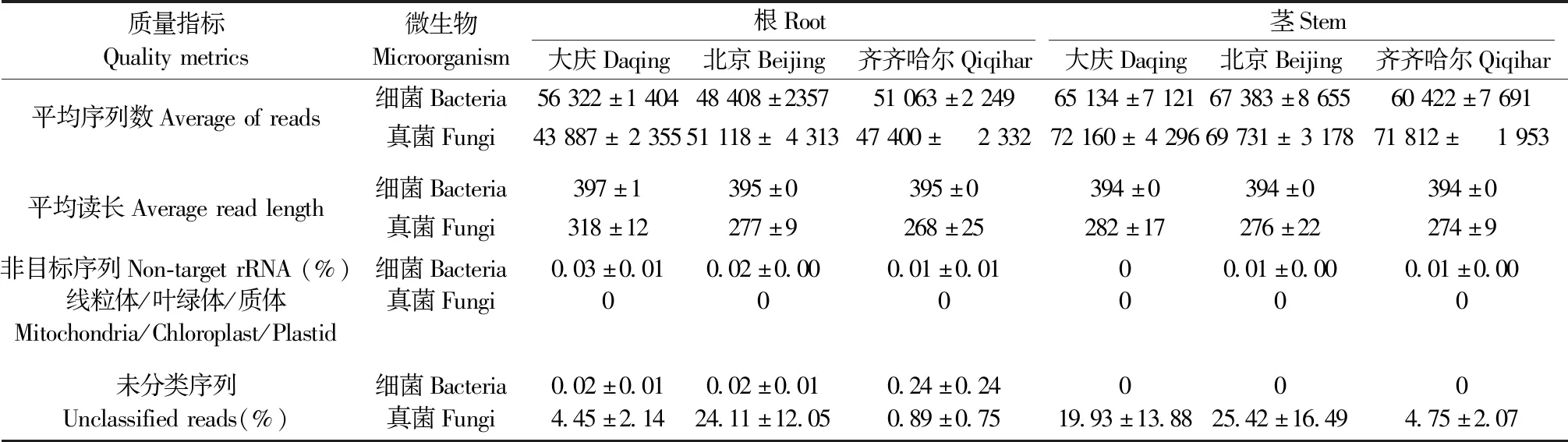
表1 Illumina测序分析的质量指标Tab.1 Quality metrics of Illumina sequencing analysis
2.4 内生菌的群落结构
在纲水平上,利用方差分析(ANOVA)来评估不同植物器官(根、茎)和银中杨不同种植点(大庆、北京和齐齐哈尔)对所有检测到内生细菌和真菌相对丰度(%)的影响。内生细菌群落主要由放线菌纲(相对丰度~50%),β-变形菌纲(~10%),α-变形菌纲(~10%),γ-变形菌纲(~5%)和拟杆菌纲(~5%)组成(图3A)。其中,在不同地点之间,α-变形菌纲细菌在大庆地区银中杨根中的丰度显著高于北京和齐齐哈尔地区(大庆:28.75%,北京:15.39%,齐齐哈尔:16.58%),酸杆菌纲细菌在齐齐哈尔地区银中杨根中的丰度显著高于北京和大庆地区(齐齐哈尔:1.65%,北京:0.25%,大庆:0.04%)。不同植物器官中,β-变形菌纲的细菌在3个地点的银中杨茎中的丰度均显著高于根。大庆和齐齐哈尔地区银中杨根中的α-变形菌纲细菌的丰度均显著高于茎。
内生真菌群落主要由座囊菌纲(相对丰度~50%),伞菌纲(~15%),子囊菌纲(~10%),在纲水平尚未分类的子囊菌门(~10%)和银耳纲(~5%)组成(图3B)。其中,在不同地点之间,在纲水平上未分类的子囊菌门的细菌在大庆地区银中杨根中的丰度显著高于北京和齐齐哈尔地区(大庆:53.49%,北京:3.01%,齐齐哈尔:0.09%)。子囊菌纲真菌在北京地区银中杨根中的丰度显著高于其他2个地区(北京:56.09%,大庆:6.63%,齐齐哈尔:2.64%)。不同植物器官中,座囊菌纲真菌在3个地点的银中杨茎中的丰度均显著高于根。大庆地区银中杨根中的伞菌纲真菌显著高于茎。
2.5 微生物群落与环境因素的相关性
计算微生物群落与环境因素之间的相关性,以检验可能导致微生物多样性变化的环境因素(表2)。根中细菌和真菌群落的距离冗余分析(db-RDA)表明,样品是根据植物栽植地点的环境因素进行划分的(图4)。Mantel检验结果显示,pH值、土壤有机质(SOM)含量和钾(K)含量与微生物群落显著相关(P<0.05),而氮(N)、磷(P)含量并不是解释杨根内生菌群落差异的重要因素(表3)。
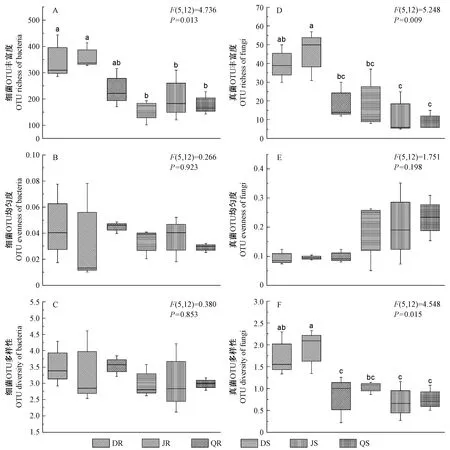
图1 内生细菌和真菌的α多样性Fig.1 Alpha diversity estimates of bacterial and fungal communities
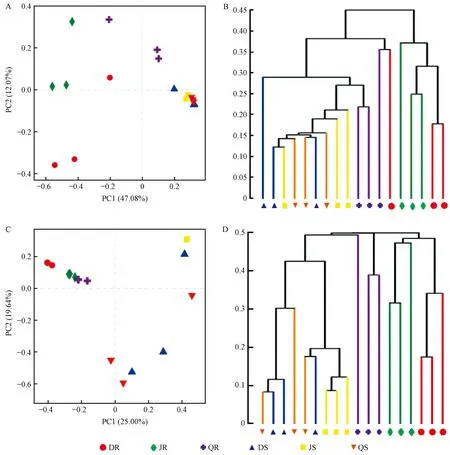
图2 内生细菌和真菌群落的主坐标(PCoA)分析和层级聚类Fig.2 Principal co-ordinates analysis (PCoA) and hierarchical clustering of bacterial and fungal communities
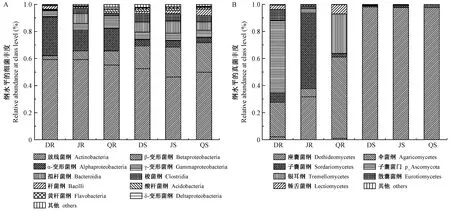
图3 纲水平上细菌和真菌的群落结构Fig.3 Bacterial community(A) and fungal community(B) structure at the class level

表2 环境因子Tab.2 Data of environmental factors
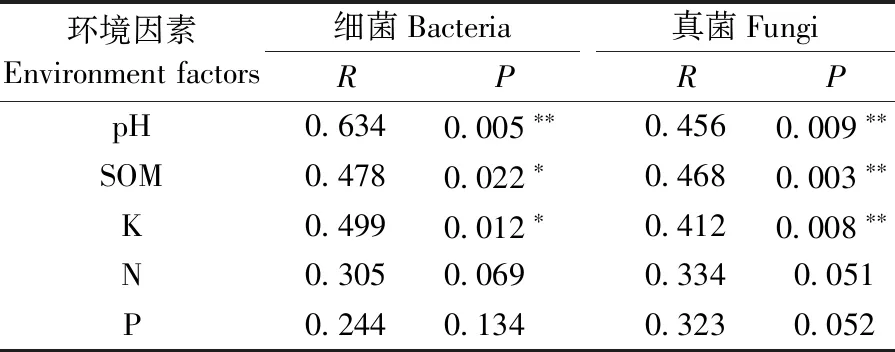
表3 微生物群落与环境因素的相关性①Tab.3 Correlation between microbial communities and environmental factors
①微生物群落与环境因子的相关性的计算基于Bray-Curtis距离算法(9 999次置换)的Mantel检验,R和P值表示相关性程度,*为P≤0.05,**为P≤0.01。Correlations between microbial communities and environmental factors were calculated using the Mantel test based on the Bray-Curtis distance algorithm (9 999 permutations).The degree of correlation is shown as the R and P-value.Significance level:*P≤ 0.05;**P≤ 0.01.
2.6 核心微生物分析
将每组中丰度排名前10的OTU定义为核心微生物,以确定不同地点生长的银中杨不同器官中的优势内生菌群。23个核心细菌OTU,归属于6个纲,分别占根和茎中细菌的64.33%和68.71%,占大庆、北京和齐齐哈尔细菌的63.63%、67.27%和68.66%(图5A)。22个核心真菌OTU,归属于7个纲,分别占根和茎中真菌的79.61%和98.34%,占大庆、北京和齐齐哈尔真菌的89.31%、81.67%和95.94%(图5B)。分别利用克氏秩和检验(Kruskal-Wallis H test)和Student T检验来分析环境因素和不同银中杨器官对核心微生物丰度的影响(表5)。其中,慢生根瘤菌属(Bradyrhizobium)和青枯菌属(Ralstonia)的根内生细菌,小球腔菌属(Leptosphaeria)、口蘑属(Tricholoma)和在属水平未分类的子囊菌门内生真菌受环境因素的影响。受银中杨不同器官影响的内生细菌有红球菌属(Rhodococcus)、根瘤菌属 (Rhizobium)、红微菌属(Rhodomicrobium)、青枯菌属(Ralstonia)、慢生根瘤菌属(Bradyrhizobium),真菌有Endosporium和属水平上未分类的子囊菌门、革菌目、格孢菌目。
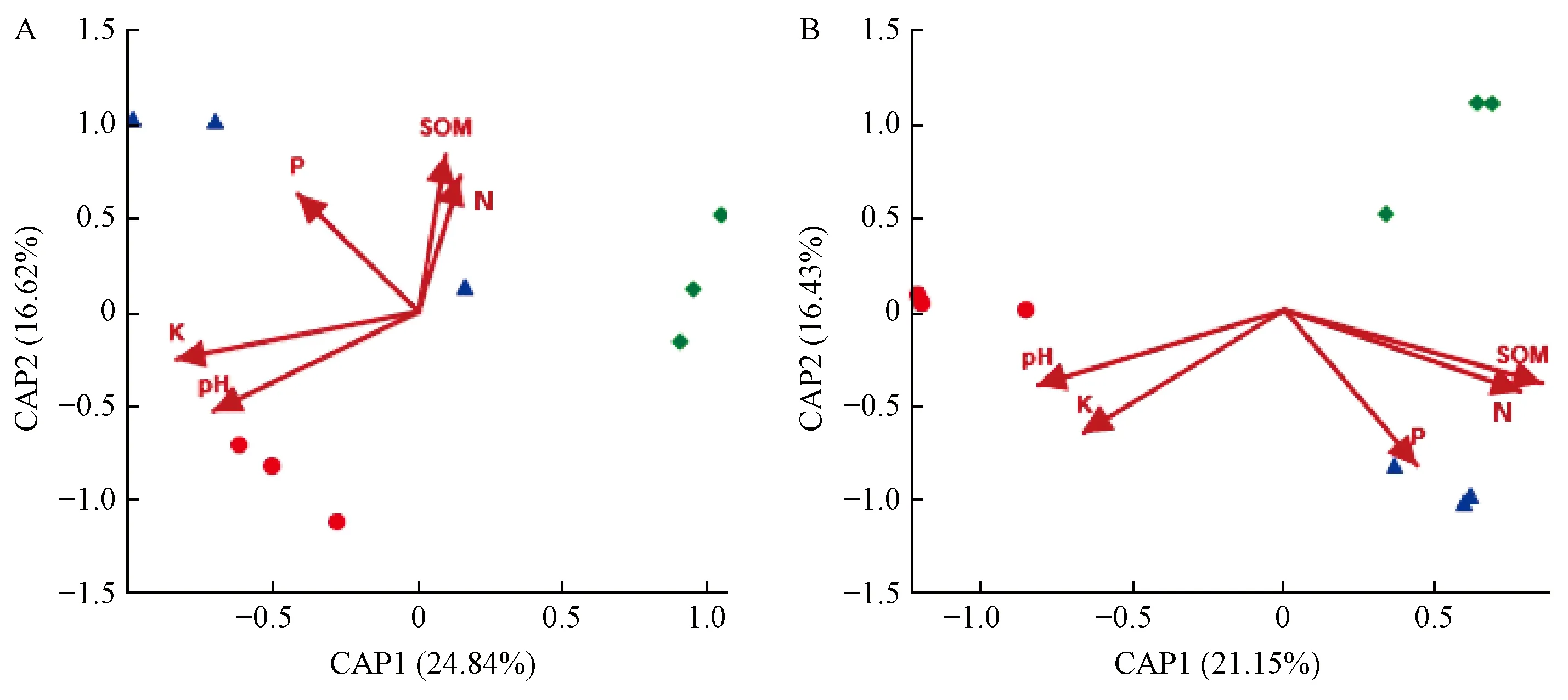
图4 根中细菌和真菌群落的距离冗余分析(db-RDA)Fig.4 Distance-based redundancy analysis (db-RDA) of bacterial community(A) and fungal community(B) in root
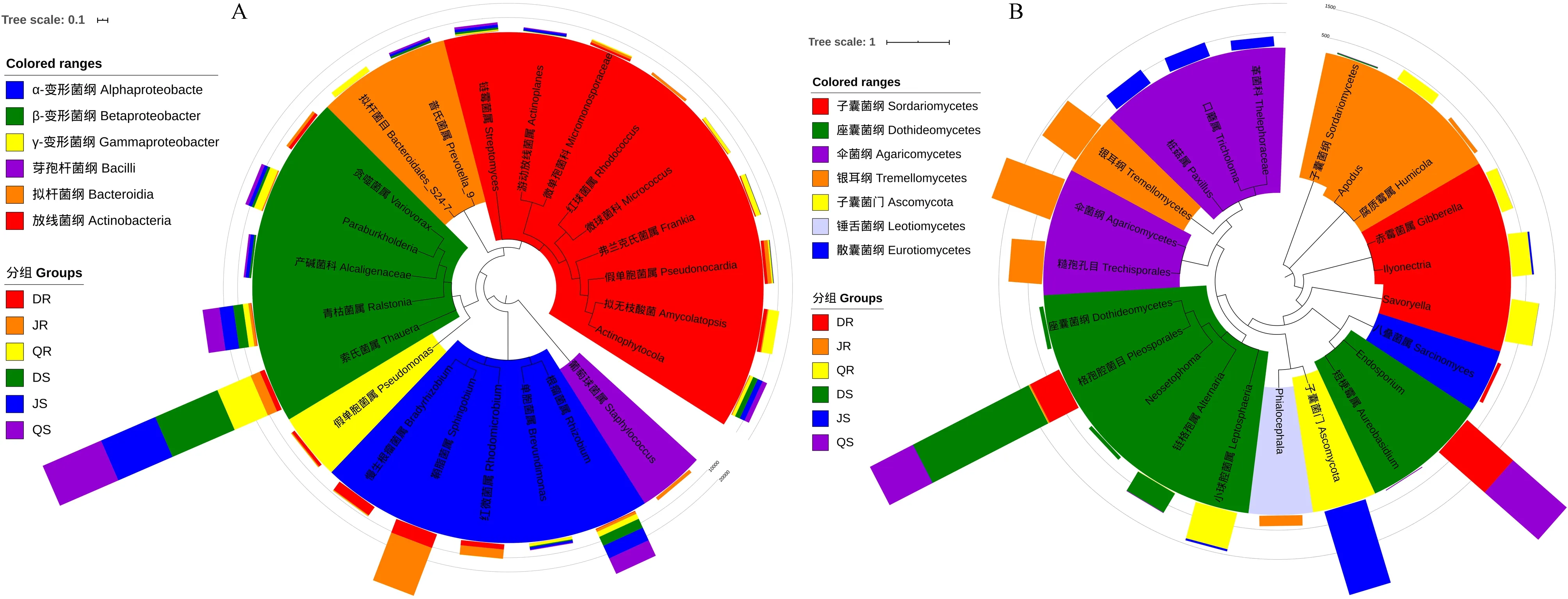
图5 内生细菌和内生真菌的核心菌群Fig.5 The core communities of endophytic bacteria and endophytic fungi

表4 种植地点和植物器官对核心内生菌结构的影响Tab.4 Plant locations and compartments effect on the endophytic structure
2.7 指示种分析
为了支持在OTU水平上克氏秩和检验和Student T检验的结果,并进一步确定银中杨不同器官间以及不同地点间内生菌群落差异是由哪些OTU决定的。运用指示物种分析,确定OTU和银中杨不同器官以及不同生长环境之间的相关性。内生细菌中分别获得了根和茎中的119和31个指示OTU。大庆、北京和齐齐哈尔3个地点的根中分别获得了23、8、8个指示OTU,茎中仅在大庆地区得到1个指示OTU。内生真菌中,分别获得了根和茎中的4和5个指示OTU;3个地点的根中分别获得了6、2、1个指示OTU,茎中仅在北京地区得到1个指示OTU。当去除了相对丰度<1%的OTU之后,共确定了7个根内生细菌指示OTU:Actinophytocola、游动放线菌属(Actinoplanes)、假诺卡氏菌属(Pseudonocardia)、红微菌属、链霉菌属(Streptomyces)、贪噬菌属(Variovorax)(P<0.01)和慢生根瘤菌属(P<0.05);5个茎内生细菌指示OTU:双歧杆菌属(Bifidobacterium)、红球菌属(P<0.01)、小杆菌属(Dialister)、粪杆菌属(Faecalibacterium)和微球菌属(Micrococcus)(P<0.05)。大庆和齐齐哈尔地区各1个指示OTU:Actinophytocola、Acidibacter(P<0.05),均位于根中。3个地点的茎中均无相对丰度>1%的指示OTU。同时,还确定了2个根内生真菌指示OTU:小球腔菌属和Ilyonectria(P<0.01);3个茎内生真菌指示OTU:格孢腔目、链格孢属(Alternaria)(P<0.01)和Endosporium(P<0.05)。大庆地区5个指示OTU:木霉属(Trichoderma)、口蘑属、锤舌菌纲、革菌科和子囊菌门(P<0.05);齐齐哈尔地区1个指示OTU:隐球菌属(Cryptococcus)(P<0.05)位于根中。北京地区1个指示OTU:Neosetophoma(P<0.05)位于茎中(表5)。
2.8 UpSetR分析
为了全面展示不同银中杨器官之间、不同种植地点之间内生菌OTU的分布,用R程序包(UpSetR)计算了各个样本中特有的和共有的OTU。结果表明,内生细菌中有51(3.30%)个OTU被6组样本共有。根内生细菌中有56(3.63%)个OTU为3个地点共有,北京和大庆地区拥有最多的共有OTU:105(6.81%)。茎内生细菌中有29(1.88%)个OTU为3个地点共有;北京和齐齐哈尔地区拥有最多的共有OTU:37(2.40%)。6个组单独特有的OTU占了总OTU数的大部分(4.54%~15.44%);其中根中特有OTU的数量大于茎(图6A)。内生真菌OTU的分布与细菌相似,有1(0.42%)个OTU被6组样本共有。根内生真菌中有4(1.67%)个OTU为3个地点共有,北京和大庆地区拥有最多的共有OTU为11个(4.58%)。茎内生细菌中有2个(0.83%)OTU为3个地点共有。6个组单独特有的OTU占了总OTU数的2.92%~29.17%;其中根中特有OTU的数量大于茎(图6B)。
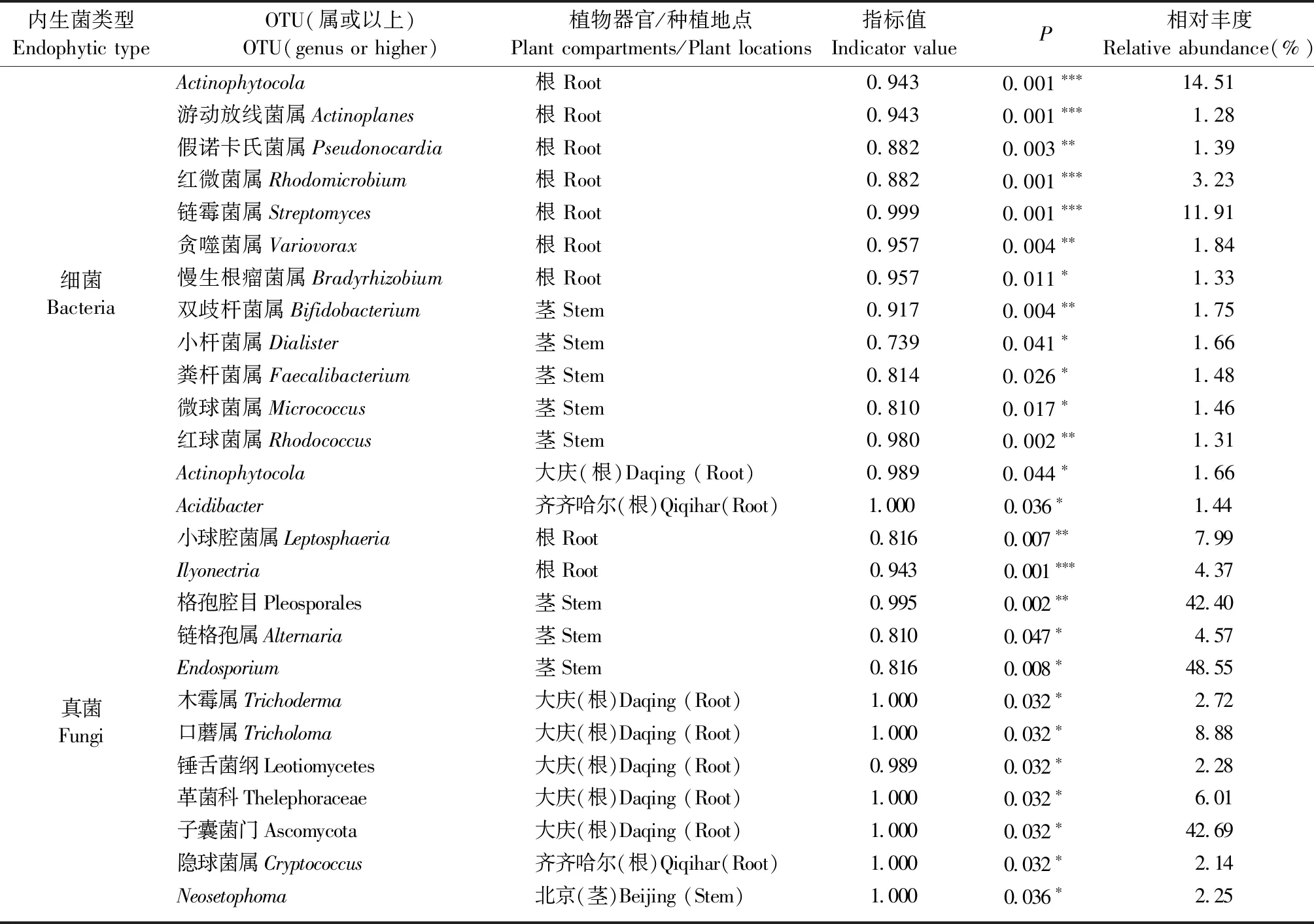
表5 指示种分析①Tab.5 Indicator species analysis
①*:P≤0.05;**:P≤0.01;***:P≤0.001。
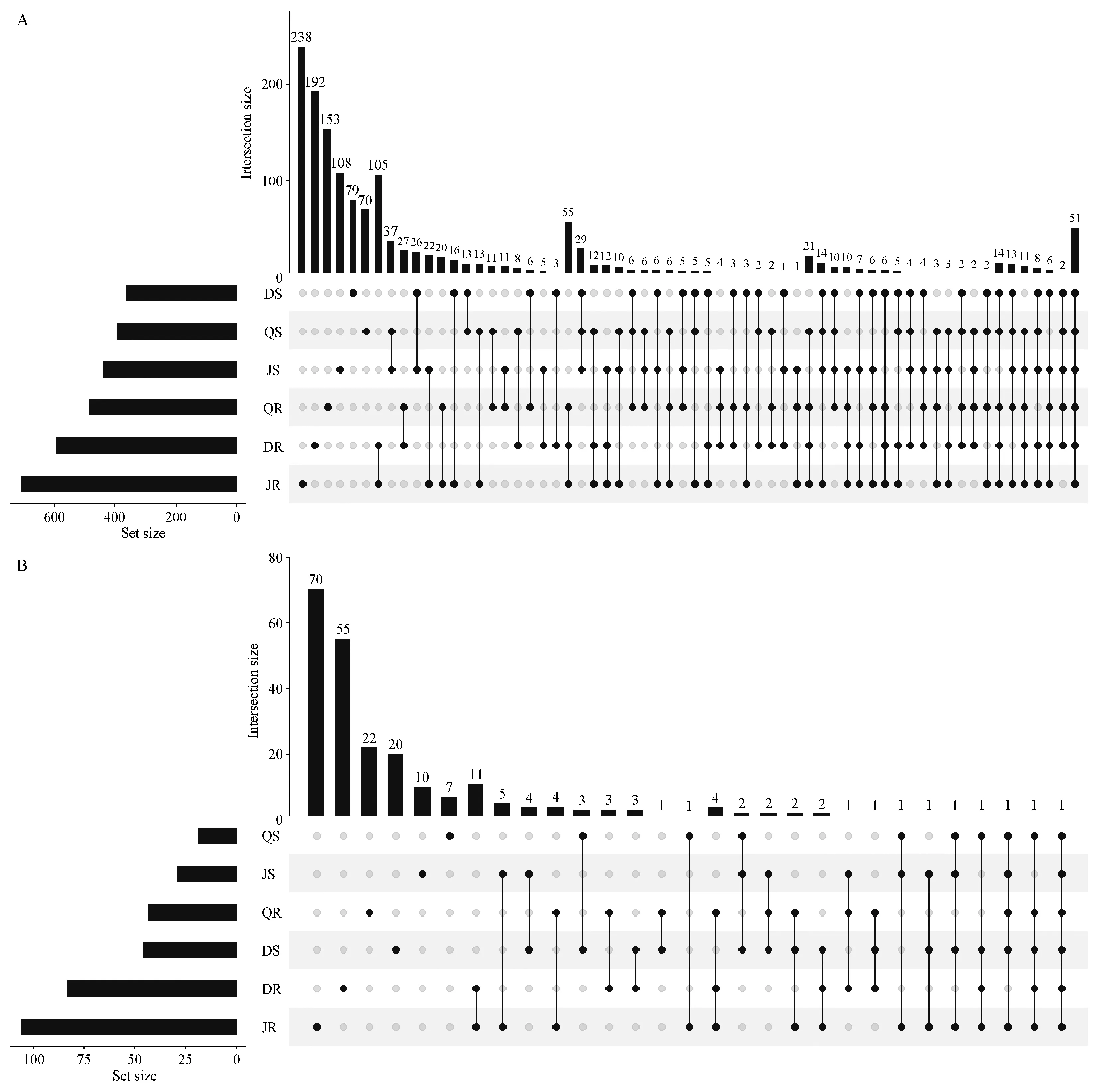
图6 样品中内生菌OTU的upset分析Fig.6 Upset analysis of endogenous microorganisms in samples
3 讨论
3.1 环境因素对银中杨内生菌群落的影响
土壤盐分含量、pH值和温度等环境因素对内生菌群落有显著影响(Podolichetal.,2014;Whitakeretal.,2018;Lozuponeetal.,2007;Yaishetal.,2016b;Thiemetal.,2018)。目前植物内生菌的研究多集中于草本植物,木本植物内生菌的研究相对较少(Kesarietal.,2013;Rozeketal.,2018)。本研究中,北京、大庆和齐齐哈尔3个地点的银中杨根内生菌群落都可以明显的区分,而茎内生菌却无法分离(图2)。在糯米(Alnusglutinosa)(Thiemetal.,2018)与海枣(Phoenixdactylifera)(Yaishetal.,2016a)内生菌的研究中也发现这一类似的现象。本研究中,在不同地点的银中杨中,pH值、土壤有机物(SOM)含量和钾含量显著影响内生菌群落(图4,表3)。这一结论与前人的研究结果相一致(Marschneretal.,2005;Lauberetal.,2009;Ishidaetal.,2009;Shakyaetal.,2013)。特别是Hartman等(2008)发现土壤pH值是土壤细菌群落变化的最佳预测因子,在门水平上,土壤中酸菌和放线菌的丰度随着pH值梯度的变化而改变。离海岸线80 m的连续样带上森林中的研究表明,沿着样带的植被和微生物群落与土壤有机质含量有较强的相关性(Meriläetal.,2010)。
银中杨根内生细菌主要以γ-变形菌纲和α-变形菌纲为主,酸杆菌门也有高水平的分布(Gotteletal.,2011;Shakyaetal.,2013),本研究发现银中杨内生细菌群落主要由放线菌纲(相对丰度~50%),β-变形菌纲(~10%),α-变形菌纲(~10%)和γ-变形菌纲(~5%)组成(图3A)。α-变形菌纲在盐碱地区(大庆)银中杨根中丰度更高,而这些菌已被证明与植物抵御逆境胁迫有关(Goębiewskietal.,2014;Thiemetal.,2018)。在非盐碱地区(齐齐哈尔),γ-变形菌纲有更高的丰度,这可能与土壤有机质含量有关(Shakyaetal.,2013)。在细菌的属水平上,慢生根瘤菌属和青枯菌属在齐齐哈尔地区的根中有较高的丰度(表4)。有研究发现慢生根瘤菌具有清除和降解污染物砷、二胺和环丙沙星的能力(Luetal.,2018;Zhangetal.,2018);青枯菌属是伯克氏菌科的细菌,能通过生产含硫的抗真菌挥发性有机化合物提高土壤的抑菌作用(Carrionetal.,2018)。在大庆地区银中杨的根中比茎中有更多的根瘤菌属细菌,根瘤菌属是豆科植物常见的共生细菌 (Azariasetal.,2015),但在玉米、水稻和燕麦(Avenasativa)(Antounetal.,1998)等非豆科植物存在,从生长在重金属污染地区的木本植物白桦(Betulaplatyphylla)和桤木(Alnuscremastogyne)的根中分离(Zlochetal.,2016)。
在本研究中,银中杨根内生真菌群落以座囊菌纲、伞菌纲、子囊菌纲和银耳纲为主。茎内生真菌主要以座囊菌纲为主(图3)。本研究结果与前人在美洲黑杨(Populusdeltoides)中的研究结果一致(Shakyaetal.,2013)。盐碱地区(大庆)银中杨根中子囊菌门丰度达到53.49%,显著高于其他2个地点,有研究已证明子囊菌门在盐碱地土壤中有高丰度的分布,且与土壤碱解氮相关性最大(王艳云等,2016)。小球腔菌的活性次级代谢产物具有抗真菌、酶抑制及植物细胞毒活性等多种生物学活性(刘丛丛等,2017)。小球腔菌属在北京地区根中相对丰度较高(22.71%),这可能是由于北京地区并非银中杨的适生区而引起的。
3.2 银中杨根与茎内生菌群落的生态位差异
本研究评估了银中杨不同器官中内生菌群落的差异,发现内生菌的丰度因器官而不同,根比茎具有更高的丰度,这些结果与内生菌定殖的基本观点一致。土壤中根际微生物群落丰富,部分细菌可主动或被动移动通过内皮层和中柱鞘,到达木质部导管,最终在植物体内定殖(Hardoimetal.,2008;Compantetal.,2009)。采用PCoA和层次聚类分析比较细菌和真菌群落结构发现,内生细菌和内生真菌在纲和属水平上都严格根据植物器官聚类。这种生态位的差异在杨树(Populustremula×Populusalba)(Beckersetal.,2016)、仙人掌(Opuntiastricta)(Fonseca-Garcíaetal.,2016)、柳(Salixbabylonica)(Tardifetal.,2016)均有报道。本研究中,根和茎中分别有约13%和6%的独有细菌OTU,约20%和6%的独有真菌OTU,这很大程度上是由于植物微环境或生态位(根和茎)中存在相关的生物和非生物梯度,如可溶性有机化合物的有效性等(Bulgarellietal.,2013)。
在属水平上,根系内生细菌群落以链霉菌属、慢生根瘤菌属和根瘤菌属为主;茎内生细菌群落以红球菌属和青枯菌属为主。这些细菌已在许多植物中被发现,可能对植物的健康和生长有益(华苟根等,2003;Ulrichetal.,2008;Yuetal.,2015;Liuetal.,2017)。这种根内生链霉菌属、慢生根瘤菌属和根瘤菌属的分布模式使得根与根际微生物种群达到最大限度的接触和相互作用(Singhetal.,2018)。有研究表明,红球菌属的成员之一带化红球菌(Rhodococcusfascians)是一种致畸植物病原菌,通常与细胞分裂素有关,并且能通过吲哚-3-丙酮酸(IPyA)途径产生吲哚乙酸(IAA) (Vandeputteetal.,2005)。青枯菌属为伯克氏菌科细菌,在伯克氏菌科的基因组中,参与芳香族化合物降解的基因多达30个,为环境中有机污染物的降解提供了合适的途径和微生物(Perez-Pantojaetal.,2012;Lunsmannetal.,2016)。内生真菌Endosporium和格孢菌目在茎中占优势,而根中以子囊菌门和革菌目为主。Endosporium属于Myriangales,已有研究者从杨树(Populusspp.)的芽和嫩枝中分离得到(Tsunedaetal.,2000;2008)。革菌目的所有真菌都是外生菌根,与植物的根形成互惠互利的关系(Hibbettetal.,2007)。
4 结论
银中杨根内生细菌和真菌群落结构取决于土壤的pH值、有机物含量和钾含量;而氮、磷含量并不是解释银中杨根内生微生物群落差异的重要因素。即使在不同的环境条件下,茎干中的微生物群落可保持稳定。此外,证实了在根和茎中的微生物群落生态位分化,每个植物器官代表了一个微生物群落的独特生态位。最后,确定了与银中杨不同器官和不同环境条件相关的指示OTU和核心微生物。

