钙结合蛋白S100A16对胰岛素抵抗的作用研究
S100蛋白在脊椎动物中是一个高度保守的家族,于1965年被首次发现,可与钙离子合并调控细胞内外的各种活动[1-2]。A16是其中一个成员,对于机体生理活动十分重要,全身敲除S100A16 基因的纯合子小鼠难以存活[3]。它的过表达又可促进3T3-L1细胞的脂质合成,同时引起胰岛素抵抗[4]。
胎球蛋白A是人类AHSG基因的蛋白产物,是胰岛素受体酪氨酸激酶的天然抑制剂,可抑制其将胰岛素受体底物(insulin receptor substrates,IRSs)磷酸化,引起胰岛素抵抗[5]。在肝脏中,过表达AHSG可引起肝脏脂肪变性[6]。本课题组之前的研究揭示,S100A16 可通过内质网应激通路促进肝脏脂肪沉积,而胎球蛋白A的表达也受到内质网应激通路的调控,引起代谢紊乱和肝脏脂肪变性[7-8]。由此推测,S100A16 可能调节胎球蛋白A的表达水平。
根据本课题组以前的研究得知,胰岛素受体底物2(insulin receptor substrate-2,IRS-2)的表达水平与胰岛素抵抗密切相关,发生胰岛素抵抗时IRS-2表达下降[9]。因此,本研究旨在根据IRS-2蛋白的表达水平探究S100A16是否通过胎球蛋白A促进HepG2细胞的胰岛素抵抗。
材料与方法
一、药物和试剂
HepG2细胞(ATCC®HB-8065TM)(美国ATCC);100 mm细胞培养皿(430167)与六孔板(3516)(美国Corning Incorporated公司);胰岛素(I8830)(北京索莱宝科技有限公司);吡格列酮(HY-13956)(美国MedChemExpress公司);过表达S100A16 质粒、干扰S100A16表达的shRNA 质粒及Vector对照质粒(南京金斯瑞生物科技有限公司);蛋白A琼脂糖珠(88846)、Lipofectamine 3000 Reagent(L3000001)(美国Thermo Fisher Scientific公司);DMEM 高糖培养基(SH30022)(美国HyClone公司);特级胎牛血清(04-001-1A)(以色列Biological Industries公司);RIPA细胞裂解液(BB- 3201- 1)、SDS-PAGE蛋白上样缓冲液(5X)(BB-3703- 1)(上海贝博生物有限公司);NP-40细胞裂解液(P0013F)(上海碧云天生物技术有限公司);多克隆S100A16 抗体(11456-1-AP)、单克隆胎球蛋白A 抗体(66094-1-Ig)和多克隆GAPDH 抗体(10494- 1-AP)(武汉三鹰生物技术有限公司);多克隆IRS-2 抗体(#3089)(美国Cell Signaling Technology公司)。
二、方法
1.研究设计与分组:用S100A16 抗体进行免疫沉淀,然后用蛋白质谱分析寻找与S100A16 相互作用的蛋白,尤其关注是否与胎球蛋白A 存在相互作用。实验1 用干扰S100A16表达的shRNA质粒、S100A16 过表达质粒和Vector 质粒转染HepG2细胞,转染Vector 质粒的细胞作为对照,转染shRNA和S100A16 过表达质粒干预作为处理组。用Western blot 验证S100A16是否调节胎球蛋白A的表达。实验2以用胰岛素慢性刺激细胞构建胰岛素抵抗模型,未转染及转染Vector 质粒的细胞作为对照,用转染shRNA 质粒干预作为处理组,验证胰岛素抵抗条件下S100A16表达的降低是否可以使IRS-2的表达水平回升。实验3在胰岛素抵抗模型中,无吡格列酮处理的作为对照,一部分细胞用10 μmol/L 吡格列酮进行处理,用以探究S100A16对HepG2细胞胰岛素抵抗的作用是否通过胎球蛋白A 进行。构建胰岛素抵抗模型:细胞状态良好时均匀接种于六孔板,待细胞长约80﹪融合度时以不含血清的DMEM 高糖培养基培养,用Lipofectamine 3000 Reagent 将干扰S100A16表达的shRNA 质粒和Vector对照质粒转染入细胞中等待4~6 h。在其中一组细胞培养基中加入胰岛素,控制其浓度为0.1 μmol/L,36 h 后用于实验[9]。
2.质粒转染:HepG2 人肝癌细胞置于含10﹪胎牛血清的DMEM 高糖培养基中,37℃、5﹪CO2饱和湿度的条件下培养,每隔1天换培养液1次。细胞状态良好时均匀接种于六孔板,待细胞长到80﹪融合度时用Lipofectamine 3000 Reagent 分别将过表达S100A16 质粒、干扰S100A16表达的shRNA 质粒和Vector对照质粒转染入细胞中。待细胞长到90﹪以上融合度时,用于实验。
3.免疫沉淀和蛋白质谱分析:将长满细胞的100 mm 培养皿中的培养液去除,加入300 μl 经预冷含有蛋白酶抑制剂的NP-40细胞裂解液,用细胞铲将细胞刮下,于冰上缓慢摇晃20 min,使其充分裂解,然后于4℃离心机中13 800×g离心15 min,取上清液。用BCA 法测定蛋白浓度。总蛋白每1 ml 加入100 μl胎球蛋白A 琼脂糖珠,于4℃摇晃10 min,以除去非特异性结合蛋白,于4℃离心机中13 800×g离心15 min,取上清,将浓度稀释至1 μg/μl,取500 μl 总蛋白加入10 μl S100A16 抗体,于4℃轻微摇晃过夜;加入100 μl胎球蛋白A,于4℃轻微摇晃6 h,于4℃离心机13 800×g离心5 s,弃上清,得琼脂糖珠-抗原抗体复合物。用预冷的裂解液洗3 遍,再用60 μl 裂解液将复合物悬浮,放于95℃水浴锅中10 min,取上清液,委托南京医科大学分析测试中心用飞行时间质谱仪(AB Sciex TripleTOF®5600+,美国)进行蛋白质谱分析。
4.用吡格列酮抑制胎球蛋白A的表达:未转染细胞以上述方法用胰岛素处理12 h 后,在其中一组细胞培养基中加入吡格列酮使其浓度达到10 μmol/ L,24 h 后用于实验[10-11]。
5.Western blot 检测蛋白表达:将六孔板中细胞培养液去除,PBS 洗2 遍,每孔加入80 μl 经预冷含有蛋白酶抑制剂的RIPA细胞裂解液,用细胞铲将细胞刮下。将含有细胞的裂解液吸入容量为1.5 ml的EP 管中,于冰上裂解20 min,每5 分钟振荡1次,充分裂解后于4℃离心机中13 800×g离心15 min,取上清为细胞总蛋白。用BCA 法测定各组蛋白浓度。加入SDS-PAGE蛋白上样缓冲液后放于100℃水浴锅中10 min,使其充分变性,制成蛋白样品。根据蛋白浓度取各组样品40 μg,以80 V 电压用12 ﹪的SDS-PAGE 胶分离蛋白,以95 V的电压用湿转法将蛋白转移至PVDF 膜上,用含5 ﹪脱脂奶粉的TBST(0.1 ﹪Tween-20)将膜于室温下封闭1.5 h,将膜裁开,印有不同蛋白的膜分别加入不同蛋白的一抗,于4℃冰箱轻微振荡过夜。洗膜3次,加辣根过氧化物酶标记的相同种属二抗,室温轻摇2 h,再洗膜3次,用ECL 显影剂曝光。
三、统计学分析方法
采用 SPSS 25.0软件进行统计学分析,Western blot 条带灰度值(目的蛋白与内参蛋白之比)以±s表示,组间比较采用成组t检验,以P< 0.05为差异有统计学意义。
结 果
一、S100A16促进胎球蛋白A的表达
质谱结果显示胎球蛋白A 可被S100A16 抗体富集并沉淀(图1)。在转染了干扰S100A16表达的shRNA 质粒的细胞中,与转染Vector 质粒的细胞比较,胎球蛋白A蛋白表达(0.36±0.03 比0.20±0.03)水平降低(t= 6.439,P= 0.003),IRS-2表达(0.76±0.06 比0.90±0.04)水升高(t= 3.133,P= 0.035,图 2a);在转染了S100A16 过表达质粒后,与转染Vector 质粒比较,细胞的胎球蛋白A蛋白表达(1.39±0.54 比2.85±0.25)水平升高(t=4.274,P= 0.013),IRS-2表达(0.73±0.11 比0.33±0.11)水平降低(t= 4.385,P= 0.012,图2b)。
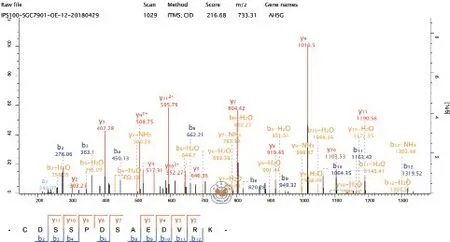
图1 胎球蛋白A的质谱
二、胰岛素抵抗条件下S100A16 抑制IRS-2的表达
用慢性胰岛素刺激后,细胞中S100A16蛋白表达(0.53±0.15 比1.03±0.19)水平上升(t= 4.027,P= 0.007),IRS-2蛋白表达(2.28±0.78比0.16±0.07)水平下降(t=5.428,P= 0.002)。与未转染及转染Vector 质粒的细胞比较,转染shRNA 质粒的细胞IRS-2蛋白的表达(0.11±0.04比1.65±0.48)水平上升,差异具有统计学意义(t=5.569,P= 0.005,图3)。
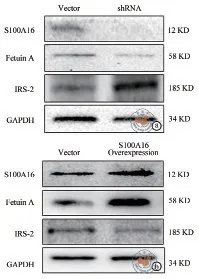
图2 S100A16 调节胎球蛋白A 以及IRS-2的表达

图3 S100A16在胰岛素抵抗条件下抑制IRS-2的表达
三、S100A16 通过胎球蛋白A 下调IRS-2的表达
与无吡格列酮处理比较,用10 μmol/L 吡格列酮处理IRS-2蛋白的表达(0.26±0.11 比0.52±0.05)水平上升,差异具有统计学意义(t=4.327,P= 0.005,图4)。

图4 S100A16 通过胎球蛋白A 下调IRS-2的表达
讨 论
胰岛素抵抗常见于2 型糖尿病、非酒精性脂肪性肝病等疾病,发生的机制尚不完全清楚。发生胰岛素抵抗时,器官对于胰岛素的敏感性大大下降,这就使得胰岛素作为信号分子无法正常发挥它的作用。IRS-2蛋白,可通过下游通路调节一系列的糖脂代谢活动,同时也能调控葡萄糖-6-磷酸酶和磷酸烯醇式丙酮酸羧激酶等代谢关键酶的表达[12-13]。IRS-2 主要在细胞骨架上的高密度小体复合物中磷酸化,持续慢性胰岛素刺激使其释放入细胞液而无法与胰岛素受体充分接触并磷酸化,最终导致IRS- 2的降解[14]。
非酒精性脂肪性肝病是指除酒精外和其他明确的损肝伤因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,可转化为肝硬化和肝细胞癌,并参与2 型糖尿病的发病。根据最近的研究表明,在动物模型和患有非酒精性脂肪性肝病的患者体内,肝脏发生胰岛素抵抗,IRS-2蛋白表达水平下降,使胰岛素信号通路失去了对葡萄糖-6-磷酸酶和磷酸烯醇式丙酮酸羧激酶等关键酶的抑制作用,从而增强了肝脏的糖异生作用[12]。另有研究表明,几乎所有非酒精性脂肪性肝病的患者都存在肝胰岛素抵抗,并且增加了2 型糖尿病的风险[15]。因此,本研究对于非酒精性脂肪性肝病和2 型糖尿病的机制做出了补充。由于肝脏是人体主要的代谢器官之一,也是接受胰岛素作用最重要的靶器官之一,又因为目的蛋白S100A16、胎球蛋白A和IRS-2均与肝脏脂肪变性和代谢紊乱密切相关,本研究决定采用人肝癌细胞HepG2 进行。
胎球蛋白A为分泌蛋白,主要在肝脏中表达,也可进入血浆中发挥其生理作用,内质网应激反应可上调其表达水平并由此促进肝脏脂肪变性[6,8,16]。本课题组之前的研究揭示S100A16 与热休克蛋白A5 相互作用并通过内质网应激促进肝脏脂肪合成,由此推测胎球蛋白A的表达可能受到S100A16的调节[7]。质谱结果提示S100A16 与胎球蛋白A 存在相互作用。Western blot 结果说明S100A16 可上调胎球蛋白A的表达并促进胰岛素抵抗。细胞在转染了抑制S100A16的shRNA 质粒后构建胰岛素抵抗模型,IRS-2表达水平较对照组2回升,说明S100A16表达水平的下调可在一定程度上恢复IRS-2的表达水平,反映出胰岛素抵抗条件下S100A16 通过抑制IRS-2的表达加强胰岛素抵抗。而转染过表达S100A16 质粒后诱导胰岛素抵抗使细胞大量死亡。从文献中得知,吡格列酮可作为胎球蛋白A蛋白的特异性抑制剂,在正常生理条件下也可发挥作用[10-11]。在胰岛素抵抗模型中加入一定量吡格列酮,IRS-2表达水平较对照组3 上升,说明S100A16对IRS-2的下调作用是通过胎球蛋白A 实现的,反映出胎球蛋白A是S100A16促进胰岛素抵抗过程中重要的一环。S100A16 调控胎球蛋白A的方法可能具有多种形式。除经过内质网应激通路外,它可能促进AHSG基因的转录,因为S100A16是胞内小分子蛋白并可进入细胞核发挥促进或抑制转录的作用[17]。这有赖于在以后的研究中凝胶迁移或电泳迁移率实验、荧光素酶报告基因实验和染色质免疫沉淀实验的进行。
当然,胰岛素抵抗往往在一个机体的各个器官和组织中同时发生,主要体现在肝脏、骨骼肌和脂肪组织中,仅用HepG2细胞建立胰岛素抵抗的细胞模型无法模拟胰岛素抵抗患者的体内环境,也不能普遍性地描述所有器官和组织发生胰岛素抵抗时的情况。因此,动物实验还有待进行下去。另外,胎球蛋白A是由肝脏合成并释放入血浆的分泌蛋白,它对于不同组织和器官的作用是否完全相同,以及S100A16的表达水平是否可以调节它的血浆浓度,这些都是可以进一步研究的方向。
总之,根据以上结果结合本课题组之前的研究说明,S100A16 可促进胰岛素抵抗,而胎球蛋白A为这个作用实现的途径之一。

