肿瘤坏死因子-α促进乳腺癌转移的分子机制研究
徐瑞 邱彤璐 梅杰, 沈书凝 朱一超,
乳腺癌是世界范围内女性最常见的恶性肿瘤之一,并且发病率逐年提高,已严重威胁到女性生命健康[1]。美国癌症协会预测,2019年美国将有大约270 000 例新发乳腺癌病例,超过40 000 例死亡病例[2]。到目前为止,乳腺癌发生、发展及转移的分子机制尚不完全明确。肿瘤转移作为乳腺癌致死的重要原因,进一步探究其发生的分子机制及相关因素对乳腺癌治疗及患者预后评价均有重要作用。
大量研究表明,慢性炎症与肿瘤之间存在明显关系[3-5]。慢性炎症的存在会增加该处发生肿瘤的风险,肿瘤微环境中也被发现有大量炎症因子浸润。肿瘤细胞、间质细胞、趋化因子及细胞因子是构成肿瘤微环境的主要因素,其中间质细胞包括炎症因子,是肿瘤微环境间质细胞中重要的组成成分[6]。肿瘤微环境中的炎症是以炎症因子为主导的非可控性炎症,对肿瘤的发生、发展有重要的作用[7]。
炎症反应在肿瘤发展的不同阶段,包括发生、发展、转移都起着重要作用。有研究表明,减少炎症细胞和炎症介质可以抑制肿瘤的生长与转移[8]。这不仅为抗癌药物的研发提供了靶点,也为探索肿瘤的发生发展机制提供了思路。肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)是在肿瘤中与炎症相关的化学介质之一,参与了肿瘤的发生和发展[9]。已有研究报道,TNF-α与乳腺癌转移密切相关[10],但其具体的分子机制仍不完全明朗。本研究旨在探讨TNF-α促进乳腺癌转移的分子机制,提供控制乳腺癌转移的新思路、新靶点。
资料与方法
一、一般资料
1.研究对象:本研究为前瞻性研究。本研究收集2018年1月至2019年4月就诊于南京医科大学第一附属医院和南京医科大学附属无锡人民医院乳腺外科,经病理学确诊为浸润性乳腺癌的患者血液标本共53 例。收集血液于EDTA 抗凝管内,立即在低温离心机离心后,将上层血浆收集到无菌离心管后保存于-20℃冰箱。本研究南京医科大学伦理委员会审查并批准准予实施。入组患者均签署书面知情同意书。纳入标准:(1)经空芯针穿刺活组织或者术后病理检查确诊为乳腺癌;(2)年龄20~70岁;(3)就诊前均未接受任何辅助性治疗。排除标准:(1)非原发性乳腺癌;(2)合并其他器官原发性恶性肿瘤;(3)妊娠状态或处于哺乳期。
2.主要材料与试剂:TNF-αELISA试剂盒(CHE0019,北京四正柏生物科技公司),小G蛋白检测试剂盒(美国Cytoskeleton公司),MDA-MB-231细胞(中国科学院上海生命科学研究院细胞库),重组人TNF-α(C600021,生工生物工程股份有限公司),二磷酸腺苷核糖基化因子6(ADP- ribosylation factor,Arf6)-T27N 质粒(Dr.Julie G.Donaldson 惠赠,Laboratory of Cell Biology,美国国立卫生研究院),LipofectamineTM2000 试剂盒(美国Invitrogen公司)。
二、方法
1.实验分组:(1)评估临床样本中TNF-α含量高低的子实验中,根据TNF-α在乳腺癌患者血浆中的表达分组,53 例乳腺癌患者分为高表达组(27 例)与低表达组(26 例);(2)评估TNF-α是否对乳腺癌MDA-MB-231细胞迁移有影响的子实验中,分为对照组和TNF-α诱导组;(3)评估Arf6是否为TNF-α诱导乳腺癌MDA-MB-231细胞迁移靶点的子实验中,分为空载对照组(转染空载体)、Arf6- T27N组(转染Arf6-T27N)、空载转染+TNF-α组(转染空载体后加500 ng/ml TNF-α)、Arf6- T27N+TNF-α组(转染Arf6-T27N 后加500 ng/ ml TNF-α)。
2.酶联免疫检测法(ELISA):取刚入院未经药物治疗的乳腺癌患者清晨空腹静脉血,EDTA 抗凝管取血,血浆保存于-20℃冰箱。应用ELISA 酶联免疫检测法,严格按照试剂盒使用说明书步骤操作,在450 nm处测定吸光度,每个样本重复检测3次。
3.细胞培养与转染:细胞置于10 ﹪胎牛血清(FBS)和双抗(青霉素100 U/ml,链霉素100 µg/ ml)的DMEM 培养基中,5﹪ CO2、37℃培养箱中培养;0.25﹪胰蛋白酶消化细胞,传代培养。当细胞融合度达到80﹪时,用胰蛋白酶消化并接种至96孔板中。按不同分组进行诱导或转染,在37℃及5﹪CO2条件下继续培养,细胞融合度至少达到80﹪时进行划痕操作。
4.细胞划痕实验:为了分析经过不同处理后乳腺癌细胞的迁移能力,将MDA-MB-231细胞接种到96孔中。对53个临床病例TNF-α的含量分析后选取500 ng/ml 进行细胞系实验,培养24 h 后,进行划痕操作,并用PBS 冲洗以去除细胞碎片。迁移4 h后,在室温下将细胞用0.2﹪结晶紫染色20 min。图像在迁移后0和4 h 使用尼康正置明视场光学显微镜采集。利用Image J软件分析0 h和4 h 之间的迁移面积评价细胞迁移能力。
5.小G蛋白活化实验(GLISA):利用GLISA实验对Arf6 等小G蛋白的活化程度进行测定。乳腺癌细胞接种到6孔板中,用500 ng/ml的TNF-α诱导后检测常见小G蛋白活性,用不同浓度TNF-α诱导后推测TNF-α对Arf6的最适宜作用浓度。严格按照试剂盒使用说明书步骤操作,每个样本重复检测3次。
三、统计学分析方法
采用SPSS 23.0软件进行统计学分析。TNF-α表达量、划痕实验相对愈合面积、小G蛋白相对活化程度等以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用LSD检验。TNF-α表达高低与临床病理参数的关系采用χ2检验或Fisher 确切概率法分析。以P< 0.05为差异具有统计学意义。
结 果
一、血浆TNF-α表达与乳腺癌淋巴结的关系
乳腺癌患者血浆TNF-α的表达与患者年龄、肿瘤大小、远端转移、临床分期、ER表达状态、PR表达状态、HER2表达状态差异无统计学意义,但与淋巴结转移状态差异有统计学意义(χ2= 9.294,P= 0.002)。与无淋巴结转移患者比较,已发生淋巴结转移的患者中乳腺癌患者血浆TNF-α的表达量升高。(表1~2)
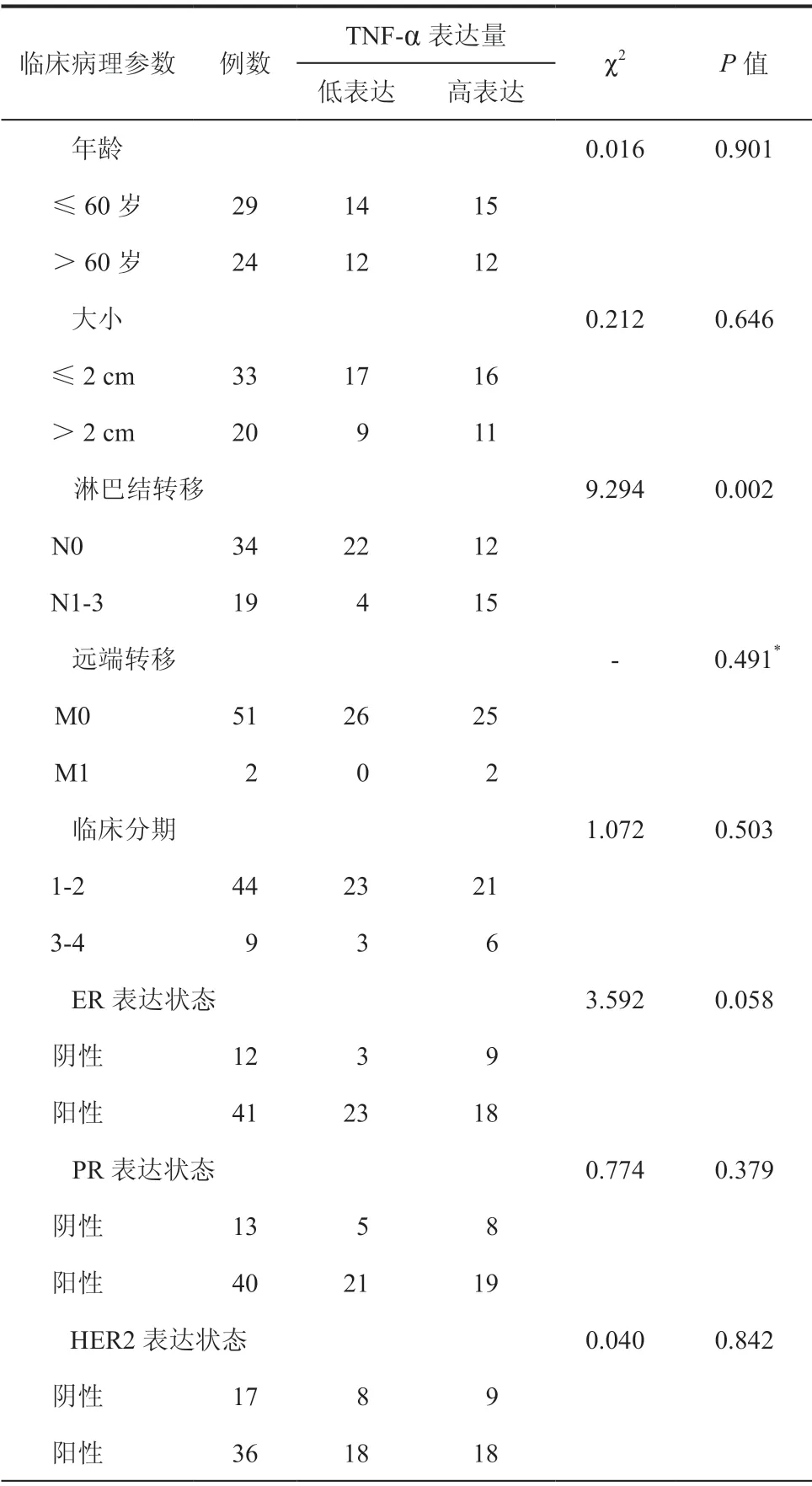
表1 血浆TNF-α表达量与乳腺癌病理参数间的关系

表2 不同淋巴结转移状态的乳腺癌患者血浆TNF-α表达量
二、TNF-α对乳腺癌细胞迁移的影响
乳腺癌细胞划痕后迁移4 h,与对照组比较,TNF-α诱导组的相对愈合面积(1.00±0.04 比2.34±0.25)增大,差异具有统计学意义(t= 9.295,P< 0.001,图1)。
三、TNF-α对小G蛋白的诱导激活作用
与对照组比较,诱导组小G蛋白Arf6 相对活化程度升高,差异具有统计学意义(P< 0.001),而其它小G蛋白的活化程度在TNF-α诱导前后比较差异无统计学意义(P> 0.05,表3)。
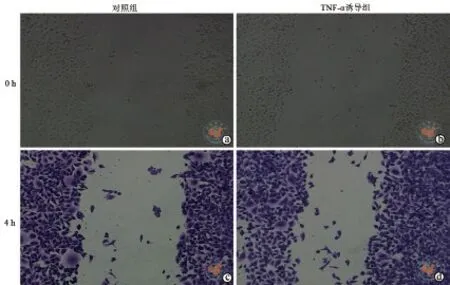
图1 正置明视场显微镜下观察两组乳腺癌细胞迁移能力(×10)
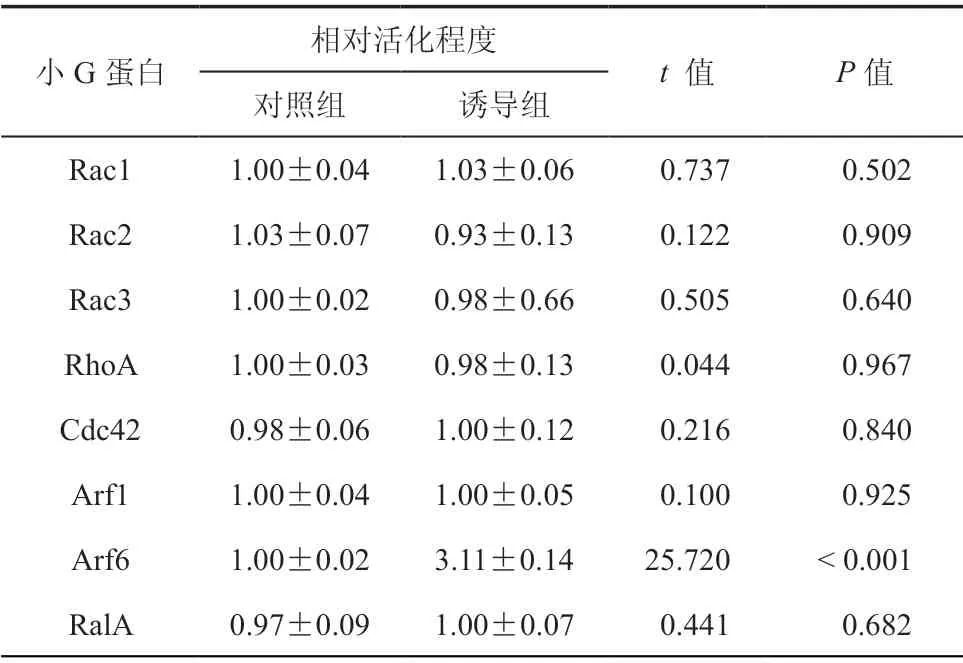
表3 TNF-α对常见小G蛋白活化程度的影响(x± s,n = 3)
四、干扰Arf6 活性对TNF-α介导乳腺癌细胞迁移的影响
与对照组比较,500、1 000 ng/ml TNF-αArf6 相对活化程度升高,差异具有统计学意义(P< 0.001,表4)。用负显性Arf6(Arf6-T27N)和其对应空载体转染乳腺癌细胞系MDA-MB-231。划痕实验结果显示,与空载对照组比较,Arf6-T27N组的乳腺癌细胞Arf6 相对活化程度、相对愈合面积之间比较差异无统计学意义(P> 0.05);与空载转染+TNF-α组比较,Arf6-T27N+TNF-α组在Arf6 相对活化程度、相对愈合面积均降低,差异具有统计学意义(P< 0.001,表5,图2)。
表4 不同TNF-α浓度对乳腺癌细胞中Arf6 活化程度的影响(± s,n = 3)

表4 不同TNF-α浓度对乳腺癌细胞中Arf6 活化程度的影响(± s,n = 3)
注:与对照组比较,aP < 0.001;与100 ng/ml 诱导组比较,bP < 0.001。n为实验重复次数
分组 Arf6 相对活化程度对照组 1.00±0.02 100 ng/ml 诱导组 1.13±0.11 500 ng/ml 诱导组 3.17±0.23ab 1000 ng/ml 诱导组 3.12±0.10a F 值 230.276 P 值 < 0.001
表5 不同分组乳腺癌细胞的Arf6 相对活化程度及迁移能力(± s,n = 3)
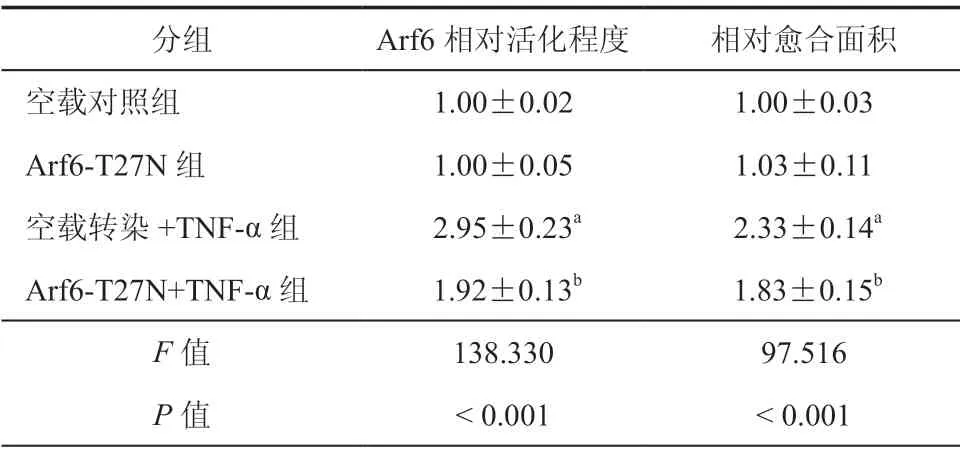
表5 不同分组乳腺癌细胞的Arf6 相对活化程度及迁移能力(± s,n = 3)
注:与空载对照组比较,aP < 0.001;与空载转染+TNF-α组比较,bP < 0.001。n为实验重复次数
分组 Arf6 相对活化程度 相对愈合面积空载对照组 1.00±0.02 1.00±0.03 Arf6-T27N组 1.00±0.05 1.03±0.11空载转染+TNF-α组 2.95±0.23a 2.33±0.14a Arf6-T27N+TNF-α组 1.92±0.13b 1.83±0.15b F 值 138.330 97.516 P 值 < 0.001 < 0.001
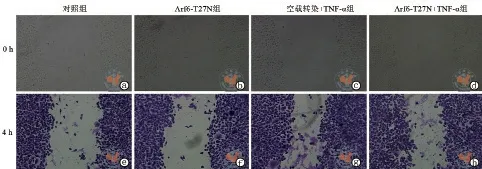
图2 正置明视场显微镜下观察不同分组乳腺癌细胞的迁移能力(×10)
讨 论
小G蛋白是一类分子量只有20~30 kD,具有GTP 酶活性的GTP 结合蛋白。已有大量研究证实小G蛋白在多种肿瘤的转移中起到重要的作用[11-13]。据此推测,小G蛋白可能是TNF-α诱导乳腺癌转移通路中的重要作用靶点。研究表明已知炎症在肿瘤发生、发展中起着重要作用,而TNF-α已被证明是联系这两种过程的重要纽带之一[14]。这种联系的内在机制与TNF-α的具体作用却是因肿瘤而异的。目前已有许多研究证明TNF-α在不同肿瘤模型中与不同的细胞因子在表达量上有相关性。例如在前列腺癌与肾癌中TNF-α含量与IL-6、IL-8 等炎症因子表达量呈正相关[15]。在胰腺癌中患者血浆TNF-α含量与肿瘤转移呈正相关[16]。证实了TNF-α在肿瘤转移中的作用。在某些肿瘤中,患者血浆TNF-α含量可以作为诊断依据,而在另一些肿瘤中TNF-α含量又能够预测分期,并对预后有预测价值[14]。本研究发现,乳腺癌患者血浆TNF-α含量与淋巴结转移呈正相关,即血浆TNF-α高表达的乳腺癌患者具有更高的淋巴结转移风险。而细胞实验也证明,TNF-α可以增强乳腺癌细胞迁移能力。
TNF-α可促进多种炎性细胞因子和趋化因子,从而影响肿瘤血管的形成和发展,促进肿瘤的侵袭和转移[17]。如在卵巢癌中内源性TNF-α与肿瘤细胞中趋化因子受体CXCR4及其配体CXCL12的表达增加有关,从而增加了肿瘤的转移;在胶质瘤细胞培养中,外源性TNF-α也增加了趋化因子,内源性TNF-α,以及血管内皮生长因子的表达量,从而促进肿瘤的发展[18]。在某些情况下TNF-α通过激活转录因子和相关基因激活相关细胞信号通路,影响肿瘤细胞的活性,促进肿瘤细胞的增殖[19]。TNF-α还会直接导致肿瘤细胞或基质细胞基因损伤,可能具有抗凋亡或有丝分裂活性[18],也可能介导肿瘤细胞与基质细胞间的相互作用,诱导成纤维细胞生成基质金属蛋白酶,改变免疫细胞的功能从而影响肿瘤的发生、发展[20]。
Arf6是一类鸟嘌呤核苷结合蛋白。其中的Arf6是小GTP蛋白核糖基化因子家族重要成员之一[21]。Arf6 主要参与调节质膜转运和细胞内肌动蛋白组装,在调节细胞胞质分裂、细胞黏附、肿瘤侵袭转移等生物学过程中也具有生理功能[22]。最近许多研究证实,Arf6蛋白的高表达和活化可能与乳腺癌、胰腺癌、肺癌等多种肿瘤的侵袭和转移密切相关[23]。EGFR-Arf6 通路的激活在肿瘤恶性进展过程中起着重要的作用。研究发现,Arf6及其效应物(即AMAP1)的过表达参与了EGFR -GEP100- Arf6- AMAP1 通路的形成和激活,此通路与许多癌症的形成过程密切相关,如乳腺癌、头颈部鳞状细胞癌等[24-25]。就转移性肿瘤而言,重组肌动蛋白细胞骨架是肿瘤细胞侵袭行为的关键事件。而与EGFR信号相关的Arf6 激活了SCAR/ WAVE,并将Rac1信号传递到Arp 2/3 复合物,进而导致肌动蛋白细胞骨架重塑和边缘延伸,并黏附于细胞外基质,从而促进乳腺肿瘤细胞的迁移和侵袭[26]。本研究发现,加入TNF-α诱导后,Arf6 活性升高,而该升高活性可在转染Arf6-T27N后被显著抑制。由此说明,Arf6是TNF-α介导的乳腺癌细胞迁移通路中的重要下游分子。下调Arf6 活性,可以显著抑制TNF-α介导的乳腺癌细胞迁移,提示TNF-α/Arf6 通路在乳腺癌转移机制中有着重要的意义。
尽管有许多研究证实了TNF-α与乳腺癌转移之间的关系,但其具体机制还并不十分明确。因此选取乳腺癌为对象,探讨乳腺癌患者血浆中炎症因子TNF-α含量与乳腺癌转移以及其他一些临床指标之间的相互关系,以及TNF-α通过激活Arf6 通路促进乳腺癌转移有关机制的具体研究。总之,本研究阐明了TNF-α/Arf6 通路在乳腺癌转移中的重要作用,为乳腺癌转移标志物开发、靶向治疗提供了新思路和新靶点。

