二氯乙酸对人肾癌细胞株A498侵袭及迁移的抑制作用研究
肾癌是常见的恶性肿瘤,常起源于肾实质泌尿小管上皮系统,多发于50~70岁人群。据统计,我国肾癌患者在成年恶性肿瘤病患中的构成比约为2﹪~3﹪,且上升态势明显,尤其是在超过40岁的中年男性中肾癌的发病率呈显著增长,也是威胁我国居民健康与生命的重要疾病之一[1]。目前肾癌常用的疗法包括手术、放化疗和中医技术等,虽对控制病情有积极作用但综合疗效不甚理想,且远期预后仍较差,而积极探讨新的治疗技术和靶点也是当前关于肾癌治疗研究的热点[2-3]。二氯乙酸(DCA)属于一种小分子无机物,可对线粒体发挥作用使其去极化,且在多项实验中均表现出了良好的诱导恶性肿瘤细胞凋亡、抑制其生长和增殖的作用[4-6]。尤其是在宫颈癌、卵巢癌中,且其作用机制有调控抑癌基因信号通路蛋白的表达及生物学效应、调控有氧糖酵解等;也有研究证实二氯乙酸可抑制膀胱癌细胞株T24 克隆形成,抑制其侵袭和迁移,且发现是通过控制上皮细胞-间充质转化实现此作用的[7-8]。据此推测二氯乙酸能够影响人肾癌细胞株的侵袭和迁移能力,但该药物是否具有此作用及其可能的机制仍需进一步探讨。鉴于此,本研究特设计体外细胞实验探讨上述问题,以期为肾癌治疗的研究提供新方向。
材料与方法
一、细胞、试剂及仪器
人肾癌细胞株A498(上海慧颖生物科技有限公司);RPMI 1640 培养基(美国Gibco公司);DCA(美国Sigma公司,纯 度≥96﹪);Giemsa染液(珠海贝索生物技术有限公司);Trizol 试剂盒(美国Invitrogen公司);蛋白提取试剂盒(美国Invitrogen公司);上下游引物(由深圳晶美生物科技有限公司设计合成);鼠抗人c-Jun 氨基末端激酶(JNK)、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、p-JNK 单克隆抗体,山羊抗兔JNK、E-cadherin、N-cadherin、p-JNK 多 克 隆 抗 体(采 用辣根过氧化物酶标记)(美国Promega公司,一抗批号:002081506A、002092601B、002101203A、002110507C;二抗批号:002010303A、002060705B、002071112A、002050314C)。
INCO2/108 型CO2培养箱(德国Memmert公司);SP21-318C 型酶标仪(北京中西远大科技有限公司);Millipore 型Transwell 小室(上海夏夷实业有限公司);DSX500 型光学显微镜(日本Olympus公司);IX71 型倒置相差显微镜(日本Olympus公司);T100 型聚光聚合酶链反应(PCR)仪(美国Bio-Rad公司);US61M 型基因电泳仪(美国MEDA公司);DYCZ-24F 型蛋白电泳仪(北京六一仪器厂)。
二、方法
1.细胞培养、鉴定和分组干预:取人肾癌细胞株A498 用含有10﹪浓度的胎牛血清和1﹪浓度的青链霉素溶液的RPMI 1640 培养基培养,注意需放置于CO2培养箱中,条件设置为5﹪浓度CO2、37℃。待细胞生长至对数期,分为4组,每组设置5个复孔,每孔细胞数5×105个。包括阴性对照组、DCA 低剂量、中剂量、高剂量组。预实验发现DCA对人肾癌细胞株A498的半数抑制浓度(IC50)为38.5 mmol/L,且DCA 临床等效剂量为5 mmol/L,故设置3个给药浓度,低剂量即为临床等效剂量,中剂量即为2×临床等效剂量(即10 mmol/L),高剂量即为4×临床等效剂量(即20 mmol/L),阴性对照组予以等容积无菌生理盐水,均培养48 h。

表1 引物序列信息
2.侵袭能力检测:采用Transwell 小室实验检测侵袭能力。将各组细胞按照1×105/ml 密度、200 μl接种于Transwell 小室上室,铺有Matrigel 基质胶。下室中加入RPMI 1640 培养基,其中含有600 μl 20﹪浓度的胎牛血清。按照上述条件于CO2培养箱中继续培养24 h,以棉签将基质胶、上室未穿膜细胞轻轻擦去。采用甲醇固定,10 min 后采用0.1 ﹪浓度的Giemsa 染液染色,室温下等待30 min。在光学显微镜下拍照观察,放大100 倍,统计平均每个视野中侵袭细胞数。
3.迁移能力检测:采用细胞划痕实验检测迁移能力。将各组细胞接种于6孔板中,待细胞生长面积至90﹪后以10 μl 加样枪头进行划痕,每孔划痕1次。于48 h 后在倒置相差显微镜下观察,细胞迁移率=(1-愈合后间距/起始间距)×100﹪。
4.侵袭、迁移相关基因表达检测:包括JNK、E-cadherin、N-cadherin mRNA表达,采用实时荧光定量聚合酶链反应(RT-qPCR)检测。Trizol 法提取总核糖核酸并予以反转录处理,配置反应体系,总反应体系为25 μl,各基因引物序列见表1。实施扩充反应的条件为:95℃(10 min),40个循环:95℃(10 s)→60℃(20 s)→72℃(20 s),最后60℃(5 min)。分析并计算目的基因的相对表达量(2-△△Ct)。
5.侵袭、迁移相关蛋白表达检测:包括JNK、E-cadherin、N-cadherin蛋白表达及p-JNK 水平,采用Western blot 检测。提取总蛋白、定量、上样、电泳、封闭、孵育(室温,1 h)。滴加一抗,孵育(4℃,过夜)。滴加二抗,孵育(37℃、2 h)。TBST洗涤2次,暗室曝光、显影、定影、拍照后扫描。同一张膜上的其他蛋白在化学发光检测后进行Strippingbuffer处理,经封闭液封闭后进行后续抗体孵育等Western blot 操作。目的蛋白的相对表达量为目的蛋白与β-actin(内参)的比值。
上述实验均重复3次,取各项实验结果的平均值作为本研究结果。
三、统计学分析方法
采用SPSS 25.0软件进行统计学分析,侵袭活性、迁移率、JNK、E-cadherin、N-cadherin mRNA及蛋白表达、p-JNK 水平均符合正态分布和方差齐性检验,以±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P< 0.05为差异具有统计学意义。
结 果
一、不同剂量DCA组与阴性对照组细胞侵袭活性对比
DCA 高剂量组侵袭活性高于DCA 中剂量组、DCA 低剂量组、阴性对照组,差异具有统计学意义(P< 0.001)。(图1,表2)
二、不同剂量DCA组与阴性对照组细胞迁移能力对比
DCA 高剂量组迁移率低于DCA 中、低剂量组及阴性对照组,各组比较差异具有统计学意义(P< 0.001)。(图2,表2)
表2 不同组干预后细胞侵袭活性及迁移率比较(± s,n = 3)
注:与阴性对照组比较,aP < 0.05;与低剂量组比较,bP < 0.05;与DCA 中剂量组比较,cP < 0.05;n为实验重复次数
分组 侵袭活性(个/视野)迁移率(﹪)阴性对照组 530.26±81.22 53.59±6.71 DCA 低剂量组 372.74±50.06a 36.26±5.01a DCA 中剂量组 167.89±47.12ab 23.95±4.20ab DCA 高剂量组 75.33±10.09abc 10.05±2.31abc F 值 73.243 73.510 P 值 < 0.001 < 0.001
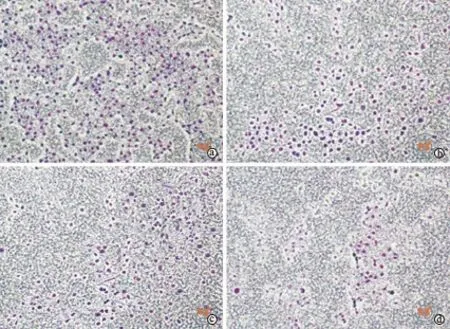
图1 倒置相差显微镜下观察不同组细胞侵袭活性(Giemsa 染色,×100)

图2 倒置相差显微镜下观察不同组细胞迁移能力(×100)
三、不同剂量DCA组与阴性对照组JNK、E-cadherin、N-cadherin mRNA表达对比
各组JNK mRNA 与蛋白表达差异均无统计学意义(P> 0.05);DCA 高剂量组E-cadherin mRNA相对表达量高于DCA 中、低剂量组及阴性对照组,差异具有统计学意义(P< 0.001);DCA 高剂量组N-cadherin mRNA 相对表达量低于DCA 中、低剂量组及阴性对照组,差异具有统计学意义(P< 0.001)。(表3)
四、不同剂量DCA组与阴性对照组JNK、E-cadherin、N-cadherin蛋白表达及p-JNK 水平对比
DCA 高剂量组E-cadherin蛋白相对表达量高于DCA 中、低剂量组及阴性对照组,差异具有统计学意义(P< 0.001);DCA 高剂量组N-cadherin蛋白相对表达量、p-JNK 水平低于DCA 中、低剂量组及阴性对照组,差异具有统计学意义(P< 0.001)。(图3,表4)
表3 不同组JNK、E-cadherin、N-cadherin mRNA表达对比(± s,n = 3)
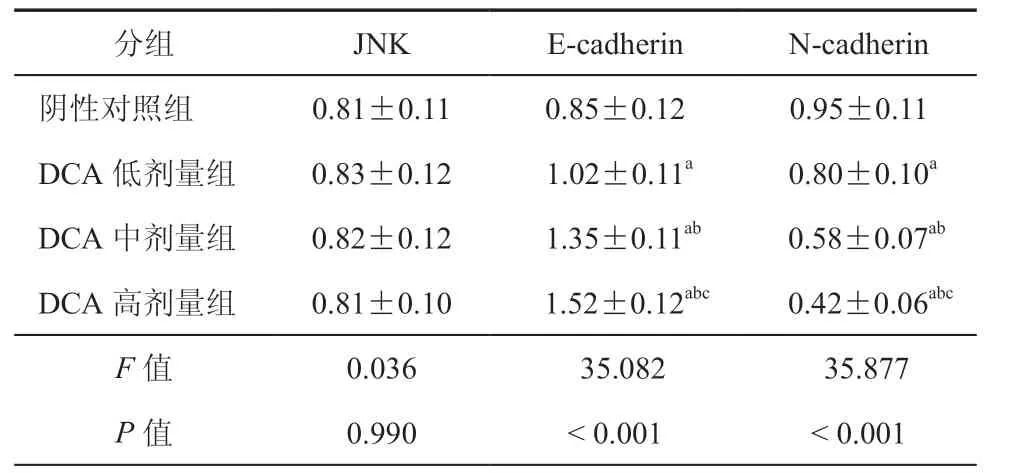
表3 不同组JNK、E-cadherin、N-cadherin mRNA表达对比(± s,n = 3)
注:与阴性对照组比较,aP < 0.05;与低剂量组比较,bP < 0.05;与DCA 中剂量组比较,cP < 0.05;n为实验重复次数
分组 JNK E-cadherin N-cadherin阴性对照组 0.81±0.11 0.85±0.12 0.95±0.11 DCA 低剂量组 0.83±0.12 1.02±0.11a 0.80±0.10a DCA 中剂量组 0.82±0.12 1.35±0.11ab 0.58±0.07ab DCA 高剂量组 0.81±0.10 1.52±0.12abc 0.42±0.06abc F 值 0.036 35.082 35.877 P 值 0.990 < 0.001 < 0.001

图3 Western blot 检测不同组JNK、E-cadherin、N-cadherin蛋白表达及p-JNK 水平
讨 论
目前关于肾癌的发病机制研究尚少,人们对其认识也尚浅。关于该病病因报道,大致可分为遗传因素、精神因素、化学致癌物质接触和不良生活习惯等几类,但仍需进一步研究[9-10]。由于目前人们对该病的病因病机认识少,且肾癌细胞侵袭和迁移的能力强,临床治疗难度大,因而目前尚缺乏行之有效的抗肾癌治疗方案。目前临床常用的化疗药物在体外细胞实验和临床试验中均证实该药物有一定的治疗效果,但肾癌患者的预后仍较差,且远期生存率低,仍需探讨高效的用药方案及其可能的作用机制,为临床抗肾癌用药的研究奠定基础[11-12]。
本研究侵袭活性、迁移率的对比结果中显示DCA 高剂量组抑制人肾癌细胞株A498 侵袭、迁移的作用最佳,DCA 中剂量组次之,DCA 低剂量组稍差,表明DCA 也有良好的抗人肾癌细胞株A498侵袭、迁移作用,且在一定范围内呈剂量依赖性。DCA 属于一种无机物,分子量小,穿透性强,可快速穿透细胞膜对线粒体发挥作用使其去极化,进而抑制恶性肿瘤细胞生长,还可通过增强葡萄糖的有氧代谢控制糖酵解,限制恶性肿瘤细胞对能量的摄取和利用[13]。有研究指出,DCA在大肠癌细胞中的作用体外实验中显示该药物可恢复线粒体膜电位,并且还可增加电压门控通道蛋白的表达,增强其生物学活性发挥抗恶性肿瘤细胞作用[14]。既往一项国外有报道显示,DCA 可能存在多种作用途径削弱恶性肿瘤细胞的侵袭活性和转移能力,与本研究部分结果也相符[15]。因此DCA 可抑制人肾癌细胞株A498的侵袭和迁移,在抗肾癌治疗中显示良好的研究价值和发展前景。
此外,在本研究关于DCA 抗人肾癌细胞株A498 侵袭和迁移的可能作用机制探讨结果中显示,DCA 3剂量组N-cadherin mRNA与蛋白表达、p-JNK均下降,而E-cadherin mRNA 与蛋白表达均升高,且DCA 高剂量组效用最佳,DCA 中剂量组次之,DCA 低剂量组效用稍不理想,可知DCA 可抑制p-JNK,下调人肾癌细胞株A498 N-cadherin mRNA与蛋白表达,上调E-cadherin mRNA 与蛋白表达。JNK 又被称为应激活化蛋白激酶,属于哺乳类动物细胞中丝裂原活化蛋白激酶信号通路的一类,也是细胞上皮间充质转化的重要调控因子。在正常情况下JNK 有2个磷酸化位点,p-JNK 水平较低,可抑制细胞上皮间充质转化[16]。但是在恶性肿瘤细胞中,p-JNK 水平可在受到刺激后显著升高,进而对细胞转化、迁移和侵袭等多种生物学行为发生作用。不少研究指出,p-JNK 水平升高可促使上皮间充质转化,增强癌细胞的侵袭和迁移能力,且在人肾癌细胞株中其水平也异常升高[17-19]。而在上皮间充质转化发生过程中,N-cadherin mRNA 与蛋白表达水平升高,E-cadherin mRNA 与蛋白表达下降。El Arem A 等[20]的报道中显示,上皮细胞-间充质转化是上皮源性肿瘤细胞发生和病情发展的重要基础,而肾癌是临床常见的上皮源性恶性肿瘤细胞类型,可出现细胞间连接减少表现,进而可导致细胞侵袭、迁移活性增强,对周围脏器组织和解剖结构的损伤风险增加,容易导致预后不良。上皮细胞-间充质转化病理改变过程中,E-cadherin mRNA 与蛋白表达减少,而N-cadherin、Vimentin mRNA 与蛋白表达升高。在本研究中DCA 可抑制人肾癌细胞株A498 p-JNK 水平,下调N-cadherin mRNA 与蛋白表达,上调E-cadherin mRNA 与蛋白表达,且剂量越高成效越理想,推测该药物可通过上述途径发挥抑制人肾癌细胞株侵袭和迁移作用。
表4 不同组JNK、E-cadherin、N-cadherin蛋白表达及p-JNK 水平对比(± s,n = 3)
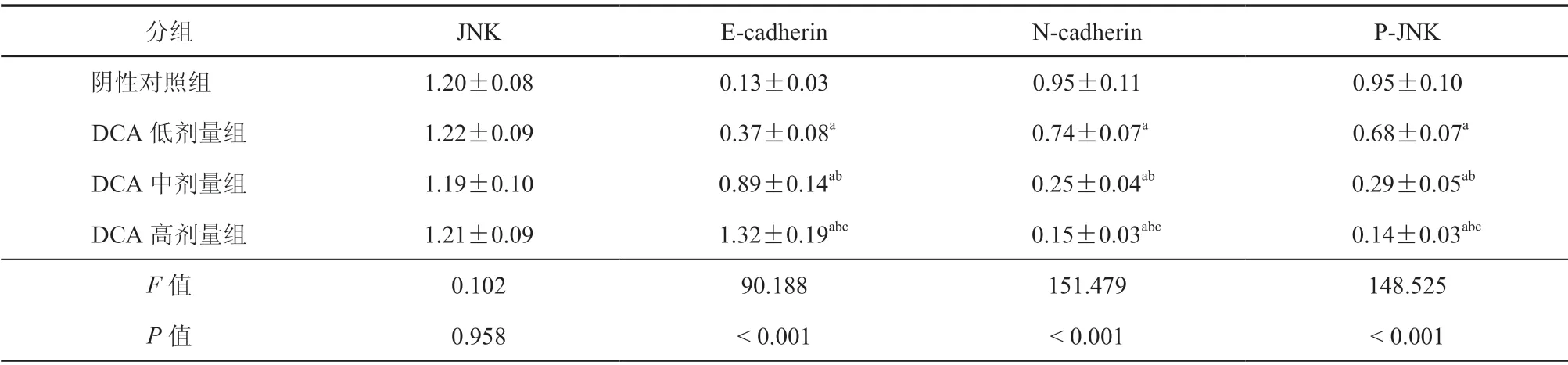
表4 不同组JNK、E-cadherin、N-cadherin蛋白表达及p-JNK 水平对比(± s,n = 3)
注:与阴性对照组比较,aP < 0.05;与低剂量组比较,bP < 0.05;与DCA 中剂量组比较,cP < 0.05;n为实验重复次数
分组 JNK E-cadherin N-cadherin P-JNK阴性对照组 1.20±0.08 0.13±0.03 0.95±0.11 0.95±0.10 DCA 低剂量组 1.22±0.09 0.37±0.08a 0.74±0.07a 0.68±0.07a DCA 中剂量组 1.19±0.10 0.89±0.14ab 0.25±0.04ab 0.29±0.05ab DCA 高剂量组 1.21±0.09 1.32±0.19abc 0.15±0.03abc 0.14±0.03abc F 值 0.102 90.188 151.479 148.525 P 值 0.958 < 0.001 < 0.001 < 0.001
综上,在人肾癌细胞株A498 中予以DCA 干预均可抑制其侵袭和迁移,且在一定范围内DCA的剂量越高作用越佳,该药物抗人肾癌细胞株A498侵袭和迁移的作用可能与抑制p-JNK 水平,下调N-cadherin、mRNA 与蛋白表达,上调E-cadherin mRNA 与蛋白表达有关。本研究显示出DCA 有良好的抗肾癌潜力,但仍存在明显不足:(1)DCA对人肾癌细胞株A498 侵袭、迁移的调控作用是否存在其它机制仍不可知;(2)如何利用DCA 治疗肾癌患者仍需要进一步探讨。后续应将上述问题作为研究的重点。

