阿加曲班对急性脑梗死大鼠脑组织细胞凋亡的影响
刘猛 刘娟 朱月敏 袁亚松 韩建鹏 王姣姣 卢双动
急性脑梗死(acute ischemic stroke,AIS)又名急性缺血性脑卒中,发病速度快且病理进程迅速,是世界上发病率、致残率和死亡率较高的主要原因之一[1]。AIS 损伤可导致缺血区及周围半暗带脑组织细胞死亡及脑组织软化坏死,进一步加重病理进程,对人类健康构成严重威胁[2]。但该病的具体发病机制仍然尚不清楚。目前,有关脑组织细胞的凋亡机制在AIS 中的作用受到广泛关注。阿加曲班(Argatroban)是一种安全且高效的选择性凝血酶抑制剂和抗凝血剂,临床上用于治疗48 h 内AIS 患者,但其作用机制尚不明确[3]。本研究通过建立AIS 大鼠模型,观察阿加曲班对损伤大鼠神经功能的保护作用,并从脑组织细胞凋亡角度探讨可能的机制,为阿加曲班在AIS 疾病的临床应用上奠定实验基础。
材料与方法
一、材料
1.实验动物:体质量为250~300 g的成年雄性SD 大鼠购于上海斯莱克实验动物有限公司。饲养温度为20℃~23℃,光照/黑暗周期为12 h,相对湿度为50 ﹪。所有实验动物自由摄食摄水。饲养2 周后建立实验模型。
2.实验试剂:阿加曲班(美国Axxora公司);Rat Apoptosis regulator BAX Elisa kit(Cusabio)、Rat B-cell CLL/lymphoma 2(BCL2)ELISA kit(中国武汉华美生物工程有限公司);大鼠胱天蛋白酶3(Casp-3)ELISA Kit(美国R&D公司);caspase-3 Rabbit mAb、Bcl-2 Rabbit mAb、Bax Rabbit mAb 以及b-actin Rabbit mAb(美国CST公司);2,3,5-三苯基氯化四氮唑(triphenyltetrazolium chloride,TTC)染色试剂(美国Sigma公司);TUNEL细胞凋亡检测试剂盒(中国上海碧云天生物技术有限公司)。
二、方法
1.大鼠大脑中动脉缺血(middle cerebral artery occlusion,MCAO)模型的建立:手术前16 h 大鼠禁食禁饮。10 ﹪水合氯醛(0.35 g/kg)用于腹腔麻醉。将麻醉好的实验动物仰卧固定于操作台上,被毛暴露颈部,手术工具用75 ﹪的乙醇消毒待使用。手术刀沿着颈部正中处切开,暴露分离左侧颈总动脉、颈内动脉和颈外动脉。首先用动脉夹夹闭颈内动脉同时结扎颈总动脉近端和颈外动脉起始段,随后从颈总动脉远端的切口处插入鱼线。当鱼线插入深度为18 mm 时阻力增大,停止插入。
2.给药方式:将大鼠分为假手术组(Sham组,不插入MCAO 拴线);脑中动脉缺血模型组(MCAO组);阿加曲班处理组(Argatroban组)。每组设置3个时间窗(0、6、12 h)取样,每个时间窗组6 只实验动物,其中3 只用于ELISA 检测,另外3 只用于Western blot蛋白检测。在建模后0、6、12 h 分别给予阿加曲班药物处理。将0.45 mg的阿加曲班制成0.2 ml的溶液备用。实验动物清醒后立即给药。Argatroban组静脉注射阿加曲班溶液0.2 ml。Sham组和MCAO组静脉注射等体积的生理盐水。
3.TUNEL 法检测大鼠脑细胞凋亡情况:术后72 h,断头取脑处死实验大鼠。将取出的脑组织制备成厚度约为6 μm的切片,置于载玻片上,多聚甲醛固定10~20 min,PBS 洗涤2次,每次10 min;所有样品加入50 μl的TUNEL 检测液,室温孵育60 min,PBS 洗涤3次。最后用抗荧光淬灭封片液封片后置于荧光显微镜下观察。凋亡细胞呈现红色荧光。计算细胞凋亡指数(AI):AI(﹪)=阳性染色平均光密度(MOD)×表达面积率×100。
4.ELISA 法检测细胞凋亡相关因子:ELISA法用于测定AIS 大鼠脑组织细胞凋亡相关因子caspase-3、Bax和Bcl-2的表达。收集脑组织样本,加入预冷的蛋白裂解液匀浆后离心取上清,每孔加入标准品或待测样本100 μl,将反应板充分混匀后置于室温孵育2 h;洗涤液充分洗涤反应板4~6次,并用滤纸印干;每孔加入100 μl的第一抗体工作液,充分混匀后置于37℃中孵育120 min;洗板4~6次;每孔加入酶标抗体工作液100 μl,将反应板置于37℃处理0.5 h;洗板4~6次;每孔加入底物工作液100 μl,室温避光处理15 min;最后每孔加入100 μl 终止液终止反应。酶标仪450 nm处检测样本吸光值。
四、统计学分析方法
采用SPSS 19.0软件进行统计分析。脑组织细胞凋亡、caspase-3、Bcl-2及Bax蛋白的表达均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P< 0.05为差异具有统计学意义。
结 果
一、三组脑组织细胞凋亡指数情况
0、6、12 h Sham组的脑组织细胞凋亡数量随着时间推移不断增加,但表达量仍然较低(图1)。与MCAO组比较,Sham组与Argatroban组脑组织细胞凋亡指数在不同时间点均降低,差异具有统计学意义(P均 < 0.05,表1)。
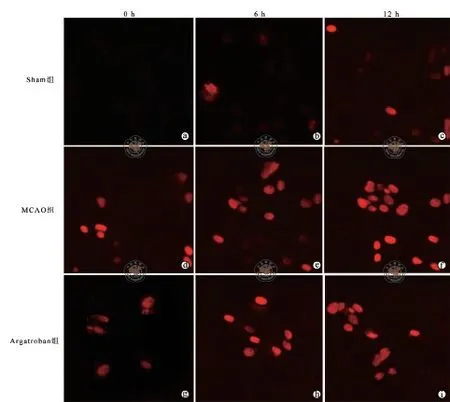
图1 荧光显微镜下观察不同时间点三组大鼠脑组织细胞凋亡情况(TUNEL 荧光染色,×400)
二、三组大鼠脑组织细胞caspase-3表达情况
ELISA 结果显示,0、6、12 h 三组大鼠脑组织细胞caspae-3表达比较差异具有统计学意义(P< 0.01)。与Sham组比较,MCAO组在不同时间点大鼠脑组织细胞caspase-3表达均升高且呈现出时间依赖性,差异具有统计学意义(P均 < 0.001);与MCAO组比较,Argatroban组大鼠脑组织细胞caspase-3的表达均降低(P均 < 0.01)。Western blot结果趋势与ELISA 结果一致。(表2,图2~3)
表1 不同时间点三组大鼠脑组织神经细胞凋亡指数(﹪,± s,n = 3)
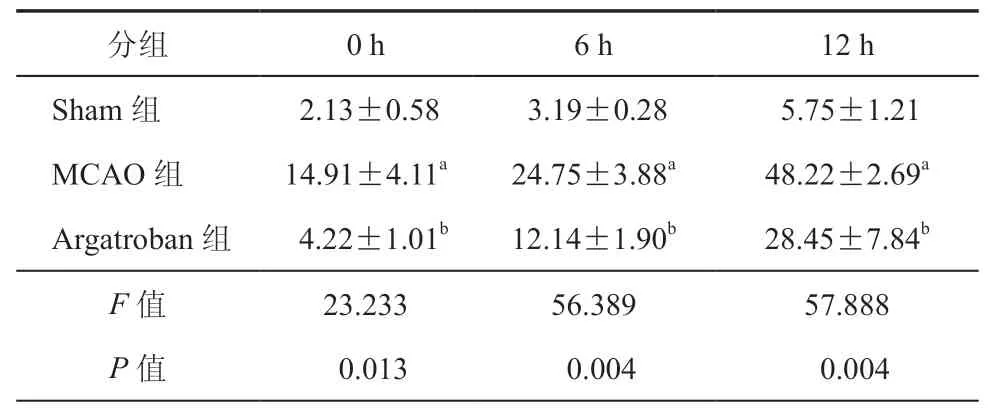
表1 不同时间点三组大鼠脑组织神经细胞凋亡指数(﹪,± s,n = 3)
注:与Sham组比较,aP < 0.01;与MCAO组比较,bP < 0.05;n为实验重复次数
分组 0 h 6 h 12 h Sham组 2.13±0.58 3.19±0.28 5.75±1.21 MCAO组 14.91±4.11a 24.75±3.88a 48.22±2.69a Argatroban组 4.22±1.01b 12.14±1.90b 28.45±7.84b F 值 23.233 56.389 57.888 P 值 0.013 0.004 0.004
表2 ELISA 检测不同时间点三组大鼠脑组织细胞caspae-3表达(ng/ml,± s,n = 3)
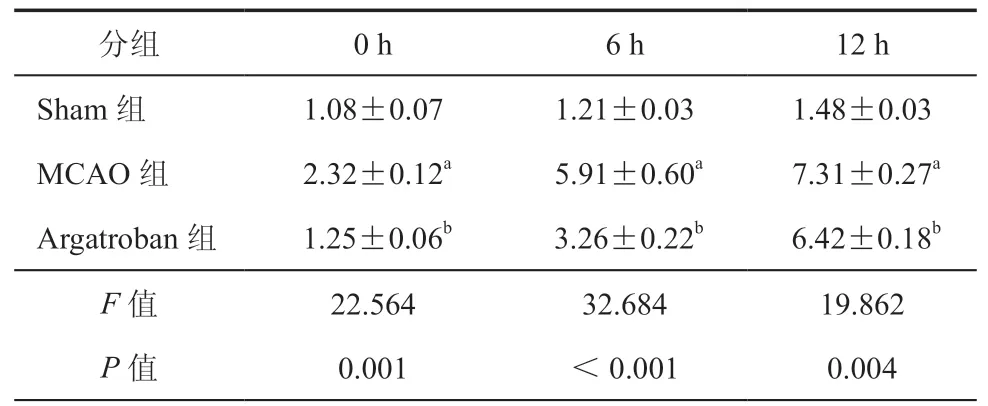
表2 ELISA 检测不同时间点三组大鼠脑组织细胞caspae-3表达(ng/ml,± s,n = 3)
注:与Sham组比较,aP < 0.001;与MCAO组比较,bP < 0.01;n为实验重复次数
分组 0 h 6 h 12 h Sham组 1.08±0.07 1.21±0.03 1.48±0.03 MCAO组 2.32±0.12a 5.91±0.60a 7.31±0.27a Argatroban组 1.25±0.06b 3.26±0.22b 6.42±0.18b F 值 22.564 32.684 19.862 P 值 0.001 <0.001 0.004
三、三组大鼠脑组织细胞Bax表达情况
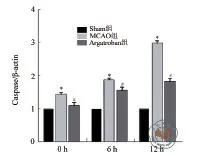
图2 Western blot 结果检测不同时间点三组大鼠脑组织细胞caspase-3蛋白表达定量分析
ELISA 结果显示,三组大鼠在不同时间点脑组织细胞中Bax表达比较差异有统计学意义(P均 < 0.01)。与Sham组比较,MCAO组不同时间点大鼠脑组织细胞Bax表达均升高(P均 < 0.001);与MCAO组比较,Argatroban组不同时间点大鼠脑组织细胞Bax表达均降低(P均 < 0.01)。Western blot结果趋势与ELISA 结果一致(表3,图3~4)。
表3 ELISA 检测不同时间点三组大鼠脑组织细胞Bax表达(ng/ml,± s,n = 3)
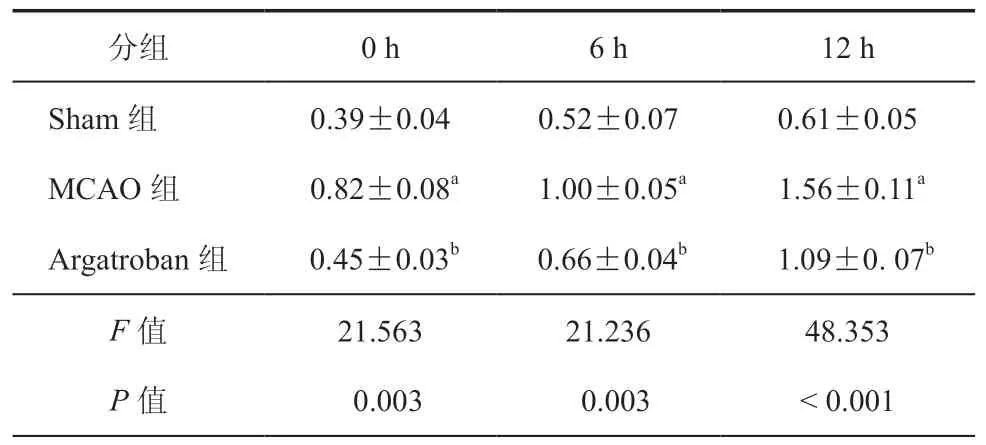
表3 ELISA 检测不同时间点三组大鼠脑组织细胞Bax表达(ng/ml,± s,n = 3)
注:与Sham组比较,aP < 0.001;与MCAO组比较,bP < 0.01;n为实验重复次数
分组 0 h 6 h 12 h Sham组 0.39±0.04 0.52±0.07 0.61±0.05 MCAO组 0.82±0.08a 1.00±0.05a 1.56±0.11a Argatroban组 0.45±0.03b 0.66±0.04b 1.09±0.07b F 值 21.563 21.236 48.353 P 值 0.003 0.003 < 0.001
四、三组大鼠脑组织细胞Bcl-2表达情况
Western blot 结果显示,与Sham组比较,MCAO组0 h 时大鼠脑组织细胞Bcl-2蛋白表达降低(P< 0.05),6 h 时表达升高(P< 0.001),12 h 时两组表达差异无统计学意义(P> 0.05)。与MCAO组比较,Argatroban组不同时间点的Bcl-2蛋白水平均升高,差异有统计学意义(P均 < 0.001,图3,5)。
ELISA 结果显示,与Sham组比较,MCAO组和Argatroban组0 h 时大鼠脑组织细胞Bcl-2表达差异无统计学意义(P均 > 0.05),MCAO组6 h时 大 鼠脑组织细 胞Bcl-2表达升高(P< 0.001)。与MCAO组比较,Argatroban组大鼠脑组织细胞Bcl-2表达在6 h和12 h 时均升高,差异有统计学意义(P均 < 0.001,表4)
表4 ELISA 检测不同时间点三组大鼠脑组织细胞Bcl-2表达(ng/ml,± s,n = 3)
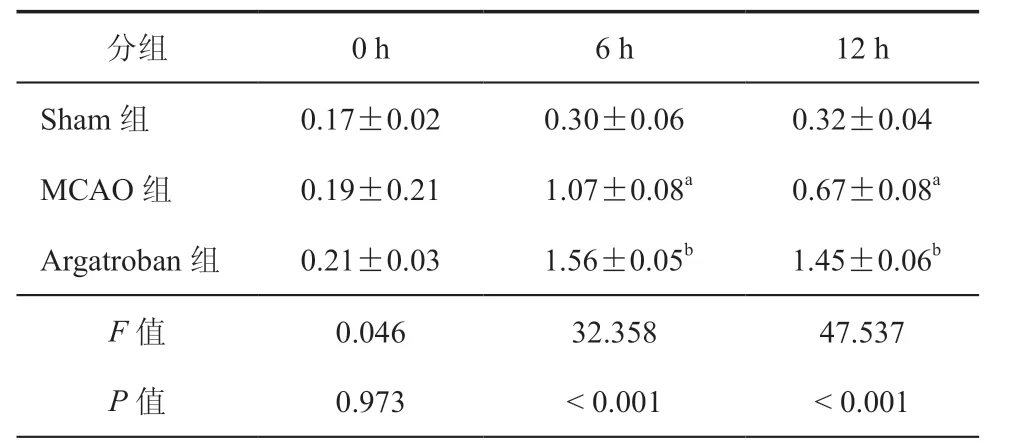
表4 ELISA 检测不同时间点三组大鼠脑组织细胞Bcl-2表达(ng/ml,± s,n = 3)
注:与Sham组比较,aP < 0.01;与MCAO组比较,bP < 0.01;n为实验重复次数
分组 0 h 6 h 12 h Sham组 0.17±0.02 0.30±0.06 0.32±0.04 MCAO组 0.19±0.21 1.07±0.08a 0.67±0.08a Argatroban组 0.21±0.03 1.56±0.05b 1.45±0.06b F 值 0.046 32.358 47.537 P 值 0.973 < 0.001 < 0.001

图3 Western blot 检测不同时间点三组大鼠脑组织细胞caspase-3、Bcl2和Bax蛋白表达
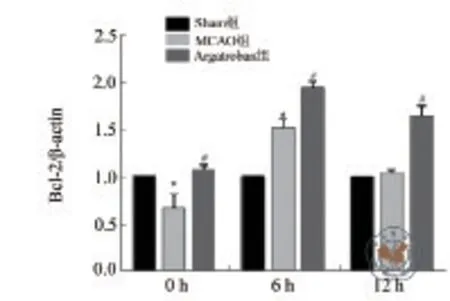
图4 Western blot 检测不同时间点三组大鼠脑组织细胞Bax蛋白表达定量分析
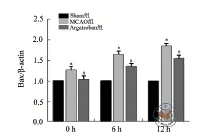
图5 Western blot 检测不同时间点三组大鼠脑组织细胞Bcl-2蛋白表达定量分析
讨 论
AIS是常见的破坏性神经系统疾病,也是全球第2 大致死原因,深入探究AIS的神经保护机制刻不容缓[4]。本研究通过建立大鼠MCAO 模型观察阿加曲班对AIS 大鼠脑组织细胞凋亡的神经保护作用。结果表明,阿加曲班可通过减少脑细胞凋亡数量,抑制caspase-3和Bax表达,上调Bcl-2 水平从而发挥神经保护作用。
20 世纪80年代早期,日本医疗人员就将阿加曲班用于治疗心肌梗塞、经皮冠状动脉介入治疗和脑血栓等临床研究中[5]。与肝素不同的是,阿加曲班可独立于抗凝血酶Ⅲ竞争性的抑制凝血酶而发挥抗凝血作用,同时还可抑制纤维蛋白形成[6]。一项急性缺血性脑卒中抗凝治疗的临床研究表明在AIS 治疗早期,阿加曲班是唯一的一种具有明显效果的抗凝血药物[7]。有关阿加曲班的药物安全性和可行性也曾被报道过。研究指出用阿加曲班治疗后的脑梗死患者的出血风险和死亡率并没有额外增加,也没有出现严重的副作用和并发症,而且并不影响其他抗凝血药物的治疗时间窗[8]。在脑出血的小鼠模型中,给予阿加曲班治疗改善了损伤动物的神经功能且降低了神经细胞的凋亡数量[9]。本研究表明,在MCAO组0~12 h 之间,阿加曲班能够降低AIS 大鼠脑组织细胞凋亡数量,且在0 h 时与Sham组差异无统计学意义。这与前人的研究具有一致性[8-9]。
caspase-3是半胱氨酸-天冬氨酸蛋白酶(cysteine-aspartic acid protease,caspase)家族成员,它作为关键蛋白在凋亡过程中发挥蛋白质降解的作用[10]。caspase-3 最初以procaspase-3 形式存在且不具活性。在天冬氨酸残基蛋白水解加工后,procaspase-3 转化为具有活性形式的caspase-3 从而介导细胞凋亡过程[11]。caspase-3 可作为细胞凋亡指标,其表达上调则表示细胞凋亡增加,反之细胞凋亡减少[12]。大量研究表明caspase-3 作为死亡蛋白酶在AIS 诱导的细胞凋亡中表达上调。临床研究发现,在发病12 h的AIS 患者血清中检测到caspase-3的表达且在24 h 时达到巅峰,并伴随有神经细胞损伤加重和梗死灶体积扩大的现象[13]。此外,在AIS 大鼠模型中可观察到损伤大鼠海马区神经元凋亡数量及caspase-3表达均高于对照组,而给予相关药物治疗可有效修复神经元细胞损伤,降低脑组织caspase-3蛋白表达[14]。陈静等[15]在相关综述中曾经提到caspase-3的mRNA表达及蛋白水平在脑梗死损伤后均出现升高,在caspase-3表达阳性高峰期后6 h 出现神经细胞凋亡的高峰期,这说明脑梗死诱发的神经细胞凋亡与caspase-3蛋白活性及裂解物的增加密切相关,并呈现出时间依赖性。本研究发现,在损伤0~12 h 内,MCAO组大鼠脑组织细胞caspase-3表达与Sham组相比升高且具有时间依赖性,期间伴随着脑组织细胞凋亡数量的递增。
Bcl-2蛋白家族是线粒体膜完整性和功能的主要调控因子,根据结构同源性可将其划分为3个亚型:抗凋亡蛋白如Bcl-2、Bcl-xL和Bcl-w等;促凋亡蛋白如Bax和Bak等以及包括Bad、Bid和noxa的BH3 only蛋白[16]。这些蛋白相互作用参与了线粒体介导的凋亡通路和非caspase 依赖的凋亡通路,从而介导了AIS引起的神经细胞凋亡机制[17]。Bcl-2 主要位于线粒体外膜、内质网和核周膜上,通过改变与促凋亡的Bax表达来调节膜的通透性[18]。在正常细胞中,Bcl-2和Bax处于平衡状态,不发生凋亡。脑缺血损伤发生后,BH3-only蛋白与Bcl-2结合置换出Bax,增加线粒体膜的通透性导致细胞色素C的释放,诱导细胞凋亡[19]。Bcl-2和Bax的功能相互拮抗,上调Bcl-2表达可抑制Bax 水平从而阻断细胞凋亡过程[20]。本研究发现,Bcl-2在AIS 0 h 时,其蛋白水平降低,随后升高并在损伤6 h时达到巅峰值,这提示内源性的Bcl-2对脑组织细胞缺血凋亡的敏感性,即Bcl-2 参与了早期的脑梗死病理进程,这与蒋杞英等[21]研究具有一致性。基于检测的间隔时间较短的影响以及细胞中Bcl-2 代偿性升高的可能性,尽管ELISA 结果显示损伤12 h后大鼠脑组织细胞中Bcl-2表达仍高于Sham组,但Western blot 结果表明MCAO组大鼠Bcl-2蛋白表达在12 h 时已经降低到与Sham组水平接近且无统计学意义,表明早期Bcl-2 参与早期脑梗死的病理过程可能存在时间延迟效应。脑梗死6~12 h期间,随着脑梗死损伤时间延长,MCAO组Bcl-2表达逐渐降低,Bax的水平进一步升高,提示随着损伤时间的递增,Bcl-2的保护功能逐渐被抑制,而Bax的促凋亡效果更加明显。阿加曲班治疗后能进一步上调Bcl-2的表达,提示阿加曲班可通过增强MCAO 诱导的Bcl-2 水平消退而产生神经保护作用。
脑缺血后神经细胞凋亡途径是一个涉及多因素的复杂机制。其致病机制仍然需要更进一步的探索。本研究表明阿加曲班能够通过减少脑梗死诱发的脑组织细胞凋亡,抑制caspase-3和Bax表达同时上调Bcl-2 水平逆转损伤引起的凋亡效应,这为阿加曲班的临床应用奠定了更深的理论基础。

