TWEAK/Fn14信号调控干细胞增殖与分化的作用与机制
肿瘤坏死因子样弱凋亡诱导蛋白(tumor necrosis factor- like weak inducer of apoptosis,TWEAK)是肿瘤坏死因子(tumor necrosis factor,TNF)超家族细胞因子成员,主要由体内单核(巨噬)细胞分泌产生。TWEAK是一种多功能细胞因子,通过作用唯一受体成纤维细胞生长因子14(fibroblast growth factor-inducible 14,Fn14)调节细胞增殖、分化、迁移和血管生成等多种生命活动,并参与调控机体的炎症反应。干细胞是在生物个体发育过程中存在于各组织中未成熟或未分化的原始细胞,具有自我更新与多向分化潜能,按其分化的能力可分为全能干细胞、多能干细胞和专能干细胞。其中未分化的多能或专能干细胞又称为祖细胞。近年研究表明,TWEAK/Fn14信号可以调节多种干细胞的增殖与分化,参与成熟个体肝再生、肌肉生成和神经再生等生理及病理过程。近年TWEAK/Fn14信号调控干细胞有较多报道。本文对相关文献进行综述。
一、TWEAK/Fn14信号的基本结构与信号通路
TWEAK 结构高度保守,人、鼠TWEAK的胞外受体结合区具有93﹪的同源性。TWEAK是由249个氨基酸组成的Ⅱ型跨膜蛋白,可裂解形成可溶性TWEAK(soluble TWEAK,sTWEAK)而发挥更强大的生物活性[1]。TWEAK胞外区C 端通过β-折叠构成三聚体,三聚体亚基之间形成沟槽为受体结合区。跨膜区通过柄状结构与受体结合区相连,柄状结构含有较多碱性氨基酸,可能对蛋白水解反应敏感。Fn14是Ⅰ型跨膜蛋白,胞外区有一富含半胱氨酸的结构域与TWEAK的结合密切相关,胞质尾部含有肿瘤坏死因子受体相关因子(TNF receptor associated factor,TRAF)结合位点。体内多种组织器官可检测到TWEAK 与Fn14的表达,如心脏、肾脏、肝、脑和皮肤组织等[2]。在生理条件下,TWEAK和Fn14的表达水平相对较低,当组织损伤及炎性反应时,TWEAK和Fn14的表达明显上调[3]。
TWEAK 与其受体Fn14 特异性结合可调节细胞增殖、分化、迁移、死亡[4-6]和血管生成[7]等多种生命活动,并刺激细胞表达多种促炎细胞因子参与调控机体的炎症反应[8]。目前认为TRAF 途径与核因子κB(nuclear factor kappa-B,NF-κB)途径是TWEAK/Fn14信号转导两个最主要的下游通路。TRAF是一类重要的衔接分子,可与Fn14 胞质尾部结合的有TRAF1、TRAF2、TRAF3、TRAF5,其中TRAF2可与细胞凋亡抑制蛋白1(cellular inhibitor of apoptosis protein1,cIAP1)形 成cIAP1-TRAF2 复 合 物,在Fn14 激活后被招募。cIAP1 可以增强细胞对TNF-α的敏感性[9]。TWEAK 与TNF-α协同作用可诱导细胞增殖和凋亡两种截然不同的命运,这取决于细胞膜表面肿瘤坏死因子受体(TNF receptor,TNFR)的亚型[10]。特定炎症微环境改变细胞的TNFR表达谱,Fn14-TRAF2-TNFR1信号轴诱导细胞凋亡,Fn14-TRAF2-TNFR2信号轴则激活NF-κB信号通路,活化的NF-κB 转位进入细胞核,作用于相应的功能元件发挥促细胞增殖[11]在内多种生物学效应(图1)。亦有报道称,TWEAK/Fn14信号可激活丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路。哺乳动物细胞中MAPK 亚族主要包括细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK),c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38 MAPK。如,TWEAK 可增加人脐静脉内皮细胞中磷酸化的ERK和JNK 水平,TWEAK作用于C2C12 肌管可诱导ERK、p38和JNK的磷酸化。此外,TWEAK 作用于人真皮微血管内皮细胞并激活ERK、p38和JNK信号通路,可增加E-选择素和细胞间黏附分子-1的产生,从而促进血管炎的发生发展[12]。
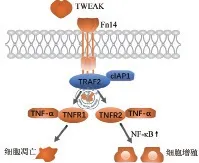
图1 Fn14-TRAF2-TNFR信号轴调控细胞增殖与凋亡
二、TWEAK/Fn14信号促进肝干细胞增殖
肝细胞是组成肝脏最主要的一类细胞,它更新缓慢,日常增殖活动较少。但当肝脏受到急性损伤时,肝细胞可以迅速进入细胞周期活跃分裂促进肝组织再生。慢性肝脏损伤时,肝细胞反复破坏导致其再生能力受到不同程度的损害,此时肝干细胞被激活,它可以大量增殖并迁移至实质组织分化成肝细胞和胆管上皮细胞,这对慢性肝脏损伤的修复具有重要的意义[13]。肝干细胞定位于肝板和胆管交界的Hering管的肝细胞巢中,具有高核质比的特征。在这个特殊的区域,肝干细胞靠近新生的肝细胞和胆管上皮细胞,而且很多体外实验也证明了它可以向肝细胞和胆管上皮细胞分化,表达它们特有的标志物,如甲胎蛋白、细胞角蛋白18[14]。已知一些细胞因子可以参与调节此过程,如肝细胞生长因子、转化生长因子等,但它们同时也可促进肝细胞的增殖而非选择性作用于肝干细胞[15]。
2005年,Jakubowski 等[16]发 布的研 究 结 果表 明,TWEAK 可选择性地促进肝干细胞的分裂。在转基因小鼠肝脏内,外源性TWEAK 可显著增强肝干细胞的增殖活动,肝干细胞与肝细胞均可表达Fn14,TWEAK 却没有促进肝细胞分裂。新生个体肝脏高表达Fn14蛋白,成熟个体肝脏表达很少,只有在损伤或修复时才升高。二乙基二硫代氨基甲酸钠(diethyldithiocarbamate,DDC)诱导化学损伤小鼠肝脏模型中,使用TWEAK 特异性抗体可减少约35﹪肝干细胞的增殖,与DDC 诱导的Fn14 基因敲除小鼠中肝干细胞增殖减少的比例大致相同。基于TWEAK在体内分布的特性推测该模型中内源性TWEAK 来源于肝血窦腔内的库普弗细胞或炎性浸润的巨噬细胞。使用TWEAK 抗体与缺乏Fn14表达都没有完全抑制肝干细胞的分裂,表明亦有其他信号通路参与调节。建立小鼠肝部分切除模型,肝组织Fn14表达水平升高,检测到肝干细胞增殖水平升高。Fn14 基因敲除小鼠肝部分切除后,肝干细胞增殖活动受到抑制[17]。Tirnitz- Parker 等[18]体外分离培养肝干细胞,加入重组人TWEAK 后活化NF-κB的含量升高,MTT 法显示TWEAK 剂量依赖以及时间依赖性地促进肝干细胞的增殖。向肝干细胞已被激活的小鼠体内注射重组人TWEAK 作为实验组,注射安慰剂作为对照组,原位检测细胞的增殖能力。24 h 后,实验组较对照组肝干细胞的数目增加了两倍,而在任意时间实验组肝细胞的增殖活动较对照组都无显著差别。综上,TWEAK/Fn14信号激活NF-κB信号通路促进肝干细胞增殖。
三、TWEAK/Fn14信号促进神经干细胞分化
传统观点认为,中枢神经系统神经元在个体出生后不久就丧失了再生的能力,直到1992年,Reynolds 等[19]首次从成年大鼠纹状体中分离得到神经干细胞,创造性地建立了体外培养成年哺乳动物神经干细胞的方法,将人们带出“神经细胞不具有新生能力”的误区。神经干细胞存在于发育和成熟的中枢神经系统[20],神经再生的过程发生在成熟个体侧脑室的脑室下区与海马齿状回的颗粒下层[21],具有自我更新和多向分化潜能的神经干细胞可分化为神经元、星形胶质细胞和少突胶质细胞[22]。神经干细胞是神经系统发育和再生过程中重要组成部分,对于神经组织遭受损伤或疾病时维持成体细胞的数量起着至关重要的作用[23]。
在脑组织中可以检测到TWEAK的表达,严重颅脑损伤与脑缺血梗死中TWEAK及其受体Fn14的表达明显上调,故推测TWEAK 与脑组织修复的过程有关[24-25]。Scholzke等[26]进行了TWEAK 干预神经干细胞增殖与分化效应的研究,结果显示,TWEAK 作用于成年大鼠脑室下区后,检测到5-溴脱氧尿嘧啶核苷数量减少这是一种能够在细胞增殖时期代替胸腺嘧啶渗入正在复制的DNA 分子的核苷类似物,表明神经干细胞增殖减少。使用选择性NF-κB 途径抑制剂Sc-514 封锁NF-κB信号可改善神经干细胞的增殖活动,验证了TWEAK 通过激活NF-κB 途径干预神经干细胞的功能状态。为检验神经干细胞增殖减少是否伴随分化的进行,Marion 使用抗神经干细胞标志物nestin的抗体与抗未成熟神经元标志物TUJ1的抗体对成年大鼠脑室下区神经组织进行免疫荧光染色。TWEAK 作用后,表达nestin细胞的数量未发生明显改变,而表达TUJ1细胞的数量显著增加。Hes1是前神经元碱性螺旋-环-螺旋转录因子家族中的成员,可抑制神经干细胞向神经元分化,使细胞保持未成熟增殖状态,其表达受到NF-κB信号通路调节。使用RT-PCR 技术检测TWEAK 作用下Hes1mRNA表达水平,24 h 后,可检测到Hes1mRNA表达水平较前显著下降。故TWEAK 可降低Hes1的表达,从而诱导神经干细胞向神经元分化。Fn14 基因敲除成年小鼠中,脑室下区神经组织再生较野生型小鼠明显减少,进一步证实了TWEAK 通过作用于膜受体Fn14促进神经干细胞向神经元分化,从而增强成熟个体脑室下区神经组织修复和再生。目前尚未有TWEAK/Fn14信号调控神经干细胞向星形胶质细胞或少突胶质细胞分化的相关报道。
四、TWEAK/Fn14信号双向调控成肌细胞
骨骼肌细胞又称肌纤维,是由成百上千个单核的祖细胞融合而成的长圆柱形多核细胞。哺乳动物的骨骼肌一生中都能保持强大的再生能力,很大程度上是由于一种称为“肌卫星细胞”的干细胞[27-28]。肌卫星细胞形状扁平有突起,存在于包裹每根肌肉纤维的层粘连蛋白鞘中,在成年机体的骨骼肌中,肌卫星细胞含量较少,大约占1﹪~4﹪[29]。正常情况下,肌卫星细胞保持静止,当肌肉损伤时则被激活进入细胞周期,转化为可以快速分裂增殖的祖细胞——成肌细胞。经过数轮增殖后,成肌细胞进入高度协调的分化过程,逐渐具备成熟肌细胞的生理生化特性,并互相融合形成新的多核肌纤维[30]。肌卫星细胞与成肌细胞在肌肉再生过程中起着至关重要的作用,其中的分子调节机制与信号传导通路相关研究具有重要的意义。
既往研究结果表明,TWEAK-NF-κB信号轴具有与肌肉损伤和修复相关的重要功能[31-32]。NF-κB 最初作为B 淋巴细胞中免疫球蛋白κ 轻链基因转录所需的核内转录因子被发现,后来证明NF-κB 几乎存在于所有细胞,广泛参与机体组织损伤、防御反应、细胞分化和凋亡等,其活化途径包括经典途径与非经典途径[33]。TWEAK 结合Fn14 可激活NF-κB信号转导通路,高浓度sTWEAK 既可以介导经典NF-κB 途径也可以介导非经典NF-κB 途径,低浓度sTWEAK 优先激活非经典NF-κB 途径[34]。有研究表明上述两种途径同时在小鼠成肌细胞株C2C12细胞增殖与分化过程中被激活,但在肌组织再生的过程中却发挥截然不同的作用。经典NF-κB 途径促进成肌细胞分裂而抑制其分化为成熟肌细胞[35-36],而非经典NF-κB 途径则可增加成肌细胞融合促使生成多核肌纤维以恢复肌组织的完整性并提高其抗压能力[37]。故生理状态下低水平TWEAK 加速肌组织的再生,高水平TWEAK 则可抑制肌组织的修复而导致不良结局的发生,使用TWEAK 特异性抗体或抑制剂可改善上述情况。综上所述,TWEAK/Fn14信号双向调控成肌细胞的功能,为肌肉损伤与肌肉疾病治疗的研究提供了新的方向。
五、TWEAK/Fn14信号调控间充质干细胞增殖与分化
间充质干细胞主要存在于结缔组织和器官间质中,以骨髓组织中含量最为丰富。在特定的诱导条件下,间充质干细胞可分化为脂肪、软骨、骨、肌肉、肌腱和关节等多种组织细胞[38-39]。间充质干细胞增殖情况是由周围微环境所调控的,研究在体外促进间充质干细胞增殖的条件,特别是各种细胞因子对其作用,是目前研究的热点。
体外分离培养人骨髓间充质干细胞,使用抗Fn14 单克隆抗体ITEM-4 显示Fn14在骨髓间充质干细胞表达。为检验骨髓间充质干细胞是否为TWEAK 反应性细胞,Girgenrath 等[40]检测了TWEAK 作用于骨髓间充质干细胞后NF-κB的活化情况。细胞裂解液中活化p65 含量明显升高证实了TWEAK 可作用于骨髓间充质干细胞并激活NF-κB信号转导通路。TWEAK 还上调骨髓间充质干细胞一些基因的表达,如周期蛋白依赖性激酶1、细胞周期蛋白A2 以及细胞间黏附分子-1和血管细胞黏附分子-1 等,表明TWEAK/Fn14信号很可能参与调节骨髓间充质干细胞的功能状态。全骨髓贴壁培养法分离纯化大鼠骨髓间充质干细胞,用腺病毒载体Ad5CMV-TWEAK 转染TWEAK 基因,大鼠骨髓间充质干细胞表达并分泌TWEAK 刺激其自身,细胞计数绘制的生长曲线显示骨髓间充质干细胞增殖活动增强。上述实验结果表明,TWEAK/Fn14信号激活NF-κB信号转导通路促进骨髓间充质干细胞增殖[41]。
骨髓间充质干细胞在将要形成骨的部位先分化为骨祖细胞,进而分化为成骨细胞,后者分泌类骨质,并被包埋其中成为骨细胞。Vincent 等[42]研究结果表明,TWEAK/Fn14信号可抑制源于骨髓间充质干细胞的成骨细胞向骨细胞分化。TWEAK 抑制成骨细胞转录因子RUNX2和Osterix的生成,下调成骨作用相关基因表达,并诱导成骨细胞分化抑制剂,骨硬化蛋白的生成,从而抑制成骨细胞分化为骨细胞,减少骨组织的生成。此外,在即将形成软骨的部位,骨髓间充质干细胞增殖并依次分化为骨祖细胞、成软骨细胞和软骨细胞。Girgenrath 等[40]在体外培养骨髓间充质干细胞的实验过程中发现,TWEAK的表达可能抑制源于骨髓间充质干细胞的成软骨细胞向软骨细胞的终末分化,进而干预软骨组织的生成与修复。
除骨髓外,脐带血、外周血和脂肪等组织中也含有间充质干细胞,其中存在于脂肪组织中的间充质干细胞因取材容易、不涉及伦理问题、便于自体移植和患者易接受等特点,日益受到研究者的重视。Alexaki 等[43]使用吸脂术获取人体腹部与臀部皮下脂肪组织,分离纯化脂肪间充质干细胞,免疫荧光染色显示TWEAK在脂肪间充质干细胞内少量分布,Fn14在脂肪间充质干细胞膜表面密集分布。体外培养脂肪间充质干细胞并诱导其分化,随着成脂过程的进行,脂蛋白脂肪酶与过氧化物酶体增殖物激活受体γ表达水平逐渐升高。2 周后,油红O 染色显示脂肪组织生成。新生的脂肪细胞中,TWEAK的表达略有增加,而Fn14的表达显著下降,故推测在脂肪间充质干细胞成脂分化的过程中,TWEAK/Fn14信号可能具有一定的抑制作用。故向未分化的脂肪间充质干细胞加入重组人TWEAK 进行培养,检测到脂肪细胞生成受到明显抑制,当TWEAK 浓度为25 ng/ml 时,抑制作用达到最大,证实了TWEAK/Fn14信号抑制脂肪间充质干细胞向脂肪细胞分化,但具体激活何种信号机制有待进一步研究。
综上,TWEAK/Fn14信号通过激活NF-κB信号通路促进骨髓间充质干细胞增殖,抑制源于骨髓间充质干细胞的成骨细胞以及成软骨细胞向骨细胞与软骨细胞分化,并可抑制脂肪间充质干细胞向脂肪细胞分化。
六、TWEAK/Fn14信号可能调控皮肤干细胞的作用
皮肤干细胞是一类存在于皮肤中的成体干细胞,始于胚胎发育阶段,并保持增殖分化潜能直至成年。近年来,随着对皮肤干细胞研究的不断深入,人们已经能够在体外分离纯化、鉴别、扩增和培养多种皮肤干细胞,其中包括位于表皮基底层的表皮干细胞以及毛囊Bulge 区的毛囊干细胞等[44]。表皮干细胞维持日常表皮的更新,毛囊干细胞主要维持毛囊的周期性生长,在组织损伤时可转化为表皮细胞及皮脂腺细胞[45]。皮肤干细胞对于皮肤稳态的维持具有重要的作用。在创伤愈合过程中,表皮干细胞和毛囊干细胞增殖分化,逐渐迁移至创伤区域,促进损伤组织的修复[46]。
皮肤干细胞的生长分化受各种信号分子的动态调控。研究结果表明,Fn14在多种皮肤固有细胞中广泛表达,包括角质形成细胞、微血管内皮细胞和真皮成纤维细胞[2]。正常角质形成细胞中TNFR1 占主导地位,炎性条件下TNFR1/ TNFR2 比例发生改变[47],TWEAK 与TNF-α协同作用诱导角质形成细胞表达促炎细胞因子与趋化因子如白介素6、调节激活正常T细胞表达和分泌细胞因子、粒细胞-巨噬细胞集落刺激因子等诱导炎症反应[48],并增强生存素和cIAP2的合成[49]促进角质形成细胞的增殖。TWEAK 可上调成纤维细胞生长因子-2促进真皮成纤维细胞增殖、合成胶原。成纤维细胞能够分泌角质形成细胞生长因子,后者刺激角质形成细胞增殖和迁移而促进损伤组织再上皮化[50]。TWEAK 还上调血管内皮生长因子A的表达,促进血管通透性增加、血管内皮细胞迁移、增殖和血管形成[3]。综上所述,TWEAK/Fn14信号通路通过促进角质形成细胞增殖和迁移、增强皮肤炎症反应、促进血管生成、胶原合成以加速创面的修复。目前尚未有学者研究TWEAK/Fn14信号在皮肤干细胞增殖与分化过程中的作用,TWEAK是否可以直接作用于皮肤干细胞来参与损伤组织再上皮化和纤维化,其真实性及具体作用机制有待进一步研究证明(表1)。
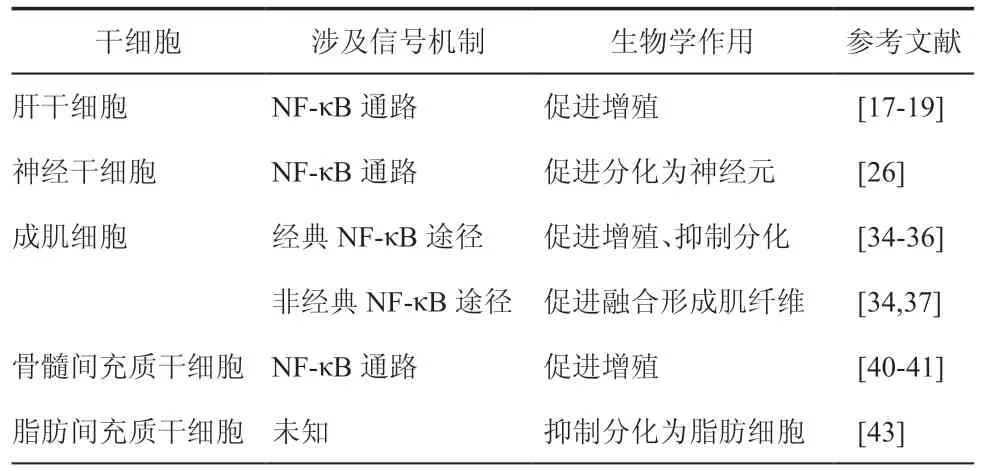
表1 TWEAK/Fn14信号对干细胞的调控作用
综上所述,TWEAK 通过作用唯一受体Fn14 可调控多种干细胞增殖与分化的过程。根据干细胞种类和来源的不同,TWEAK/Fn14信号发挥不同的生物学效应。既往研究结果表明,TWEAK/Fn14信号激活NF-κB信号通路促进肝干细胞增殖、脑室下区神经干细胞向神经元分化。TWEAK/Fn14信号激活经典NF-κB 途径促进成肌细胞增殖而抑制其分化,激活NF-κB 非经典途径促进成肌细胞融合形成肌纤维。TWEAK/Fn14信号激活NF-κB信号通路促进骨髓间充质干细胞增殖,并可抑制脂肪间充质干细胞成脂分化。TWEAK/Fn14信号还可能参与调节皮肤干细胞的功能状态。未来TWEAK/Fn14信号调控干细胞增殖与分化的研究将不仅局限于上述类型的干细胞,造血干细胞、肿瘤干细胞等更多种类干细胞受TWEAK/Fn14信号调控的相关研究即将开展,这无论是对疾病发生机制等基础医学领域,还是对器官移植、组织工程等临床医学领域,都具有深远的理论意义和重大的实践应用价值。

