微小RNAs在肝癌中的作用机制及相关应用研究进展
微小RNA(microRNAs,miRNAs)是一类非编码RNA,是一种内源性非编码单链RNA 小分子(约20个bp),通过调控靶基因表达参与大多数生物学过程,其介导的基因调控功能为解释多种疾病的复杂机制提供了新的证据[1]。肝细胞癌(hepatocellular carcinoma,HCC),简称肝癌,是最常见的原发性肝脏恶性肿瘤,是世界范围内第6 大实体恶性肿瘤,也是癌症类疾病死亡的第4 大病因[2-4]。HCC 发病率在我国相关肿瘤疾病中排名第4,致死率排名第3[5]。根据流行病学以及相关实验研究发现,许多外部环境因素以及病毒性疾病和药物的使用,导致了肝损伤和HCC的迅速发生,然而HCC 发生和发展的确切机制尚未完全阐明[6]。推进HCC 与miRNAs 之间关系的深入研讨,将为HCC 分子机理研究、临床诊疗和预后评估提供新的思路。本文旨在强调miRNAs在肝癌发生发展、多重耐药性中的作用以及作为肝癌潜在治疗靶点的价值,并就miRNAs在HCC 中的功能、分子作用通路和应用三方面的相关研究进展进行综述。
一、miRNAs 简介
Lee 等[7]1993年首次对突变体的遗传特性进行了剖析,发现了一种能够调控其晚期胚胎发育基因的新型RNA,引起了世界各国的关注和研究。miRNAs是可通过碱基互补配对原则靶向结合至特定蛋白编码基因mRNA的3'端非翻译区并介导其降解或阻滞翻译,其对基因表达具有负调控作用,根据靶点的细胞功能来促进或抑制肿瘤的发生发展[1,8]。
miRNAs的生物发生首先系由RNA 聚合酶Ⅱ介导转录为初级miRNAs。初级miRNAs 经由核糖核苷酸内切酶Ⅲ即Drosha及其辅助因子DGCR8 一起在细胞核内加工形成前体miRNAs[9]。这种前体miRNAs 呈发夹状,经由exportin-5 输出到细胞质,并被核酸内切酶Dicer及其复合体切割形成双链miRNAs[10]。最后,加工成熟的双链miRNAs解链后,诱导链被整合到RNA 诱导沉默复合体中,进而介导靶基因mRNA的降解或翻译抑制,另一条miRNAs 则通常被降解。
miRNAs 既可以通过调控靶分子群的表达来维持其在细胞内的功能,也可以从结合其他蛋白的细胞中释放出来,并以自由分子形式存在。作为释放小泡的一部分,特定的miRNAs 可以在局部保持其功能活性,或者通过血液等运输到其他组织或器官[11]。miRNAs 多样化的功能及调控作用为其成为早期HCC 诊治、预后评估的重要工具和全新有效的癌症治疗靶点提供了可能。
二、miRNAs在肝癌中的功能
(一)miRNAs 作为癌基因的功能及作用机制
研究发现许多miRNAs在HCC 中发挥着癌基因的作用,这些miRNAs在HCC组织和细胞系中的表达水平上调。miRNAs 通过信号通路调控下游靶基因、靶蛋白,从而对HCC 起到致癌基因的作用。Xiao 等[12]从研究中发现miR- 330-5p 通过靶向Sprouty2蛋白来激活蛋白激酶(细胞外调节激酶)信号通路,促进HCC细胞的增殖;miRNAs 通过直接结合到靶基因的mRNA的3'端非翻译区,从而对HCC 起到致癌基因的作用。Fu 等[13]发现miR-155-5p 可通过靶向结合PTEN 基因的3'端非翻译区以调控其表达,进而通过影响PI3K/Akt信号通路以促进HCC细胞的增殖、侵袭和迁移,并抑制HCC细胞的凋亡;miRNAs 通过调节去磷酸化,从而对HCC 起到致癌基因的作用。Li 等[14]研究发现miR-552 通过阻断Wnt 抑制因子1 介导的糖原合成激酶-3β去磷酸化促进HCC的发生和发展。miR-552在HCC组织中表达上调,其过表达促进Hep3B细胞的迁移、侵袭和上皮间质转化。
(二)miRNAs 作为抑癌基因的功能及作用机制
研究发现许多miRNAs在HCC 中发挥着抑癌基因的作用,这些miRNAs在HCC组织和细胞系中的表达水平下调。miRNAs 通过多种信号通路调控靶基因或靶蛋白,对HCC 起到抑癌基因的作用。Wu 等[15]发现miR-29c-3p在HCC组织和细胞系中的表达下调,miR-29c-3p 可通过靶向DNMT3B和LATS1 基因相关的Hippo信号通路在HCC中发挥相应的抑癌作用。Guo 等[16]研究发现miR-663b在HCC组织细胞系中以低水平表达,miR-663b 过表达通过靶向Grb2 协同结合蛋白2 抑制HCC细胞的增殖和侵袭能力。
(三)miRNAs在肝癌多重耐药性中的功能及作用机制
HCC是一种多血管原发性肝癌,具有进展快、对传统化疗药物耐药等特点。肝切除和肝移植是当前医治HCC 最有效和领先的治疗手段,化疗药物索拉非尼是HCC 晚期治疗经常使用的多激酶抑制剂。但由于肿瘤迅速获得耐药性,索拉非尼的作用是短暂的[6]。
已有研究表明,miRNAs 通过调节参与药物转运的相关基因表达,在调控HCC细胞多重耐药性方面发挥着重要作用[17]。长春新碱和阿霉素是体现HCC 高耐药性的两种化疗药物。当miR-122和长春新碱(阿霉素)联合使用时,HCC细胞对这些化疗药物的敏感性显著增强[18]。Yahya等[17]研究调查了在HCC细胞中miR-122 与细胞周期分布和多重耐药相关基因(ABCB1、ABCC1、ABCG2和ABCF2)表达的关系。研究显示,用阿霉素处理或未处理的HepG2细胞中miR-122的过表达可下调MDR 相关基因(ABCB1和ABCF2)来调节细胞对化疗药物的敏感性,通过诱导细胞周期(G0/G1期)停滞进而抑制HCC细胞生长。Azumi 等[6]发现miR-181a在更具侵袭性的Hep3B HCC细胞系中表达上调,其通过抑制Ras 相关结构域家族蛋白1 基因引起索拉非尼的耐药性。为了进一步确定 miRNAs在HCC 耐药性中的作用,Zhuo 等[19]对Huh-7细胞中miRNAs 与多重耐药性的关系进行了分析。分别用阿德霉素、顺铂、卡铂、丝裂霉素C和长春新碱对HCC Huh-7细胞系进行浓度递增的处理以开发耐药亚系,结果miR-27b、miR-181a、miR-146b-5p、miR-181d和miR-146a为肝癌耐药细胞亚系中表达差异最大的miRNAs,是靶向PTEN、P53和KRAS 等的关键蛋白。由此可见,这些miRNAs在HCC的多重耐药性形成进程中发挥着重要作用,可以作为调控耐药性形成相关通路的有效靶点。监测和靶向miRNAs 以阻止疾病进展并克服耐药性,是应对HCC 发生发展的有效方案。
三、miRNAs在肝癌中的分子作用通路
HCC 中存在miRNAs的局部异常表达,它们多靶向于HCC 发生、发展密切联系的基因和信号通路,从而调控HCC细胞的增殖和分化等重要病理进程。根据miRNAs在HCC中发挥的不同作用,可将分子通路分为mTOR 通路、Wnt 通路、JAK/STAT 通路和MAPK 通路等[20](表1)。
目前的研究表明,miRNAs 调控作用在HCC 中最具代表性的通路是mTOR,同时Wnt、MAPK和JAK/STAT 也受miRNAs表达水平的影响[20]。miRNAs 作为癌基因或抑癌基因,参与调控了HCC 发生过程中主要相关基因的表达,并为进一步探讨miRNAs在HCC 发生发展中的作用机制研究提供了新思路。
四、miRNAs在肝癌中的应用
(一)miRNAs 与肝癌的诊断
近年来研究人员通过大量实验对生物标记物——甲胎蛋白、甲胎蛋白异质体以及脱-γ-羧基凝血酶原的可靠性提出质疑,尤其体现在良性肝病(肝炎和肝硬化)当中。诸多实验数据显示甲胎蛋白及血清异常凝血本酶原的准确性不高,在HCC 肿瘤小于3 cm的患者中,仅有50﹪显示血清异常凝血本酶原活性升高[33-34]。甲胎蛋白是HCC 中应用最广泛的血清生物标志物,但其敏感性和特异性仅为60﹪和90﹪[35]。因此早期HCC的诊断迫切需求一种新的生物标志物。
理想的HCC 生物标志物应具有敏感性、特异性、可重复性、可降解性和非侵入性,能够在血清、血浆、尿液或唾液等易获取的组织中进行评估[36]。Zhang 等[35]研究表明靶向三叶态因子3的miR-7-5p和miR-203a-3p 可成为HCC 早期诊断的潜在生物标志物。Jin 等[36]研究证明4 种循环 miRNAs(miR-1972,miR-193a-5p,miR-214-3p和miR-365a-3p)可以区分HCC 与其他非HCC个体。血液中循环miRNAs 以高度稳定、无细胞的形式循环,有望成为HCC 早期诊断的新型潜在生物标志物。Wang 等[37]研究发现血清中的miR-132和miR-212在HCC 诊断中具有潜在作用。此外,miR-132、miR-212和甲胎蛋白联合使用提高了HCC的诊断效率,尤其是在敏感性和阴性预测值方面。这些结果均证明miRNAs能够作为HCC 早期无创检测的新型生物标志物。除此之外,其他外泌体如环状RNA(circular RNA,circRNA)、长链非编码RNA(long non-coding RNA,lncRNA)等通过其差异性表达水平,也在HCC 早期诊断方面发挥重要作用。Yu 等[38]研究发现在HCC细胞中circRNA-104718 与miR-218-5p 存在关联并共同表达。circRNA-104718 可充当内源性RNA(ceRNAs)并通过靶向miR-218-5p/TXNDC5信号传导途径促进HCC细胞增殖,有望成为HCC诊断和治疗的潜在靶标。Li 等[39]研究表明lncRNA FAL1在HCC 中充当致癌基因,LncRNA FAL1 可通过竞争性结合miR-1236 来加速HCC细胞的增殖和转移,可能是未来HCC的新型诊断生物标志物。
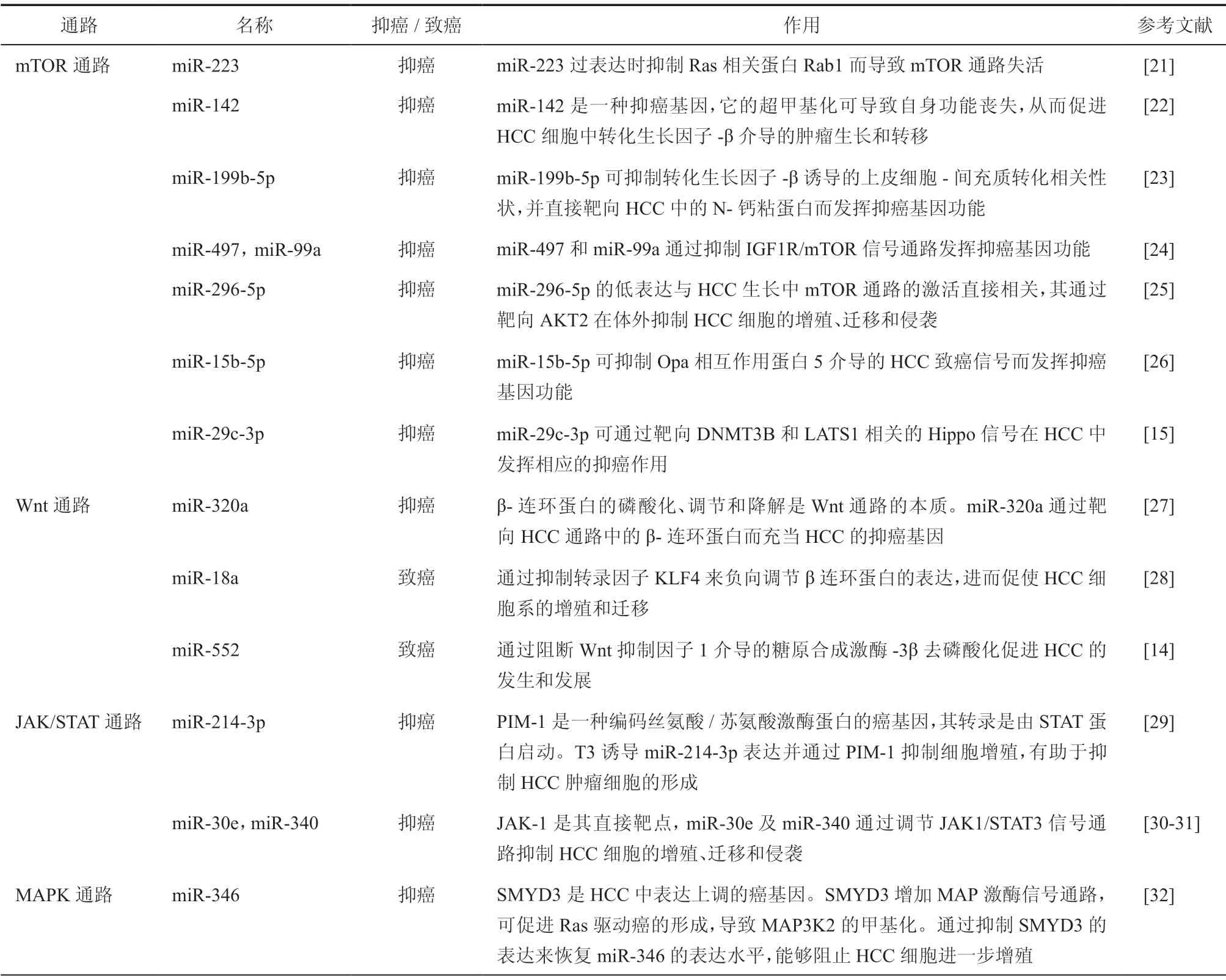
表1 miRNAs在肝癌中的分子作用通路
(二)miRNAs 与肝癌的治疗
有研究证据发现miRNAs 作为一种针对HCC的新治疗策略,在癌症治疗方面存在一定的潜在应用价值。单个miRNAs 能够调控数百个靶基因,包含转录因子、细胞因子和受体,并与许多靶基因构成复杂的调控网络。此外,miRNAs 不具备免疫原性且不编码蛋白,这些优势均证明了miRNAs在HCC 多基因疾病靶向治疗方面的应用价值。
目前,应用miRNAs 治疗HCC 主要有两种方案。第一种是通过调控前体miRNA 纠正在HCC 中表达下调的miRNAs,从而抑制HCC的增殖或诱导肿瘤细胞自身的凋亡。Fornari 等[40]证实miR-122 可通过直接作用于cyclin G1 来抑制HCC细胞的生长,进一步影响p53的转录活性及稳定性,降低HCC的转移能力;第二种是采用溶瘤病毒疗法。与正常组织相比,溶瘤病毒更能感染和杀死癌细胞,它作用多种肿瘤组织,导致癌细胞溶解,对正常组织表现出轻微的毒性[41]。Callegari 等[42]通过利用miR-199的差异性表达,开发了一种有复制能力的溶瘤腺病毒Ad-199T,实现了特异性溶瘤病毒的表达和复制,并发现在miR-199的正常阳性肝实质中,Ad-199T 复制受到抑制,溶瘤腺病毒Ad-199T可以在不引起明显肝毒性的情况下显示出治疗HCC的潜力。此外,有学者发现,有望运用反义法抑制处于上调水平的miRNAs。Krützfeldt 等[43]在小鼠体内注入修饰过的反义RNA,发现肝脏等组织的miR-192、miR-194、miR- 16和miR-122的表达下调。如若能引入与具有癌基因性质的miRNAs 互补的合成反义寡聚核苷酸,则可以有效地灭活HCC 中的miRNAs,延缓其增长。这些研究结果均表明miRNAs在HCC的发生和进展中扮演着重要的角色,其生物学的复杂性为治疗干预提供了一种新的作用机制,同时,在药物治疗与靶向性调节剂方面具有一定的发展前景。
(三)miRNAs 与肝癌的预后
与HCC 发生发展相关的一些miRNAs 已被证明能准确预测HCC的不良预后。Shen 等[44]研究证实HCC组织中呈现高表达的miR-590-5p是HCC 侵袭和转移相关的调控分子,其高表达水平显示HCC 患者的预后较差。Li 等[45]研究发现HCC组织中miR-145表达下调,其表达水平与肿瘤大小、肿瘤数量、淋巴结转移、TNM 分期以及肿瘤分化相关。经过Cox 比例风险回归模型的多变量分析可得,miR-145 低表达患者的总生存期短于miR-145 高表达患者,miR-145的低表达是HCC 患者预后不良的一个监测指标。Ali 等[46]研究发现血清中miR-133b、miR-26a、miR- 107和miR-106 可能成为经导管动脉化学栓塞治疗HCC 患者的预后生物标志物。因此,怎样寻找具有高稳定性和高准确性的miRNAs,将为接下来的研究带来新的挑战。
miRNAs是近年来研究的热点,研究进展迅速。大量有关miRNAs在正常细胞功能和疾病中的作用机制研究表明,miRNAs在HCC 不同阶段中发挥了关键作用,是其发展过程中的关键调控因子和主要参与者。miRNAs的侵袭、增殖、转移、凋亡以及相关的抑癌、致癌与耐药性作用可能是HCC的主要调控机制,并已成为HCC 诊断、治疗和预后评估中的一个关键靶标。了解miRNAs在HCC 发生发展中的调控机制,有助于开发更有效的新疗法和分子治疗药物。
然而,在miRNAs的研究中也存在一些问题。许多研究处于实验阶段,尚未真正应用于临床实践。其次,作为HCC早期诊断和治疗标志物,miRNAs的安全性和可靠性也需要进一步的研究。此外,关于外泌体miRNAs 当前研究主要集中于观察血清中miRNAs的含量,但HCC 发生的具体机制尚不完全清楚。因此,未来的研究应将miRNAs在HCC 中的获得性成果转化为临床应用,如开发可用的miRNAs 抑制剂等。对于miRNAs在HCC 早期诊断和治疗中的安全性和可靠性的研究也值得关注。推进miRNAs 与HCC 之间关系的深入研讨,将会为进行HCC 分子机理研究、临床诊疗和预后评估产生深远的影响,同时有助于进一步提高医生在抗肝癌诊断和治疗中的临床决策能力。

