宫内缺氧对幼年大鼠海马CA3区SYN、Jmjd6的表达与学习、记忆能力的影响
徐小洁,余 鸿
(1.南通卫生高等职业技术学校,江苏 南通 226016;2.西南医科大学,四川 泸州 646000)
宫内缺氧是胚胎发育中的常见问题,神经细胞对缺氧极为敏感(尤其在胚胎发育期),致使出生后出现智力障碍、脑性癫痫、瘫痪等严重的神经系统疾病。目前,国内外关于宫内缺氧对神经系统的影响机制及脑内一些神经递质的表达变化报道甚少。因此,探讨宫内缺氧对海马CA3区突触体素(SYN)和Jmjd6的表达变化及对幼年大鼠学习记忆能力的影响机制具有重要意义。
1 材料与方法
1.1 试剂与仪器
小鼠抗SYN购自美国Millipore公司,兔抗Jmjd6购自Abcam(Hong Kong)Ltd,羊抗小鼠及羊抗兔均购自北京中杉金桥公司,Leica RM2245电动切片机购自德国Leica公司,Morris水迷宫跟踪系统购自成都泰盟公司,三气培养箱购自美国REVCO公司。
1.2 实验动物
选择健康成年雌性SD大鼠14只(第三军医大学滕鑫生物技术有限公司提供),体重230~250 g,分别与健康成年雄性SD大鼠5只(西南医科大学动物实验中心提供),体重230~250 g,按1∶1先后合笼饲养配种,以第二日晨发现雌鼠阴栓记为妊娠0 d,取出雌鼠单独饲养至孕第14 d。将孕鼠随机分为对照组和缺氧组,分别为6只和8只。
1.3 方法
1.3.1 宫内缺氧 将缺氧组孕鼠自孕第14 d开始,放入设置好(氧浓度130 ml/L,二氧化碳浓度0.3~0.4 ml/L,温度25℃,相对湿度75%~80%)的智能型三气培养箱中制作缺氧脑损伤新生鼠模型,当培养箱控制面板上的数值达到与设置值一致时开始记录缺氧时间,自孕14 d开始每天缺氧2 h,连续5 d(孕期第 14、15、16、17、18 d),对照组不缺氧。两组孕鼠自然分娩(孕第21 d),产后两组每窝随机选取新生鼠两只饲养至30 d(30日龄)。
1.3.2 Morris水迷宫实验 对30日龄的幼年大鼠进行11 d的Morris水迷宫实验。具体实验方法[1]如下:四象限阶段训练,每个象限时间间隔10 min,若训练时大鼠下水60 s仍未找到平台,则引导大鼠到平台上,使其在平台上停留10 s,连续训练5 d,第6 d(35日龄)进行无平台60 s空间探查测试,记录在目标象限的探查时间T1。第7 d开始维持4 d的对位训练,训练方法同前,仅平台移至对侧象限,第11 d(40日龄)进行60 s无平台对位探查测试,记录在目标象限的探查时间T2。实验室环境不变,保持安静,实验者始终处于同一位置,距泳池最近边缘约60 cm。
1.3.3 幼鼠取材、石蜡切片、免疫组化染色 于Morris水迷宫实验结束当日取参与实验的幼年大鼠脑组织,常规石蜡切片(自大鼠大脑前囟向尾侧方向2 mm处,经海马冠状面切片,切片厚5μm),切片脱蜡至水,行SYN、Jmjd6免疫组化染色。
1.3.4 图像分析及统计学处理 将各免疫组化染色切片放在网络版数码显微镜DMBA200下照相,放大400倍。用Image-Pro Plus6.0图像分析软件(Media Cybernetics公司)对图像进行分析,所有指标观察面积为800×600像素,取海马CA3区中的恒定部位对各指标进行分析。比较两组SYN和Jmjd6阳性细胞的积分光密度(IOD)值。各指标以均数±标准差(±s)表示。同一指标组间比较运用SPSS 13.0统计软件包处理,采用独立样本t检验进行统计分析。
2 结果
2.1 Morris水迷宫实验结果
Morris水迷宫实验显示,缺氧组幼年大鼠探查测试时间(T1)和对位探查测试时间(T2)均较对照组短,差异有显著性(P<0.05),见表 1。
表1 两组幼年大鼠Morris水迷宫实验在目标象限搜索时间比较(±s,s)
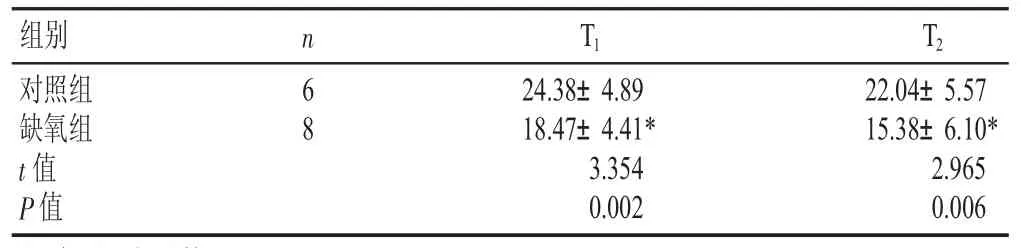
表1 两组幼年大鼠Morris水迷宫实验在目标象限搜索时间比较(±s,s)
注:与对照组比较,*P<0.05
组别 T1 24.38±4.89 18.47±4.41*n T2对照组缺氧组6 8 22.04±5.57 15.38±6.10*t值P值3.354 0.002 2.965 0.006
2.2 两组幼年大鼠海马CA3区SYN免疫组化染色结果
阳性物质为棕黄色的点状或细颗粒状物,分布密集,且集中在多形层(见图1、图2)。图像分析显示,缺氧组SYN阳性细胞的IOD值比对照组小(P<0.05),见表2。
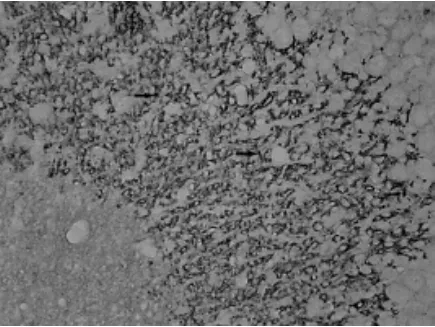
图1 对照组SYN阳性物质(免疫组化染色法,400×)
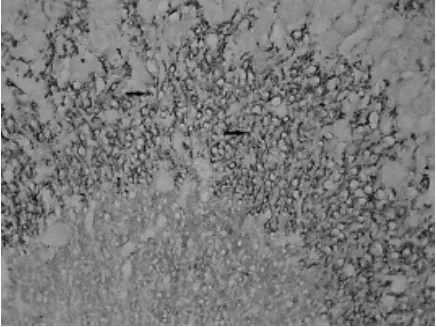
图2 缺氧组SYN阳性物质(免疫组化染色法,400×)
2.3 两组幼年大鼠海马CA3区Jmjd6免疫组化染色结果
阳性细胞胞质被染成棕黄色,细胞中央卵圆形或圆形空泡为细胞核;阳性细胞呈区域性分布,主要位于颗粒层(见图3、图4)。图像分析显示,缺氧组Jmjd6阳性细胞的IOD值比对照组高(P<0.05),见表 2。
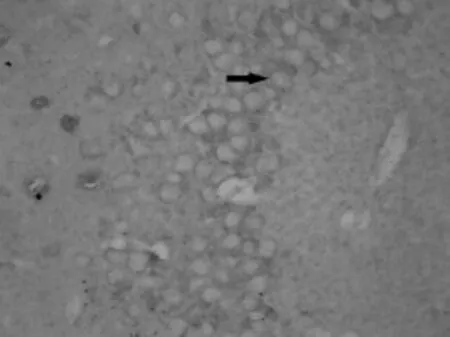
图3 对照组Jmjd6阳性细胞(免疫组化染色法,400×)
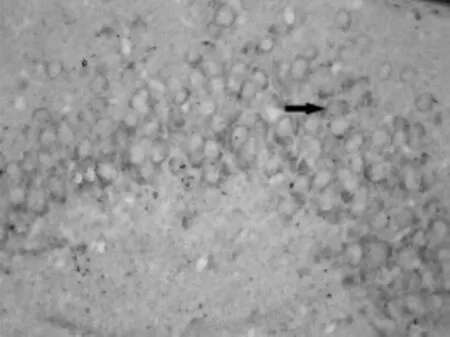
图4 缺氧组Jmjd6阳性细胞(免疫组化染色法,400×)

表2 SYN和Jmjd6阳性细胞积分光密度值比较
3 讨论
3.1 宫内缺氧导致大鼠学习、记忆能力下降
Morris水迷宫实验由美国科学家Richard GM Morris于1981年创立[1]。目前常用来作为评价动物学习与记忆的模型。这一实验的基础是,啮齿类动物在水中有强烈的逃避水环境的动机,并以最快、最直接的途径逃离水环境。学会逃避水环境的过程体现动物的学习能力;根据周围环境进行空间定位,有目的地游往水中安全的地方(平台),体现动物的空间记忆能力。海马在工作、学习、记忆过程中发挥重要作用,对缺氧损伤极为敏感[2]。已有报道表明,缺氧能够损伤大鼠空间记忆能力[3]。本实验发现,自孕 14 d 开始孕鼠连续缺氧(130 ml/L)5 d(2 h/d)后,幼鼠探查测试和对位探查测试在目标象限的搜索时间均较对照组明显延长,说明缺氧组幼鼠的学习、记忆能力下降,宫内缺氧降低了大鼠学习、记忆能力。
3.2 突触体素含量降低导致大鼠学习、记忆能力下降
突触体素(synaptophysin,SYN)又称P38,可作为海马CA3区神经元功能和损伤修复的标示物[4]。突触体素含量越低,记忆损伤越严重[5]。本实验通过对突触体素免疫组化染色及其积分光密度检测,发现缺氧组幼年大鼠海马CA3区的突触体素含量明显少于对照组,IOD值显著低于对照组。说明缺氧导致突触体素含量降低,进而导致大鼠学习、记忆能力降低。
3.3 Jmjd6功能减弱导致大鼠学习、记忆能力下降
Takeuchi等[6]于1995年发现Jumonji基因,该基因是小鼠神经管形成的必需基因,其编码产物Jmj蛋白质含有DNA结合结构域(AT-rich interactiondomain,ARID)和两种保守的 Jmj结构域(JmjN、JmjC)。Jmjd6(Jumonji C domain containing gene 6)属加双氧酶,且是一种组蛋白精氨酸去甲基酶[7]。JmjC结构域可以使精氨酸上的甲基羟基化而去掉甲基[8],这需要氧的参与。在宫内缺氧条件下,JmjC结构域不能发挥正常活性或活性很弱。Jmjd6的加双氧酶功能和组蛋白精氨酸的去甲基化功能就不能正常发挥或功能很弱,可以通过以下途径影响宫内缺氧幼年大鼠的学习、记忆能力:第一,Jmjd6可以调节细胞的分化和增殖,异常调节可以影响细胞的成熟以及导致肿瘤[9],缺氧使Jmjd6的功能不能正常发挥,从而导致功能不正常的神经元不断分化、增殖,造成智力低下;第二,不能正常发挥作用的Jmjd6通过改变基因的表达和调节血管内皮生长因子受体1(Flt1)而影响血管内皮细胞的再生功能[10]。所以,缺氧导致的Jmjd6不能正常发挥作用而抑制血管生成,在本实验中表现为缺氧组幼年大鼠大脑中的血管数量减少,脑供血相对不足进而出现智力低下。这与本次Morris水迷宫实验中缺氧组幼年大鼠探查测试和对位探查测试在目标象限的搜索时间均较对照组短的结果一致。本研究对Jmjd6进行了免疫组化染色及积分光密度检测,发现缺氧组幼年大鼠海马CA3区Jmjd6含量明显高于对照组,说明宫内缺氧可能导致Jmjd6功能不能正常发挥或功能减弱进而造成海马CA3区功能不正常的神经元数量增多,从而降低了大鼠的学习、记忆能力。

