柚皮挥发油化学成分及对灰葡萄孢菌的抑菌活性
叶肖辰皓,姜珊珊,焉炳飞*,叶 敏*
1烟台大学化学化工学院,烟台 264005;2云南农业大学植物保护学院,昆明 650201
水果和蔬菜富含维生素、无机盐和植物纤维,是人体所需维生素、矿物质和膳食纤维的重要来源,也是仅次于粮食的主要农产品[1]。新鲜果蔬在贮运过程中常常会因植物病原菌侵染而发生病变腐烂,造成巨大的经济损失和资源浪费[2]。灰葡萄孢菌(Botrytiscinerea)是一种导致草莓、番茄等果蔬采后发生灰霉病的重要植物病原真菌[3]。长期以来,国内外防治果蔬采后灰霉病的主要方法是使用人工合成的化学杀菌剂,其中常用的化学杀菌剂有噻菌灵(triabendazole)、甲基硫菌灵(thiophanate-methyl)、异菌脲(iprodione)等[4]。然而,已有足够的证据显示,化学杀菌剂长期用于果蔬采后抑菌防腐不仅对人体健康造成较大危害,同时也增大了致病微生物产生抗性的潜在风险[5]。大量研究结果表明,某些植物的挥发油(essential oils)能够有效控制果蔬的采后病害,从而降低因使用化学杀菌剂造成的食品安全风险[6]。
柚(Citrusmaxima)是芸香科柑橘属乔木的果实,属于芳香类水果,主要分布于东南亚及我国的长江以南地区。我国是世界上名列第二的柚子种植大国,柚子的种植面积和产量仅次于美国[7]。柚皮占柚子重量的三分之一,食用或加工后产生的大量柚皮不仅污染环境,而且是一种资源浪费[8]。有报道称柚皮提取物对多种植物病原菌有显著的抑菌活性[9],为了更好地开发和利用柚皮这一天然的抑菌物质资源,本研究以果蔬采后重要致病真菌灰葡萄孢菌作为供试靶标,对柚皮挥发油的抑菌活性进行研究,探讨将柚皮挥发油用于果蔬采后抑菌防腐的可能性。
1 仪器与材料
1.1 主要仪器
气相色谱仪(Agilent 7890B具FID检测器,美国Agilent公司);气相色谱-质谱联用仪(Agilent 7890A/5975,美国Agilent公司);HP-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm,美国J&W Scientific 公司);电子分析天平(AL-104型,瑞士Mettler Toledo仪器有限公司);旋转蒸发仪(Buchi R-114,瑞士Buchi公司);低温冷却循环泵(DLS-5L/25,巩义市予华仪器有限责任公司);超声波清洗器(SK8210LHC,上海科导超声仪器有限公司);智能光照培养箱(MGC-300A,上海一恒科技有限公司);电热套;水蒸汽蒸馏装置;微量进样器等。
1.2 试剂
正十三烷、正十六烷、正十八烷(色谱纯,美国Sigma-Aldrich公司);柠檬烯(美国Sigma-Aldrich公司,含量95%)、月桂烯(美国Sigma-Aldrich公司,含量94%);正己烷(分析纯,天津化学试剂有限公司);高纯氦气(纯度99.999%,昆明梅赛尔气体有限公司);葡萄糖(分析纯,国药集团化学试剂有限公司);琼脂粉(分析纯,北京索莱宝科技有限公司)。
1.4 实验材料
实验用柚子为福建平和产琯溪蜜柚,购自昆明市农贸市场,取新鲜柚子将皮剥下备用。本研究使用的灰葡萄孢菌菌种,为云南农业大学云南生物资源保护与利用国家重点实验室保藏菌种。
2 实验方法
2.1 柚皮挥发油提取及密度测定
采用水蒸气同时蒸馏萃取法提取柚皮挥发油。现有研究结果表明[10,11],采用水蒸气蒸馏提取植物挥发油,植物材料与水的料液比大多采用1∶3或1∶4本研究采用1∶3。准确称取新鲜柚皮200 g于提取瓶中,加入600 mL蒸馏水,摇匀。将200 mL正己烷装入溶剂瓶中,分别加热至沸腾,自水和溶剂回流正常开始计时,提取时间为6、8、10和12 h,提取完成后正己烷经无水NaSO4脱水过滤,滤液在40 ℃下减压除去溶剂得到柚皮挥发油,每个实验重复3次,依据3次重复的结果计算平均得率。
准确移取柚皮挥发油1.0 mL于干燥的称量瓶中称重(精确至0.001 g),计算挥发油的密度(g/cm3)。
2.2 柚皮挥发油化学成分的GC-FID分析
色谱柱:HP-5MS 石英毛细管柱(30 m×0.25 mm×0.25 μm,美国J&W Scientific 公司);柱箱温度:初温40 ℃,保持2 min,以5 ℃/min升至250 ℃,保持6 min;进样口温度:230 ℃;检测器温度260 ℃;载气为高纯氦气(纯度99.999%),流量1.0 mL/min;燃气为氢气(纯度99.9%),流量:60 mL/min;助燃气为无水空气,流量:400 mL/min;进样分流比10∶1;进样量1.0 μL,样品浓度1.0 mg/mL(溶剂为正己烷)。
2.3 柚皮挥发油化学成分的GC-MS分析
2.3.1 气相色谱条件
色谱柱:HP-5MS 石英毛细管柱(30 m×0.25 mm×0.25 μm);柱箱温度:初温40 ℃,保持2 min,以5 ℃/min升至250 ℃,保持6 min;进样口温度:230 ℃;载气为高纯氦气(纯度99.999%),流量1.0 mL/min;分流比10∶1,进样量1.0 μL,样品浓度1.0 mg/mL(溶剂为正己烷)。
2.3.2 质谱条件
EI离子源,电离能量:70 eV,扫描范围:50~550 amu,四极杆温度:150 ℃,离子源温度:230 ℃,接口温度:280 ℃,EM电压:1 450 V,溶剂延迟:6 min。
2.4 柚皮挥发油及其主要单体化合物抑菌活性测定
2.4.1 培养基的制备
本研究使用马铃薯葡萄糖琼脂(PDA)培养基(马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 000 mL),高压湿热灭菌(121 ℃,30 min)后备用。
2.4.2 挥发油及其主要单体化合物接触抑菌活性测定
本研究采用Gogolous等[12]的菌丝生长速率法,测定柚皮挥发油及其主要单体化合物的抑菌活性。将柚皮挥发油及其主要单体化合物用适量丙酮溶解,加入与丙酮等量的Tween-80 摇匀后用灭菌蒸馏水配制成系列预浓度的挥发油乳浊液,待PDA培养基冷却至45 ℃时,将挥发油乳浊液加至培养基中(挥发油乳浊液体积与培养基体积比为 1∶9),充分混匀后移入直径为9 cm的培养皿制成含挥发油及其主要单体化合物62.5、125、250、500、1 000、2 000 μg/mL的PDA含药平板,空白对照培养基加入与处理培养基等量的丙酮和Tween-80。
在经7天预培养的病原菌菌落边沿用内径5 mm打孔器制取菌饼后将菌丝面分别接种到含药及对照(含等量溶剂和Tween-80)的PDA培养基平板中心,于25 ℃下黑暗培养1、2、3、4、5和6 天后用十字交叉法分别测量各处理的菌落直径并计算其平均值,依据下列公式计算各处理对病原菌菌丝的生长抑制率,每处理重复3次。
2.4.3 挥发油及其主要单体化合物熏蒸抑菌活性测定
采用Chutia等[13]的培养皿对扣熏蒸法,测定柚皮挥发油及其主要单体化合物的抑菌活性。在经7天预培养的病原菌菌落边沿用内径5mm打孔器制取菌饼后将菌丝面接种到PDA培养基平板中心。在直径40 mm的无菌滤纸片上用微量进样器分别准确滴加浓度为62.5、125、250、500、1 000、2 000 μg/mL的柚皮挥发油及其主要单体化合物(浓度按培养皿对扣的净空体积折算)并置于培养皿盖中,将接种后的PDA培养基平板倒扣在培养皿盖上用帕拉膜(Parafilm)密封后25 ℃下黑暗培养,接种后1、2、3、4、5和6天后用十字交叉法分别测量各处理的菌落直径并计算其平均值,依据上列公式计算各处理的菌丝生长抑制率,每个处理重复3次。
2.5 数据分析
用SPSS17.0数据处理软件对实验数据,结合Student-Newman-Keuls检验进行单向ANOVA分析,评价处理间的差异显著性和重复间的离散度。
3 结果与分析
3.1 柚皮挥发油提取时间与得率
水蒸气蒸馏不同时间提取柚皮挥发油得率和物理性状结果,如表1所示。
试验结果表明,用水蒸气同时蒸馏萃取法提取柚皮挥发油的最佳提取时间为10 h,得率为0.32%(w/w),柚皮挥发油密度为0.66 g/cm3。

表1 不同时间提取柚皮挥发油得率
注:得率为均值±标准差。
Note:Values are mean ± standard deviation (n=3).
3.2 柚皮挥发油化学成分分析
3.2.1 柚皮挥发油化学成分的GC-MS和GC-FID分析
GC-MS 分析结果表明,柚皮挥发油中共有8个主要化学成分,占挥发油总量的99.8%,柚皮挥发油化学成分的总离子流图,详见图1。
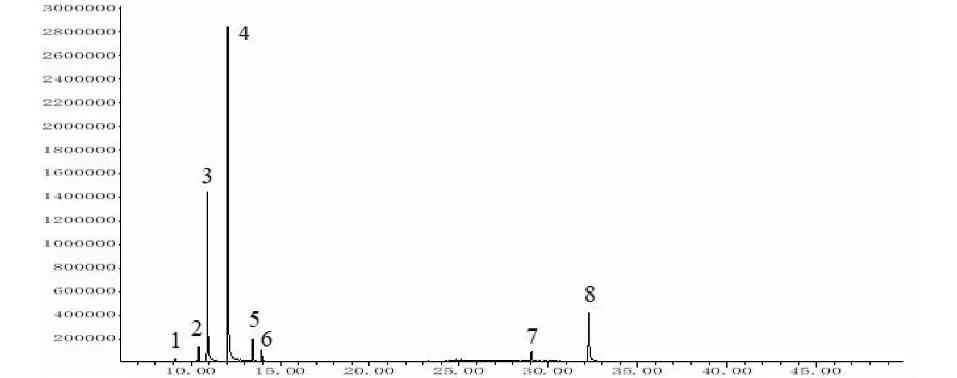
图1 柚皮挥发油GC-MS分析的总离子流图Fig.1 Total ion chromatogram of essential oil from C.maxima peel
通过NIST08质谱谱库检索并结合GC-FID保留指数测定鉴定了柚皮挥发油中8个主要成分的化学结构,柚皮挥发油中所含的8个主要成分的质谱图,如图2所示;主要碎片离子数据,如表2所示。在GC-MS分析同等的色谱分离条件下,以正十三烷(n-octane)、正十六烷(n-hexadecane)和正十八烷(n-octadecane)为基准物质进行柚皮挥发油的GC-FID分析,按8种主要化学成分的保留时间,计算其保留指数。经与相关文献[14-16]中挥发性化学成分的GC-FID保留指数比对,柚皮挥发油中8中化学成分的保留指数分别与相同或相近气相色谱分析条件下3-methyl-apopinene、α-蒎烯(α-pinene)、月桂烯(myrcene)、柠檬烯(limonene)、α-methyl-α-[4-methyl-3-pentenyl]oxiranemethanol、氧化芳樟醇(linalool oxide)、蓝桉醇(globulol)和香柏酮(nootkatone)的保留指数相吻合。挥发油中各个组分的相对含量依据GC-FID的分析结果,采用归一化法按峰面积大小进行定量。柚皮挥发油GC-MS分析和GC-FID保留指数测定的结果,如表3所示。

图2 柚皮挥发油主要成分的质谱图Fig.2 Mass spectra of main chemical compositions in essential oil from C.maxima peel.

表2 柚皮挥发油主要成分的主要碎片离子数据
续表2(Continued Tab.2)

峰号Peak No.化合物Compound主要碎片离子Main fragment ion[m/z (%)]5α-Methyl-α-[4-methyl-3-pentenyl]oxiranemethanol59 (99.9);94 (60.3);43 (52.7);111 (39.8);93 (38.5);55 (36.2);68 (31.8); 67 (25.8);41 (25.6);81 (19.6)6Linalool oxide59 (99.9);43 (66.4);55 (30.2);94 (28.3);68 (26.9);41 (26.2);111 (22.6); 93 (21.5);67 (19.2);81 (16.3)7Globulol43 (99.9);41 (62.3);69 (45.2);81 (43.5);109 (41.2);55 (35.4);95 (34.2);67 (33.3);107 (30.6);93 (30.0)8Nootkatone147 (99.9);121 (77.4);146 (73.5);161 (69.9);41 (68.4);133 (64.5);200 (64.2);203 (59.7);175 (56.7);79 (54.8)
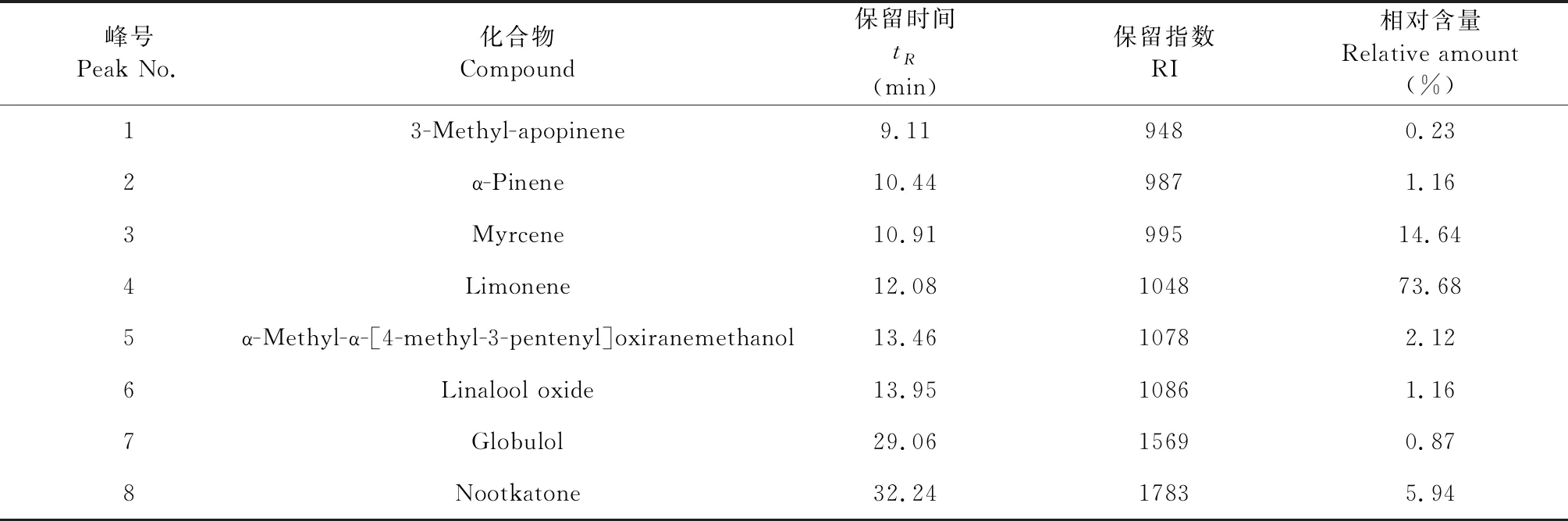
表3 柚皮挥发油的主要化学成分

表4 接种后不同时间柚皮挥发油对灰葡萄孢菌的接触抑菌活性
注:菌丝生长抑制率数值之后为±标准差(三次重复);同列平均值后的字母不同表示经S-N-K检验在P= 0.05水平上差异显著。
Note:Values are mean ± standard deviation (n=3);Means in the same column followed by the different letter were significant different according to S-N-K test atP= 0.05.
3.3 柚皮挥发油的抑菌活性
3.3.1 柚皮挥发油的接触抑菌活性
接种后不同时间柚皮挥发油对灰葡萄孢菌的接触抑菌活性实验结果,如表4所示。
试验结果表明,柚皮挥发油对灰葡萄孢菌的接触抑菌活性与处理剂量成正相关,接种第2天后与时间成负相关,结果见表4。总体来看柚皮挥发油对灰葡萄孢菌的接触抑菌活性较低,活性最高值为接种后第2天的2 000 μg/mL处理,对菌丝生长的抑制率为80.74%,其余处理的活性均低于60%。接种第4天后250 μg/mL及以下处理的抑菌活性与空白对照相比在P<0.05水平上无显著差异。
3.3.2 柚皮挥发油的熏蒸抑菌活性
接种后不同时间柚皮挥发油对灰葡萄孢菌的熏蒸抑菌活性实验结果,如表5所示。

表5 接种后不同时间柚皮挥发油对灰葡萄孢菌的熏蒸抑菌活性
注:菌丝生长抑制率数值之后为±标准差(三次重复);同列平均值后的字母不同表示经S-N-K检验在P=0.05水平上差异显著。下同。
Note:Values are mean ± standard deviation (n=3);Means in the same column followed by the different letter were significant different according to S-N-K test atP= 0.05.The same as below.
试验结果表明,柚皮挥发油对灰葡萄孢菌的熏蒸抑菌活性与处理剂量成正相关,接种第2天后与时间成负相关,结果见表5。总体来看当柚皮挥发油浓度在低于500 μg/mL时抑菌活性不突出,对菌丝生长的抑制率大部分均低于50%,但1 000 μg/mL及以上浓度处理则表现出较好的抑菌活性,2 000 μg/mL处理在接种后不同时间对菌丝生长的抑制率均为100.00%,与其它各处理在P<0.05水平上均差异显著。
3.4 柚皮挥发油中主要单体化合物抑菌活性
柚皮挥发油中两种相对含量较高的化学成分是柠檬烯(73.68%)和月桂烯(14.64%),为明确这两种主要成分的抑菌活性,进行了柠檬烯和月桂烯对灰葡萄孢菌的接触抑菌活性和熏蒸活性的测定。
3.4.1 柠檬烯的接触抑菌活性
接种后不同时间柠檬烯对灰葡萄孢菌的接触抑菌活性实验结果,如表6所示。
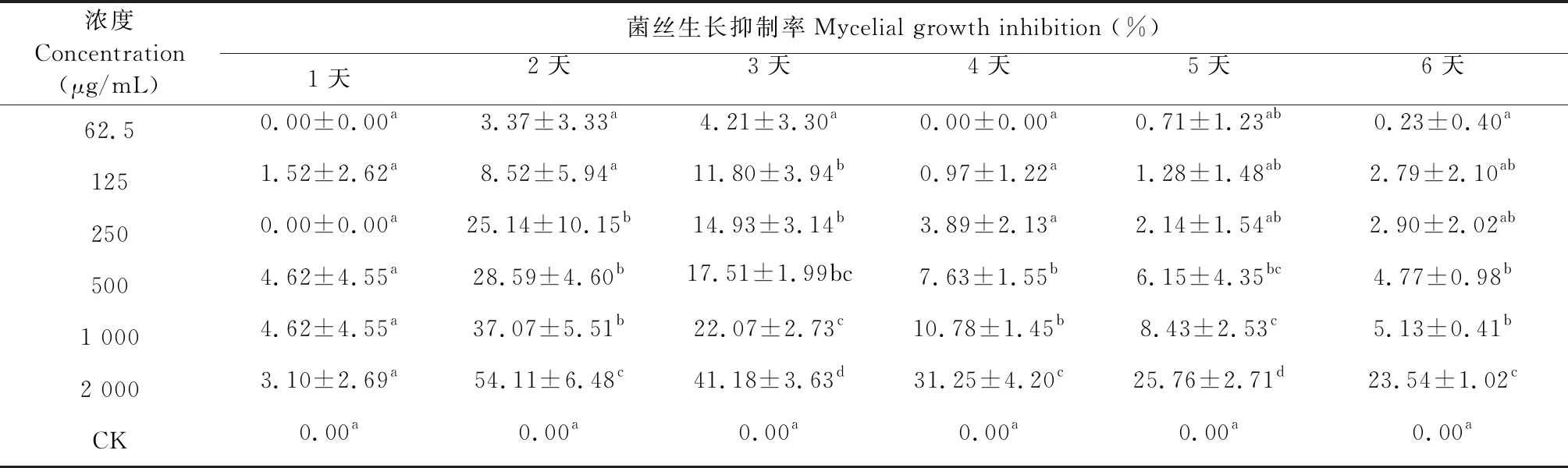
表6 接种后不同时间柠檬烯对灰葡萄孢菌的接触抑菌活性
试验结果表明,柠檬烯对灰葡萄孢菌的接触抑菌活性与处理剂量成正相关,接种第2天后与时间成负相关,结果见表6。总体来看柠檬烯对灰葡萄孢菌的接触抑菌活性较低,活性最高的为接种后第2天的2 000 μg/mL处理,其对菌丝生长的抑制率也仅为54.11%,其余各处理的抑菌活性均低于50%。125 μg/mL及以下处理的抑菌活性与空白对照相比,在P<0.05水平上无显著差异。
3.4.2 柠檬烯的熏蒸抑菌活性
接种后不同时间柠檬烯对灰葡萄孢菌的熏蒸抑菌活性实验结果,如表7所示。
试验结果表明,柠檬烯对灰葡萄孢菌的熏蒸抑菌活性与处理剂量成正相关,接种第2天后与时间成负相关,结果见表7。总体来看当柠檬烯浓度在低于500 μg/mL时抑菌活性较低,对菌丝生长的抑制率大多低于50%。1 000 μg/mL及以上浓度处理则表现出较好的抑菌活性,2 000 μg/mL处理在接种后不同时间的菌丝生长抑制率均为100.00%。各处理的抑菌活性与空白对照相比,在P<0.05水平上均差异显著。
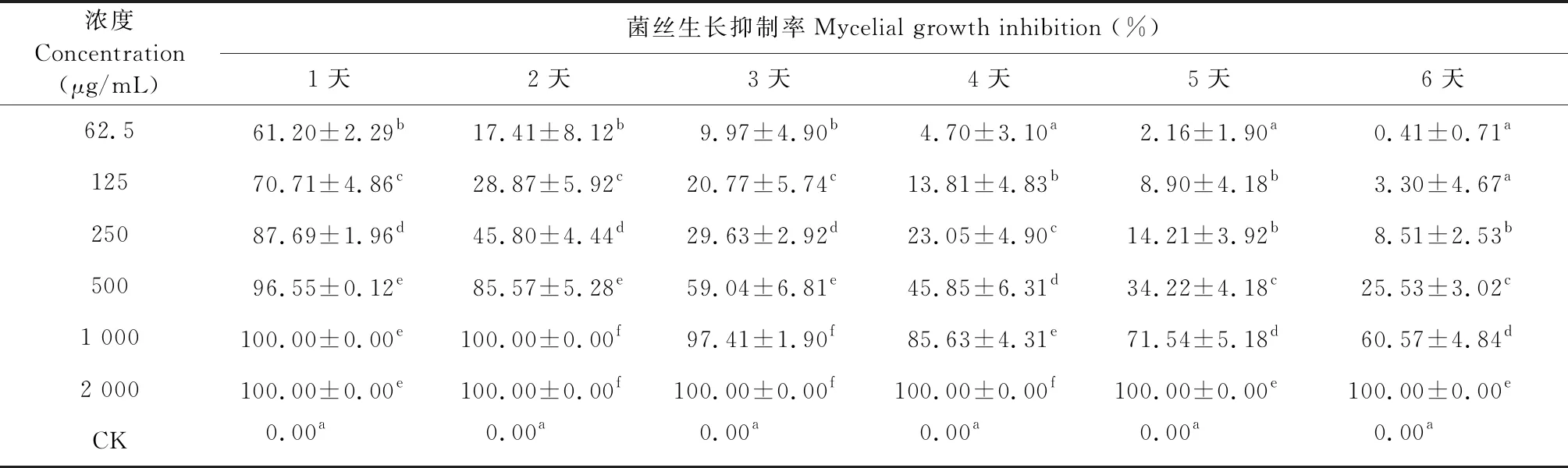
表7 接种后不同时间柠檬烯对灰葡萄孢菌的熏蒸抑菌活性
柠檬烯接触和熏蒸两种不同处理方法对病原菌菌丝生长的抑制活性熏蒸处理的要高于接触处理的抑制活性。
3.4.3 月桂烯的接触抑菌活性
月桂烯对灰葡萄孢菌接种后不同时间的接触抑菌活性实验结果,如表8所示。
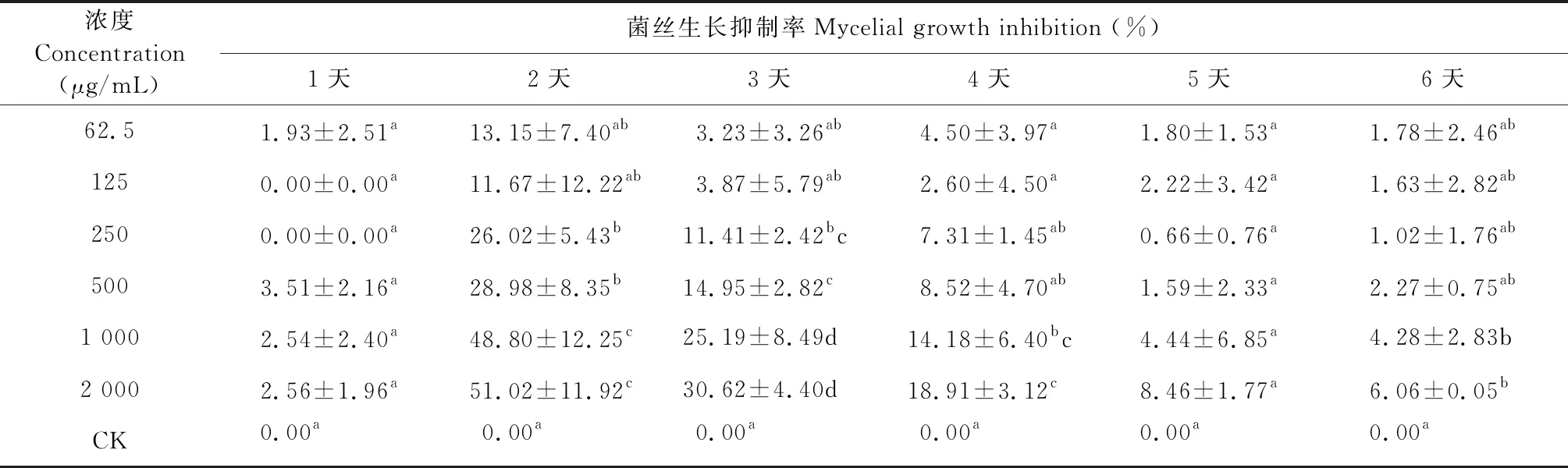
表8 接种后不同时间月桂烯对灰葡萄孢菌的接触抑菌活性
试验结果表明,月桂烯对灰葡萄孢菌的接触抑菌活性与处理剂量成正相关,接种第2天后与时间成负相关。总体来看,月桂烯对灰葡萄孢菌的接触抑菌活性比较低,2 000 μg/mL处理2天时的菌丝生长抑制率也仅为51.02%,其余处理的抑菌率均低于此值。大部分处理的抑菌效果与空白对照相比,在P<0.05水平上均无显著差异。
3.4.4 月桂烯的熏蒸抑菌活性
月桂烯对灰葡萄孢菌接种后不同时间的熏蒸抑菌活性实验结果,如表9所示。

表9 接种后不同时间月桂烯对灰葡萄孢菌的熏蒸抑菌活性
续表9(Continued Tab.9)

浓度Concentration(μg/mL)菌丝生长抑制率Mycelial growth inhibition (%)1天2天3天4天5天6天50082.43±5.09d53.02±2.93e36.01±1.66d27.32±3.46e19.50±3.19d13.58±3.10c1 000100.00±0.00e64.45±2.30f50.38±2.51e38.23±0.99f26.98±2.00e20.75±0.45d2 000100.00±0.00e100.00±0.00g88.84±1.47f80.00±1.23g70.11±1.35f60.79±0.69eCK0.00a0.00a0.00a0.00a0.00a0.00a
试验结果表明,月桂烯对灰葡萄孢菌的熏蒸抑菌活性与处理剂量成正相关,接种第2天后与时间成负相关。总体来看月桂烯浓度在1 000 μg/mL及以下时抑菌活性较低,对菌丝生长的抑制率大多低于50%,62.5与125 μg/mL两个处理间在P<0.05水平上无显著差异,但浓度为2 000 μg/mL的处理则表现出较好的抑菌活性。
4 结论
现有研究结果表明,植物挥发油是一个由多种挥发性化学成分组成的复合体系,其中萜类、酚类、醇类、醛类和芳香化合物是植物挥发油的重要成分。很多单萜(monoterpene)和倍半萜(sesquiterpene)类化合物在植物与病原菌的互作中,具有较强的生物活性和重要的生态功能,其中有的化合物在抑制果蔬采后致病微生物方面具有重要的研究价值。
植物病原菌的侵染和危害,是加速采收后果蔬腐烂最重要的致腐因子,利用植物挥发油进行果蔬采后抑菌防腐,国内外学者做过很多研究[17-19]。Nengguo等[20]认为芸香科有些植物的挥发油能抑制某些果蔬的采后病害。Nengguo等的研究结果表明,柑橘挥发油对水果的重要致病真菌意大利青霉菌(Penicilliumitalicum)和指状青霉菌(P.digitatum)具有显著的抑菌活性。本研究结果表明,柚皮挥发油对果蔬采后重要致病真菌灰葡萄孢菌的菌丝生长具有明显的抑菌活性。柚子与柑橘同为芸香科植物,本研究结果印证了Nengguo Tao等的观点。

图3 柚皮挥发油及其主要化学成分对灰葡萄孢菌处理后6天的熏蒸抑菌效果示意图Fig.3 Antifungal activity of essential oil and its chemical compositions vapour against B.cinerea after 6 days exposure注:A-柚皮挥发油;B-柠檬烯;C-月桂烯。Note:A-Essential oil from C.maxima peel;B-Limonene;C-Myrcene.
本研究结果表明,柚皮挥发油中共有8个主要化学成分,其中含量最高的是柠檬烯天开始,柚皮挥发油和柠檬烯的抑菌效果显著强于月桂烯。柚皮挥发油和柠檬烯1 000 μg/mL处理表现出较好的抑菌活性,2 000 μg/mL处理在接种后不同时间的菌丝生长抑制率均为100.00%,抑菌活性极显著优于同等剂量的月桂烯。因此,可以推测柠檬烯是柚皮挥发油中的主要抑菌活性成分。柚皮挥发油、柠檬烯和月桂烯1 000 μg/mL接种后6天对灰葡萄孢菌的抑菌活性结果,如图3所示。
用同一种有抑菌活性的挥发性化学成分熏蒸和接触处理靶标病原菌,不同处理方式间的抑菌活性可能会有较大差异[10],本研究的结果也证明了这种现象。柚皮挥发油在同等剂量下接触和熏蒸处理灰葡萄孢菌,其抑菌活性表现出很大差异,熏蒸处理的抑菌活性显著高于接触处理,且各处理的抑菌活性与处理时间成反比(图4)。关于同等用药剂量下为什么熏蒸处理的抑菌活性远高于接触处理,笔者认为熏蒸处理挥发性抑菌活性成分通过空气与菌体全方位接触,使药效得到充分发挥,而接触处理菌体仅有接触培养基的部分才能受药,药效不能得到充分发挥。由于两种给药处理方法病原菌受药的面积相差较大,从而导致抑菌活性出现较大差异。

图4 柚皮挥发油不同处理方法对灰葡萄孢菌的熏蒸抑菌效果(1 000 μg/mL)Fig.4 Antifungal activity of essential oil with different treatment methods against B.cinereaafter 6 days exposure (1 000 μg/mL)
综上所述,柚皮挥发油对灰葡萄孢菌具有显著的抑菌活性,其主要化学成分是柠檬烯和月桂烯等8种挥发性有机化合物,其中含量最高的是柠檬烯(73.68%)和月桂烯(14.64%)。根据本研究的结果推测,柠檬烯是柚皮挥发油的主要抑菌活性成分。柚皮挥发油和柠檬烯单体化合物对灰葡萄孢菌熏蒸处理的抑菌活性显著高于接触处理,且各处理的抑菌活性与处理时间成反比。
致病真菌侵染是导致果蔬采后腐烂的重要因素,探寻可替代化学合成杀菌剂用于果蔬采后抑菌防腐的天然产物,对保障食品安全和公众健康,具有极其重要的意义。我国柚子种植分布广泛种植面积较大,因此柚皮资源丰富。本研究证明在离体条件下,柚皮挥发油对灰葡萄孢菌具有显著的抑菌活性,下一步可在此基础上通过深入研究,探讨柚皮挥发油用于番茄灰霉病等由灰葡萄孢菌所致果蔬采后重要病害防控的可能性。

