正交试验优选脱糖大枣的制备工艺
马宝珠,刘世军,唐志书,李慧,张娱,宋忠兴,崔春利,许洪波,刘红波,张军武,王少程
(陕西中医药大学/陕西省中药资源产业化协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西省创新药物研究中心,陕西 咸阳 712083)
大枣为鼠李科植物枣(Ziziphus jujuba Mill.)的干燥成熟果实[1],在中国已有三千多年的历史。中国各地均有栽培,世界上90%以上的大枣都产自中国[2]。虽然我国有着丰富的大枣资源,但大枣的深加工系列产品缺乏,使大枣产量和果农的经济收入不成比例。
随着社会的发展,我国糖尿病人急剧增长,加上人们对自我身材完美的追求,“戒糖”这个概念逐渐渗透到人们的日常饮食中,而大枣含糖量高达50 %~80 %[2],让人望而生畏。“糖”已经让人变得恐惧起来。
实验采用L9(34)正交试验法来优化大枣醇提工艺,在降低大枣中单糖的同时,最大化的保留大枣中的其它活性成分,让人们能够食用到含糖量低而又更健康的脱糖大枣,也为大枣的进一步深加工提供实验依据。
1 仪器与试剂
1.1 仪器
电热鼓风干燥箱(北京科伟永兴仪器有限公司);高速万能粉碎机(天津鑫博得仪器有限公司);KQ-300DE型数控超生波清洗器(昆山市超声仪器有限公司);UV-2600紫外可见分光光度计(日本岛津);电子分析天平(赛多利斯科仪器有限公司)。
1.2 试剂
葡萄糖(分析纯,天津市大茂化学试剂);氢氧化钠(分析纯,天津市天力化学试剂有限公司);3,5-二硝基水杨酸(化学纯,上海科丰实业有限公司);硫酸(分析纯,成都市科隆化学品有限公司);亚硫酸钠(分析纯,天津市天力化学试剂有限公司);苯酚(分析纯,天津市天力化学试剂有限公司);酒石酸钾钠(分析纯,天津市天力化学试剂有限公司); 无水乙醇(分析纯,安徽安特食品股份有限公司)。
1.3 材料
实验所用大枣为购于咸阳市人人乐超市,为新疆和田大枣。
2 方法和结果
2.1 总糖含量测定方法
2.1.1 总糖标准曲线的绘制 分别精密移取0.2、0.4、0.6、0.8、1.0、1.2 mL的0.1 mg·mL-1葡萄糖溶液于具塞试管中,各加纯化水至2 mL,精密加入6 %苯酚溶液(由80%苯酚现配)1.0 mL,摇匀后立刻加入浓硫酸5.0 mL,常温放置30 min后冰水浴5 min,于490 nm处用紫外可见分光光度计测其吸光度值[3]。空白对照则以2 mL纯化水代替葡萄糖溶液。标准曲线图则以浓度为横坐标,吸光度为纵坐标进行绘制,见图1。回归方程:y = 17.211x - 0.0494; 相关系数:R2= 0.9990。
2.1.2 样品中总糖的测定方法 将样品加纯化水稀释至合适的倍数,于超声波清洗器中超声40 min,即得样品溶液。测定前,将样品溶液摇匀,精密移取2 mL于具塞试管中,加入 6% 的苯酚溶液1 mL,摇匀后立即加入浓硫酸5 mL。常温放置30 min后冰水浴5 min,于490 nm处用紫外可见分光光度计测其吸光度值。空白对照则以2 mL纯化水代替葡萄糖溶液。最后根据“2.1.1”所得的总糖标准曲线线性回归方程求得样品溶液中总糖浓度。
2.2 还原糖含量的测定方法
2.2.1 DNS试剂的配置[4]主要有:
A液:称取6.3 g DNS,21.0 g氢氧化钠充分溶解于400 mL超声脱气后的纯化水中。
B液:称取182.0 g酒石酸钾钠溶解于400 mL脱气后的温水中,再加入5.0 g的苯酚,5.0 g的亚硫酸钠,搅拌使其溶解,并放置至常温。
最后将A液与B液混合均匀,倒入1 000 mL的棕色容量瓶中并定容至刻度线,即为配制好的DNS试剂。将DNS试剂冷藏于冰箱中备用。
2.2.2 还原糖标准曲线的制备[5~7]精密移取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL的1.00 mg·mL-1葡萄糖溶液于25 mL容量瓶中,各加纯化水至2 mL,再精密移取5.0 mL DNS试剂加入容量瓶中。快速摇匀,沸水浴5 min后,立即冷却20 min置于冰水中,最后定容至刻度线,于493 nm处用紫外可见分光光度计测其吸光度。空白对照则以2 mL纯化水代替葡萄糖溶液。标准曲线图则以横坐标为浓度,纵坐标为吸光度进行绘制,见图2。回归方程:y = 31.442x - 0.0759;相关系数:R2= 0.9992。
2.2.3 条件优化 主要有:
(1)显色条件。通过阅读文献发现,苯酚-硫酸法测总糖的方法大都一致,而DNS法测还原糖时,由于DNS试剂的配置比例不同等原因,显色条件也有较大的不同。因此,针对还原糖的测定进行显色条件优化。
(2)最大吸收波长的选择。按照“2.2.2”的测定方法进行,精密移取1.00 mg·mL-1的葡萄糖溶液1 mL于25 mL容量瓶中,加水1 mL,再加5.00 mL DNS试剂,沸水浴3 min,冰水浴20 min,定容至刻度线,于450~1 600 nm波长范围内用紫外可见分光光度计进行光谱扫描。扫描结果见图3。由图可知,波长为493 nm时有最大吸光度,故笔者实验还原糖测定时选用的波长为493 nm。
(3)显色剂用量的选择。在6只25 mL容量瓶中,按照“2.2.2”的测定方法进行,加入1 mg·mL-1的葡萄糖溶液1 mL,DNS溶液加入量依次为2、3、4、5、6、7 mL,沸水浴3 min。结果见图4。由图可知,DNS用量为 4~17 mL时,吸光度趋于稳定,DNS用量为5 mL时,吸光度最大,故选择加入显色剂的用量为 5 mL。
(4)显色反应时间的选择。
在5只25 mL容量瓶中,按照“2.2.2”的测定方法进行,加入1 mg·mL-1的葡萄糖溶液1 mL,DNS溶液5 mL,分别沸水浴3、4、5、6、7 min。结果见图5。由图5可知,显色反应时间为5 min时测定的吸光度最大,故选择显色反应时间为5 min。
2.2.4 方法学考察 主要有:
(1)精密度实验。分别精密移取0.5 mL的1 mg·mL-1葡萄糖溶液于6只25 mL容量瓶,按照还原糖标准曲线测定方法测定吸光度值,测得吸光度分别为0.565、0.573、0.563、0.566、0.572、0.580,RSD=1.11%。结果表明,吸光度无明显变化,说明方法精密度良好。
(2)稳定性实验。分别精密移取0.5 mL的1mg·mL-1葡萄糖溶液于6只25 mL容量瓶,按照还原糖标准曲线测定方法每隔5 min测一次吸光度,连续30 min考察稳定性。测得吸光度分别为0.559、0.573、0.547、0.555、0.564、0.568,RSD=1.67%。结果表明,吸光度值30 min内无明显变化,说明方法稳定性良好。
(3)还原糖加样回收实验。精密移取已知还原糖(大枣粉末还原糖)含量为0.34421 mg·mL-1的样品溶液0.5 mL,按还原糖含量的80 %、100 %、120 %,加入对应葡萄糖浓度的溶液0.5 mL,按照“2.2.2”还原糖标准曲线测定方法的实验方法测定吸光度值,计算回收率,结果见表1。

表1 还原糖加样回收实验
结果显示,还原糖平均加样回收率为101.17%,RSD为4.27 %。符合要求。
2.2.5 样品中还原糖的测定方法 将样品加纯化水稀释至合适的倍数,于超声波清洗器中超声40 min,即得样品溶液。取1 mL样品溶液并加纯化水至2 mL于25 mL容量瓶中。加入5 mL的DNS溶液,摇匀后沸水浴5 min显色,然后冰水浴20 min,再加纯化水定容至刻度线,摇匀,于493 nm处用紫外可见分光光度计测其吸光度。以2 mL纯化水代替样品溶液作空白对照。最后根据“2.2.2”还原糖标准曲线线性回归方程求得样品溶液中还原糖浓度。
2.3 脱糖原理及工艺
大枣中含有单糖(葡萄糖、果糖)、低聚糖和多糖,根据果糖易溶于乙醇,葡萄糖微溶于乙醇,而多糖难溶于醇,故可以利用单糖和多糖在乙醇溶液中的溶解度不同进行简单分离,去除掉单糖部分。
用乙醇溶液对大枣粉末加热回流提取,选取对醇提工艺影响较大的四个因素,乙醇浓度,提取时间,加醇量,提取次数进行单因素考察,最后利用正交试验优选出最佳的提取工艺。
2.4 醇提工艺的优选
2.4.1 大枣吸水率的考察 将大枣清洗、去核、烘干、粉碎并过4号筛,制的大枣粉末备用。
称取50 g大枣粉末3份于烧杯中,加200 mL水,摇匀后浸泡至大枣粉末完全湿润,滤过,测量吸水率[8]。结果见表2。
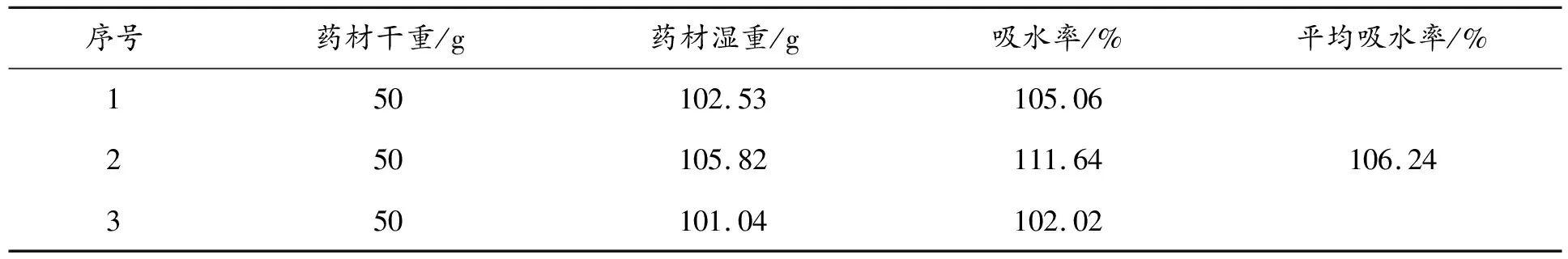
表2 大枣粉末吸水率测定结果
由表2可知,大枣粉末的吸水率为106.24%,约为大枣粉末量的1倍,故在第1次加液体时多加1倍量液体。
2.4.2 醇提工艺的评价指标[9-10]实验对大枣进行醇提主要为了在保留大枣中多糖及低聚糖的同时,脱除掉还原糖。故以多糖及低聚糖含量和还原糖脱除率作为考察醇提效果的两个主要指标,权重系数各为0.4。另外,将枣渣的产率作为次要指标,权重指数占0.2。采用综合加权评分法,对醇提试验进行优选。
多糖及低聚糖含量=(总糖含量-还原糖含量)×100%
还原糖脱除率=
2.4.3 单因素实验 通过阅读大量参考文献得知,对醇提工艺影响较大的四个因素为乙醇浓度,提取时间,加醇量,提取次数[11~12]。对这四个因素分别进行单因素考察,根据综合评分结果,每个因素优选出三个最佳水平。
(1)乙醇浓度的考察。准确称取5份50 g的大枣粉末,根据吸水率为106.24%,故选择加入10倍量的乙醇,乙醇浓度分别为100%、90%、80%、70%、60%,加热回流60 min。滤过,将枣渣晾干,称重。取适量枣渣,加水稀释至合适浓度,测其总糖和还原糖含量。结果见表3。

表3 乙醇浓度对醇提结果的影响
由表3可知,提取时乙醇浓度的不同,醇提效果也有较大的变化。随着醇提浓度的变小,综合评分也变小。当提取时乙醇浓度为60%,不便于抽滤,故没考察其醇提效果。综合考虑,正交试验醇提浓度选择80%、90%、100%这3水平。
(2)提取时间的考察。准确称取5份50 g的大枣粉末,各加入10倍量的无水乙醇,分别加热回流提取20 min、40 min、60 min、80 min、100 min,滤过,将枣渣晾干,称重。取适量枣渣,加水稀释至合适浓度,测其总糖和还原糖含量。结果见表4。

表4 提取时间对醇提结果的影响
由表4可知,提取时醇提时间的变化,对醇提效果有一定的影响。醇提时间为20 min时,醇提效果稍差,醇提时间为40 min、60 min、80 min、100 min时,综合评分相差不大。综合考虑,正交试验醇提时间选择40 min、60 min、80 min这3水平。
(3)加醇量的考察。准确称取5份50 g的大枣粉末,分别加入8、10、12、14、16、18倍量的无水乙醇,加热回流提取60 min,滤过,将枣渣晾干,称重。取适量枣渣,加水稀释至合适浓度,测其总糖和还原糖含量。结果见表5。

表5 加醇量对醇提结果的影响
由表5可知,提取时加醇量的不同,醇提效果也有较大的变化。随着加醇量的变大,综合评分也显著增大。综合考虑,正交试验加醇量选择12倍、14倍、16倍这3水平。
(4)提取次数的考察。根据实际应用及习惯,正交试验醇提次数直接选取1次、2次、3次。
2.4.4 正交实验 根据“2.4.3”的单因素考察结果,设计L9(34)正交试验表[13]。见表6。称取50 g大枣粉末,按正交试验表进行醇提。见表7、表8。
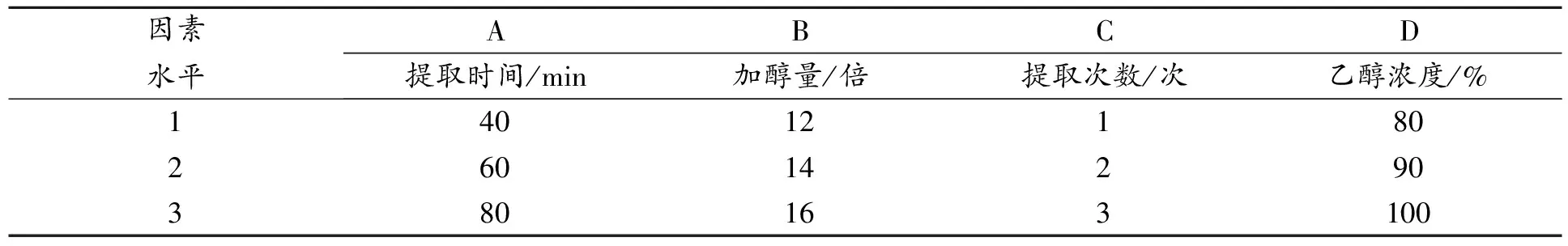
表6 醇提因素水平设计
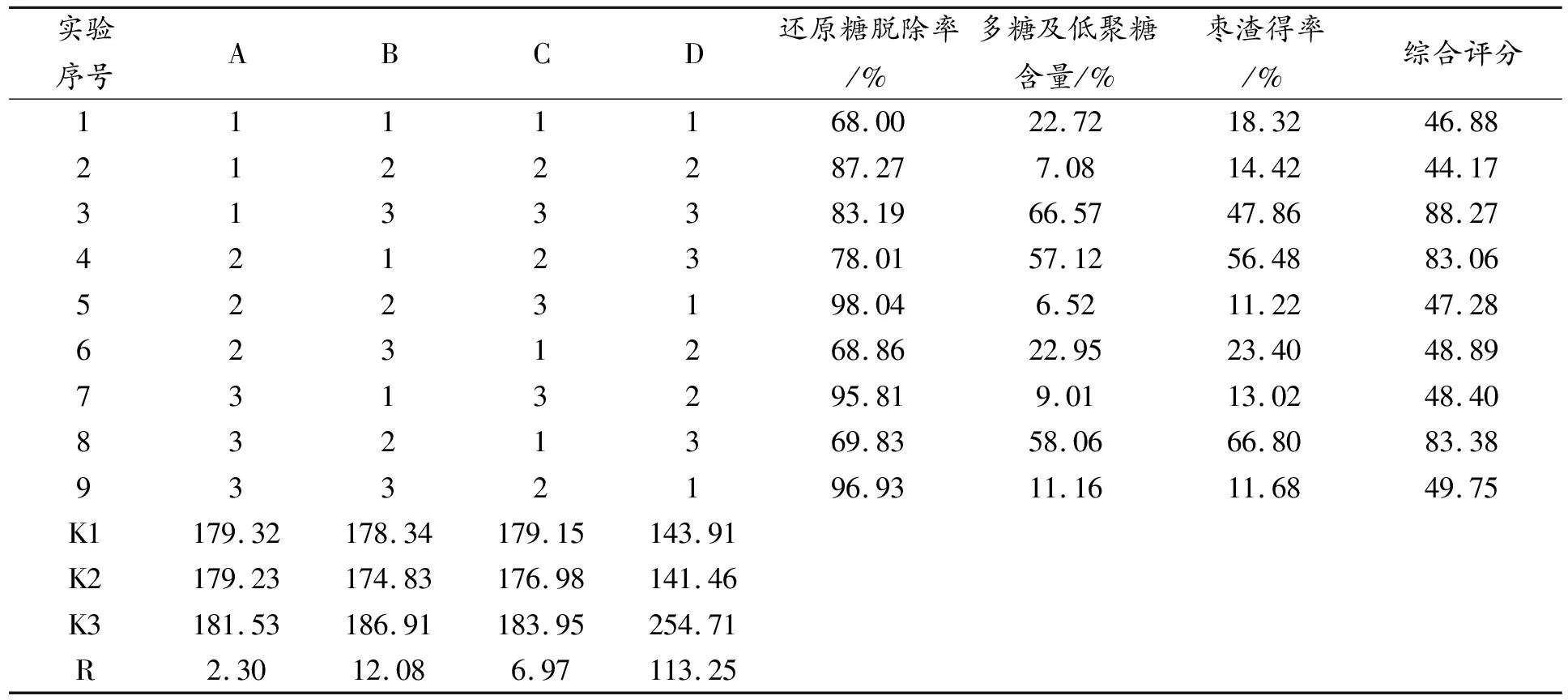
表7 醇提工艺正交试验结果

表8 醇提工艺方差分析
注:F0.05(2,2)=19.00,F0.01(2,2)=99.00
根据对醇提工艺正交试验结果分析发现,4个因素对大枣醇提效果的影响程度为提取浓度(D)>加醇量(B)>提取次数(C)>提取时间(A)。每个因素下,3个水平的影响程度为A3>A1>A2,B3>B1>B2,C3>C1>C2,D3>D1>D2。根据对方差分析发现,乙醇浓度具有极显著性差异,加醇量具有显著性差异。从节约资源、试剂等多方面综合考虑,大枣最佳的醇提工艺为A1B3C1D3,用16倍量的无水乙醇提取1次,每次40 min。
2.4.5 验证实验 准确称取大枣粉末50 g,加16倍量无水乙醇,又根据吸水率为106.24 %,故加850 mL无水乙醇,加热回流提取40 min。将回流液抽滤,取滤饼即枣渣烘干,称重,并取枣渣测其总糖和还原糖。重复三次,结果见表9。

表9 醇提工艺验证试验结果
结果表明,在此最佳工艺条件下,所得到的大枣渣中多糖及低聚糖的含量由原大枣粉末的41.08%升至59.14%,还原糖的脱除率高达70.22%,枣渣的率为68.00%,说明此醇提工艺条件稳定,可靠。
3 讨论
大枣含有单糖,低聚糖和多糖。单糖即还原糖,含量测定采用3,5-二硝基水扬酸法;总糖含量测定采用苯酚-硫酸法;大枣中多糖和低聚糖的含量测定目前都是通过总糖与还原糖含量之差来反映。不同地区,不同品类中枣的还原糖差异较大,牛林茹,李涛等人通过对7种大品类红枣还原糖含量测定后发现还原糖含量占总糖还量的44.9%~74.4%[14]。大枣中的单糖(主要为葡萄糖和果糖[15])对人体不太友善。葡萄糖被人体小肠吸收后容易引起血糖升高,不宜短时间内大量食用;果糖可以转化成为脂肪,是导致人体的肥胖的重要因素。大枣中低聚糖又分为普通低聚糖和功能性低聚糖,功能性低聚糖具有低热量、调节肠胃菌群结构、有利于钙的吸收、降低胆固醇、防止腹泻和便秘等生理作用[16]。但是目前对大枣低聚糖的研究不够深入,具体含量也不得而知,但安晓南发现大枣低聚糖中两种较高的糖为蔗果三糖和蔗果四糖,均不具有还原性[17]。大枣多糖的保肝、抗氧化、抗疲劳、调节机体免疫力等多种作用目前也是毋庸置疑的[18~20]。
采用正交试验优化大枣的醇提工艺,将大枣中的还原糖尽可能多的脱除,最大化地保留大枣中的低聚糖、多糖及其它成分,从而得到适合不同人群的“脱糖大枣”,丰富大枣系列健康产品。

