LED红蓝光对西洋参植株生长、产量和皂苷含量的影响
张玉彬, 刘文科, 杨其长, 邵明杰, 查凌雁, 周成波, 李宝石
(中国农业科学院农业环境与可持续发展研究所,农业农村部设施农业节能与废弃物处理重点实验室,北京 100081)
西洋参(Panaxquinquefolius)是五加科(Araliaceae)多年生草本植物,具有预防癌症、调节免疫系统、增强记忆力等功效。西洋参果实具有抗氧化作用,在保护神经、降低血压以及止吐等方面也具有良好的功效[1]。西洋参的生长环境较苛刻,喜温凉、湿润的环境,当前仅在我国的吉林省、山东省威海市和北京市怀柔区等地有种植,主要有农田、林下和设施等栽培方式。农田和林下种植模式,耗时且劳动密集度大,使得生产成本大幅增加;设施栽培是用遮蔽物覆盖在西洋参的上部来进行遮光,这种栽培方式难以有效调控出适宜西洋参生长的光环境。西洋参的产品外观和质量因产地气候、栽培方式等不同而差别较大[2-3],西洋参种子质量也因此参差不齐,这也影响了西洋参的品质。且野生资源越来越少,已很难通过现有的栽培方式来满足医药市场对于高品质西洋参的需求。
人工光植物工厂可以调控温度、光照、水肥等环境因子,使植物生长不受或很少受自然条件制约,大大提高作物的生产效率[4]。光是影响植物生长器官发育的重要因素,也是植物工厂栽培中重要的环境调控因素。与普通补光方式相比,LED照明的发展更大程度地完善了植物生长的光环境系统[5]。研究表明,在LED光照射下,人参植株的叶绿素含量及总皂苷含量较荧光灯比都会显著增加[6]。且LED光照射可使参根中的蔗糖、香豆酸、香草酸、胆固醇等有效成分显著增加[7-8]。Seong等[9]初步研究发现,LED红蓝光质比例3∶1,光强63.85 μmol·m-2·s-1处理可以促进人参的生长发育。目前国内药用植物的田间生产大多数采用滤光膜或转光膜来实现植物对于不同光质的需求[10],但这很难实现光强和光质比例的精确调控。本研究创新性地以西洋参为例,在环境可控的人工光植物工厂内进行栽培,设置3种LED红蓝光质比例(2R:1B、3R:1B、4R:1B)和2种光强(50和80 μmol·m-2·s-1),以探究人工光植物工厂内多种光环境因子对西洋参生长和品质的影响,为西洋参在人工光植物工厂栽培的光环境调控提供理论基础。
1 材料与方法
1.1 试验材料与试验设计
试验在中国农业科学院农业环境与可持续发展研究所的密闭植物工厂内进行。栽培环境昼/夜温度为(26±1)/(24±1)℃,昼夜相对湿度65%~75%。试验材料为长势一致的2年生西洋参苗,由中国农业科学院特产研究所提供。将西洋参苗随机斜栽于长方形培养槽(57 cm×32 cm×18 cm)内,每槽8株。采用LED红蓝光组合灯板进行光照处理(表1),设置2R:1B(Q2∶1)、3R:1B(Q3∶1)和4R:1B(Q4∶1)3种红蓝光谱组成,50 (I50)和80 μmol·m-2·s-1(I80)2种光强,共6个处理组合。采用LI 1500辐射照度测量仪(LI-COR,USA)标定植株冠层光强,试验过程中,根据参苗的长势调整光强以保障植物冠层所受光强一致。栽培基质为珍珠岩、草炭和蛭石(体积比为 1∶1∶1)的混合物。每周对所有处理喷施2次500 mL营养液及2次200 mL纯水,营养液按照查凌雁等[11]的配方配制。
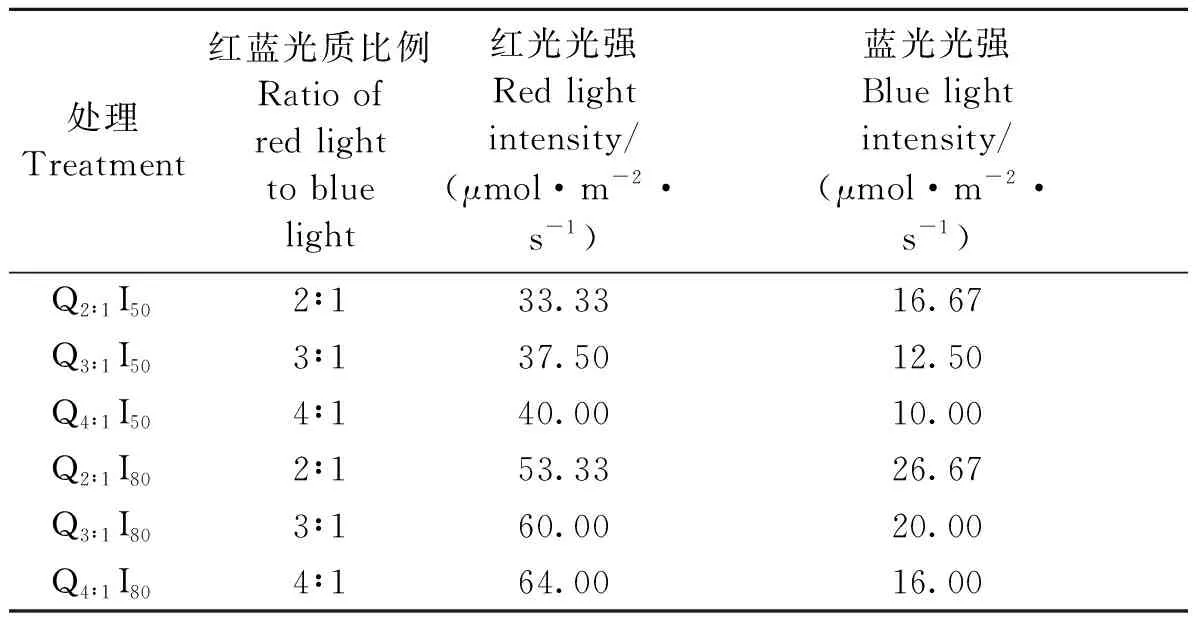
表1 试验中LED光谱参数Table 1 LED spectral parameters
1.2 测定指标及方法
西洋参收获时,每个处理随机取4株植株,将地上部分放入烘箱中,80 ℃烘干至恒重并称取质量。采用计数法测定西洋参果实和种子的数量,并称取质量。采用Li-6400便携式光合仪(Lincoln, NE, USA)在参苗移栽后第60 d,测定植株开花期不同光处理下叶片的净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)以及蒸腾速率(Tr)。西洋参地下部收获后采用冷冻干燥机(Millrock Technology, USA)对其进行脱水处理,先将参根切成1 cm的小段,再用真空冷冻干燥机进行冻干处理[12],冻干结束后立即进行真空包装。并在冻干前后分别称取参根的鲜重和干重。采用香草醛—冰醋酸—高氯酸比色法[13]测定西洋参根中的总皂苷含量。离心提取上清液后,60 ℃下氮吹,加80%甲醇溶液至匀浆状,用100%甲醇定容至1.25 mL,从中移取50 μL,低温挥去溶剂,然后再按照步骤依次操作测定总皂苷含量。
1.3 数据分析
采用Microsoft Excel 2015进行数据整理,SPSS 25.0软件对数据进行差异显著性检验分析(LSD法,α=0.05),用Orgin 9.0进行作图分析。
2 结果与分析
2.1 LED红蓝光处理对西洋参地上干重的影响
不同处理的西洋参地上干重结果(图1)显示,不同LED红蓝光质与光强处理下,西洋参植株地上部的干重均有不同程度的差异,但无显著性差异。其中,Q2∶1I50处理下西洋参地上部干重最大,达到0.81 g,Q3∶1I80处理最小为0.46 g。
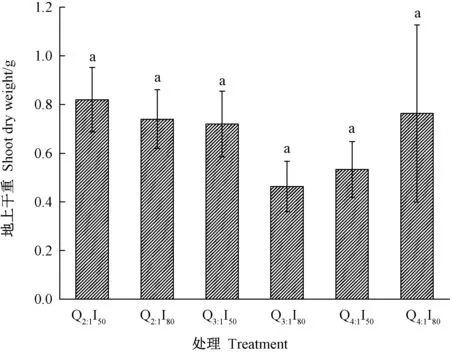
注:不同小写字母表示不同处理间差异在P<0.05水平上具有统计学意义。Note: Different small letters indicate statistically significant difference between different treatments at P<0.05 level.图1 LED红蓝光对西洋参地上干重的影响Fig.1 Effects of LED red and blue light on dry weight of American ginseng
2.2 LED红蓝光对西洋参植株光合特性的影响
由表2可知,不同LED红蓝光照射对西洋参叶片的光合特性有一定影响。西洋参叶片的净光合速率在Q4∶1I50下最低,为1.83 μmol·m-2·s-1;在Q4∶1I80下达到最高,为2.54 μmol·m-2·s-1,二者间差异具有统计学意义。气孔导度、胞间CO2浓度和蒸腾速率各处理间没有显著差异(P>0.05)。I50下,净光合速率、气孔导度、胞间CO2浓度、蒸腾速率均随红光比例的增大呈现先增大后减小的趋势。I80下,西洋参叶片净光合速率随红光比例的增大而逐渐增大,而气孔导度、胞间CO2浓度、蒸腾速率则变化相反。同一光质处理下,I80下的净光合速率略高于I50处理,即西洋参叶片在LED光强为80 μmol·m-2·s-1下具有较高的光合能力。
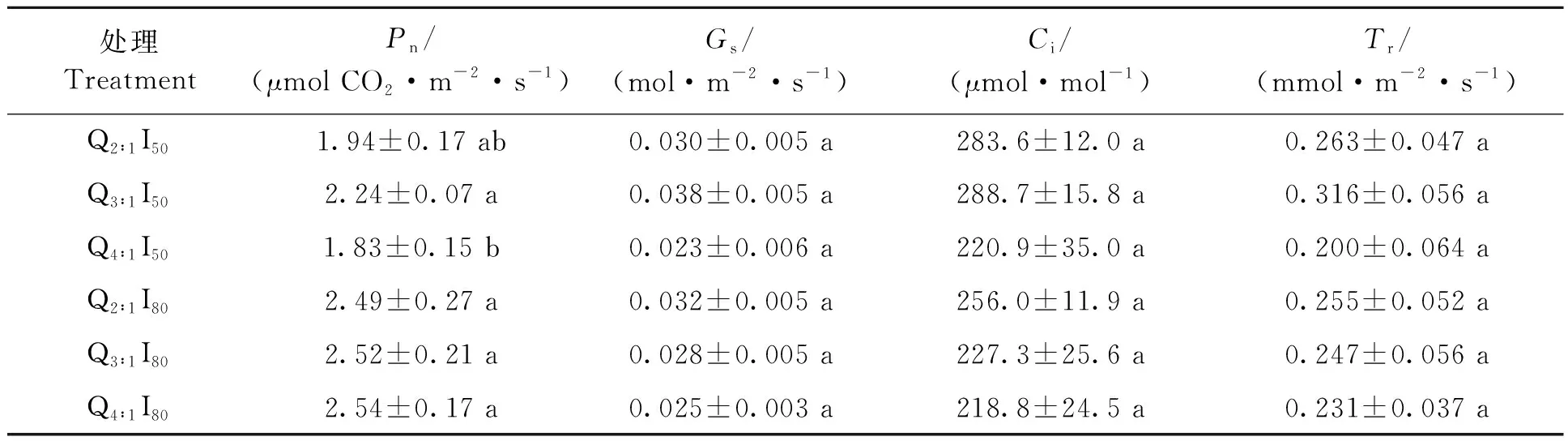
表2 不同处理对西洋参光合特性的影响 Table 2 Effects of different treatments on photosynthetic characteristics of American ginseng
2.3 LED红蓝光处理对西洋参果实和种子产量的影响
由表3可得,不同LED红蓝光照射下,西洋参果实和种子性状均有差异。Q3∶1处理下,I50下的西洋参果实和种子数量显著多于I80处理;Q2∶1和Q4∶1处理下,两种光强处理的果实和种子数量均没有显著差异。Q2∶1处理下,I50的西洋参果实单粒重显著低于I80处理。Q3∶1和Q4∶1处理下,两种光强处理下的西洋参果实单粒重均无显著差异。同一红蓝光质下,不同光强处理下的西洋参种子单粒重均没有显著差异。I50下,Q4∶1的果实和种子数量显著低于Q2∶1和Q3∶1处理,Q2∶1和Q3∶1处理间的果实及种子数量没有显著差异;果实单粒重随红光比例的增大而逐渐增大,Q4∶1时,西洋参种子单粒重最重,为50.4 mg,与Q2∶1和Q3∶1处理存在显著差异。I80下,不同LED红蓝光质处理下的果实、种子数量以及种子单粒重均无显著差异;果实单粒重随红光比例的增大而逐渐减小,Q2∶1时,果实单粒重最重,为270.8 mg。结果表明,Q3∶1I50处理下,西洋参果实和种子数量最多,分别达到17.3和19.7个。Q2∶1I80处理下,西洋参果实单粒重最重,为270.8 mg,Q4∶1I50处理下,西洋参种子单粒重最重,为50.4 mg。
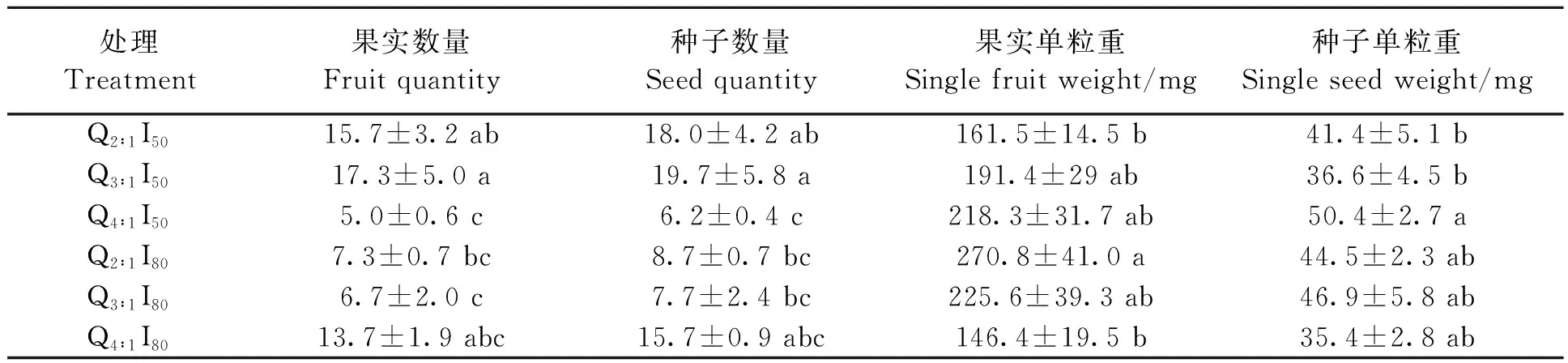
表3 LED红蓝光对西洋参果实和种子性状的影响Table 3 Effects of LED red and blue light on characteristics of fruits and seeds of American ginseng
2.4 LED红蓝光对西洋参根生物量及总皂苷含量的影响
由表4可得,不同LED光处理对西洋参地下部生物量及总皂苷均有一定影响。Q2∶1和Q3∶1处理下,I80的根鲜重和根干重均显著大于I50处理。Q4∶1下,不同光强下的根鲜重、干重无显著差异,I50处理的总皂苷含量显著低于I80处理。I50下,不同光质处理间的西洋参根鲜、干重无显著差异;西洋参总皂苷含量随着蓝光比例的降低而逐渐降低。I80下,西洋参根鲜重、根干重随LED红光比例的增大而逐渐减小。Q4∶1处理的总皂苷含量最高,为111.9 mg·g-1,且与Q2∶1和Q3∶1处理差异显著。本研究中,Q2∶1I80处理下的西洋参鲜重、干重最大,分别为15.97和4.13 g,Q4∶1I80处理下的西洋参总皂苷含量最高,达到111.9 mg·g-1。
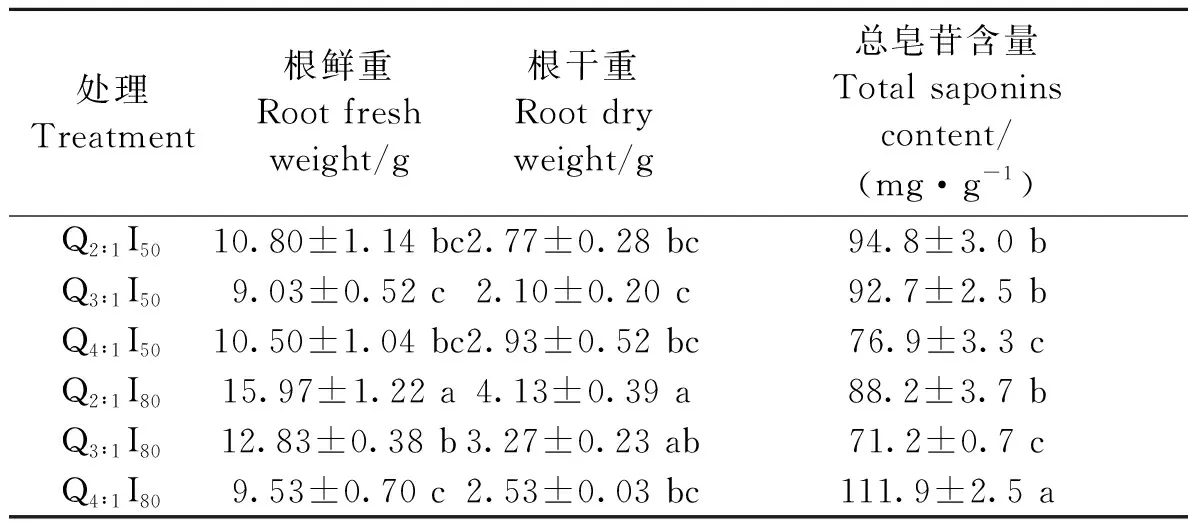
表4 LED红蓝光对西洋参根生物量及总皂苷含量的影响Table 4 Effects of LED red and blue light on root biomass and total saponin content of American ginseng
3 讨论
西洋参产量和品质的提高与生长期间光照条件的改善有关。本研究表明,与50 μmol·m-2·s-1处理相比,西洋参叶片在80 μmol·m-2·s-1下净光合速率更高,这与蔚荣海等[14]的研究结果一致。与弱光相比,强光照射下的叶片光合生产能力更强,促进光合产物积累,可以快速完成个体各器官结构的发育过程,使得高光强下西洋参生长更快。据试验观察,80 μmol·m-2·s-1下生长的西洋参植株比50 μmol·m-2·s-1的西洋参植株早开花1~3 d,在强光下细胞分裂、生长速度增加,这也使高光强下的西洋参植株较低光强的早进入黄叶期1~2 d,这与徐克章等[15]对不同生育期的人参叶片光合特性变化的研究结果一致。本研究中,不同光处理的西洋参叶片的光合特性无显著差异。这是因为植物的光合特性受环境条件的综合作用影响,在不同生育期,光合特性与环境因子间的相互关系也会发生变化。研究发现,北细辛开花期的净光合速率受某些环境因子的直接影响,而在结果期净光合速率则受环境因子协同影响[16]。西洋参与北细辛生长环境类似,其光合作用也可能是在不同的生长期受环境因子影响不同。各处理之间的光合指标无差异,可能是因为处于开花期,受光合效率、Rubisco活性[17]等因素的综合影响。
本研究发现,光强为50 μmol·m-2·s-1时,西洋参总皂苷含量随着蓝光比例的升高而逐渐增加,可能是蓝光比例较高促进了皂苷的生成。一般来说,在适宜药用植物生长的光强范围内,蓝光比例越高,越利于次生代谢物质的合成[10]。光强为80 μmol·m-2·s-1时,西洋参总皂苷含量随着蓝光比例的降低而逐渐升高,这可能是同一红蓝光质比例时,在不同光强下,蓝光比例增大导致西洋参须根数量增多,而须根在西洋参各部位中,皂苷含量最丰富[18],从而导致皂苷整体含量增多,关于总皂苷生成量对于光谱照射的响应机理,有待进一步探究。
综上所述,LED红蓝光的光强不同,红蓝光质比例对西洋参的生长、果实和种子性状及总皂苷含量的影响不同。不同LED红蓝光质比例及光强处理对西洋参叶片的光合特性均无显著影响。红蓝光质比例因照射光强不同对西洋参的影响有差异,低光强的LED红蓝光利于西洋参果实和种子的生长。光强50 μmol·m-2·s-1,红蓝光质比例3∶1是利于西洋参果实和种子生长的适宜条件。高光强的LED红蓝光利于西洋参根的生长,光强80 μmol·m-2·s-1,红蓝光质比例 2∶1 是西洋参根生长的适宜条件。

