5-甲酰四氢叶酸促进水稻幼苗在低氮条件下生长发育的研究
易尘, 张春义, 梁秋菊
(中国农业科学院生物技术研究所,北京 100081)
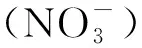
叶酸(维生素B9)属于水溶性B族维生素,是包含四氢叶酸(tetrahydrate,THF)及其衍生物在内的总称。叶酸分子包含三部分:蝶呤环(2-氨基-4-羟基-6-甲基蝶啶)、对氨基苯甲酸(p-aminobenzoate,pABA)和谷氨酸(1~7个)[11]。叶酸作为一碳反应的重要辅因子,在机体细胞内参与一碳单位的转移。不同氧化程度的一碳(one carbon,C1)单位(包括甲基、亚甲基、次甲基、甲酰基,从还原态到氧化态)连接在蝶呤环的N5位或对氨基苯甲酸的N10位,也可桥连在两者之间,构成不同形式的叶酸衍生物。叶酸衍生物通过介导一碳代谢参与了机体内的多种代谢过程,包括嘌呤、胸苷酸、甲硫氨酸、丝氨酸、甘氨酸和泛酸的生物合成及甲基化修饰过程[12-13]。植物中,叶酸被报道参与光呼吸过程、木质素和叶绿素合成及氮代谢过程[14]。
拟南芥叶酰聚谷氨酸合成酶(folylpolyglutamate synthetase,FPGS)功能缺失突变体的氮代谢出现异常。拟南芥基因组编码三个叶酰聚谷氨酸合成酶(folylpolyglutamate synthetase,FPGS),包括质体定位的FPGS1(AtDFB)、线粒体定位的FPGS2(AtDFC)和胞质定位的FPGS3(AtDFD),负责叶酸的聚谷氨酰化[15]。FPGS2功能缺失突变体幼苗在低氮条件下生长发育缓慢,其光呼吸及氮代谢发生异常[16]。相比于野生型,FPGS1功能缺失突变体dfb的种子中氮含量增加,蔗糖和有机酸含量也增加,而游离氨基酸如Asn、Glu及硝酸根含量明显降低;暗培养条件下dfb突变体对低氮胁迫更加敏感,突变体的叶酸和氮代谢物含量都发生明显改变[17]。这些研究表明,植物体内叶酸代谢与氮代谢密切相关。
为进一步探索叶酸代谢与植物氮代谢的作用关系,本研究利用水培的方式在不同氮浓度下培养水稻幼苗,并在培养液中施加5-甲酰四氢叶酸(5-formyltetrahydrofolate, 5-F-THF)分析叶酸在水稻幼苗生长发育中的作用,着重关注在低氮条件下叶酸对水稻幼苗氮代谢的影响,从而为解析叶酸参与植物氮代谢的作用机制提供理论基础,为作物生产中缓解低氮胁迫、提高植物氮利用效率提供新思路。
1 材料与方法
1.1 试验材料
1.1.1水稻材料 野生型水稻日本晴(OryzasativaL.,Japonica)种子由本实验室保存。
1.1.2试剂 叶酸衍生物5-甲基四氢叶酸、5-甲酰四氢叶酸、四氢叶酸、5,10-次甲基四氢叶酸购自瑞典Schircks Lab;4-羟乙基哌嗪乙磺酸、Triton X-100、牛血清白蛋白、水杨酸、咪唑、N-1-萘乙二胺、磺胺、苯甲基磺酰氟、聚乙烯吡咯烷酮、柠檬酸锂、亮肽素、甲基紫精、谷氨酸钠等试剂购自Sigma;Bradford工作液购自Bio-Rad;反转录试剂盒购自Fermentals;RNA提取试剂盒购自原平皓公司;Real-time 试剂购自TaRaKa;引物由华大基因合成。
1.2 培养方法
5-甲酰四氢叶酸粉末用灭菌水配置成10 mmol·L-1母液,-80 ℃存储备用。水稻种子放于水润湿的滤纸上,37 ℃培养2 d;待种子萌发,挑选发芽一致的水稻幼苗移到湿润的蛭石中,转到人工气候室中培养7 d(期间蛭石中只浇水),温室温度设置为30 ℃,16 h光照/8 h黑暗,光照强度为12 000 lx;之后使用含有5-甲酰四氢叶酸(终浓度根据实验分别设置为0、10、50、200、500 μmol·L-1)的1/2 Yoshida营养液[18](除NH4NO3浓度外,其他成分浓度均为标准浓度的一半)进行第一次浇灌,温室继续培养6 d;使用含有5-F-THF(浓度同第一次时)的标准Yoshida营养液[18]进行第二次浇灌,温室中继续培养9 d后收获幼苗,观察表型并检测各项生理指标,对照组材料培养时营养液中不添加5-F-THF。为进一步分析施加外源5-F-THF对水稻幼苗生长发育的影响及作用机制,选用了营养液中NH4NO3提供氮浓度为0.01 mmol·L-1时分别添加浓度为0、50、200 μmol·L-1的5-F-THF和NH4NO3提供氮浓度为2 mmol ·L-1(不添加5-F-THF)四种培养条件,即0.01 N、0.01 N + 50 μmol·L-15-F-THF、0.01 N + 200 μmol·L-15-F-THF、2 N进行水稻培养实验。
标准Yoshida营养液中NH4NO3浓度为1.45 mmol·L-1(即2.9 N)。设计了0.01、0.1、0.3、0.5、1、2、2.9和5.8 N的营养液,在配置中仅调整了Yoshida营养液中NH4NO3的浓度,对应的NH4NO3终浓度分别设置为0.005、0.05、0.15、0.25、0.5、1、1.45 和2.9 mmol·L-1,其他成分不变。
1.3 生理指标检测
1.3.1叶绿素检测 收集100 mg水稻幼苗地上部分,用95%乙醇浸泡2~5 min脱水后,液氮研磨,然后将粉末转移至1 mL 80%的丙酮中,混匀,黑暗下放置30 min;4 ℃ 3 000 r·min-1离心15 min,上清液利用紫外分光光度计(UV1901PC,上海奥析)检测OD663和OD645的吸光值,以80%丙酮作为空白对照,计算叶绿素a(Chla)、叶绿素b(Chlb)及Chla+Chlb含意。
Chla (mg·g-1)=[12.72×OD663-2.59×OD645] ×V/1 000×W
Chlb (mg·g-1)=[22.88×OD645-4.67×OD663] ×V/1 000×W
Chla+Chlb (mg·g-1)=[8.05×OD663+20.29×OD645] ×V/1 000×W
式中,V为上清液体积,mL;W为叶片质量,g。
1.3.2可溶性蛋白检测 可溶性蛋白提取液配置:取2.38 g 4-羟乙基哌嗪乙磺酸(HEPES)溶于100 mL水中,使用 KOH调节 pH至7.5,使用前加体积分数0.1% Triton X-100。
牛血清白蛋白(BSA)标准曲线的设定:10 mL离心管中分别加入BSA标准液(浓度分别为0、0.2、0.4、0.6、0.8、1 mg·mL-1)各100 μL,之后加入至5 mL Bradford工作液中,混匀,静置5 min后测定OD595的吸光值,并绘制标准曲线。
取30 mg水稻样品液氮研磨,粉末迅速加入0.5 mL蛋白提取液,冰上震荡20 min,4 ℃ 12 000 r·min-1离心10 min,取上清100 μL,加入5 mL Bradford进行显色,5 min后测定OD595。根据BSA标准曲线计算蛋白浓度。
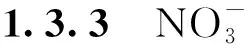
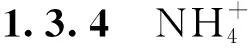
新鲜样品30 mg加入提取液在冰上研磨,4 ℃,12 000 r·min-1离心20 min,将0.2 mL上清转移至5 mL离心管中,先加入2.5 mL显色剂1充分混匀,再加入2.5 mL显色剂2充分混匀,37 ℃下保温20 min,测定OD550,对照组使用0.2 mL去离子水代替0.2 mL上清液。标准曲线通过浓度为50~250 μmol·L-1的NH4Cl溶液绘制[20]。
1.3.5游离氨基酸含量的检测 称量300 mg幼苗,液氮充分研磨成粉末,加入 1 mL 提取缓冲液(80%乙醇),充分混合后10 000 r·min-1离心10 min。将500 μL上清置于低温真空干燥仪(Alpha1-2 LDplus,Christ)中进行干燥,将得到的残基溶解于0.2 mol·L-1的柠檬酸锂溶液中(pH 2.2)。由中国农业科学院饲料研究所利用HPLC法测定游离氨基酸含量。
1.3.8谷氨酰胺合成酶活性检测 30 mg样品液氮研磨成粉,加入1 mL提取液(100 mmol·L-1Tris-HCl,pH7.6,1 mmol·L-1MgCl2,1 mmol·L-1EDTA,10 mmol·L-1β-巯基乙醇),充分混匀后 4 ℃ 12 000 r·min-1离心30 min,向200 μL上清中加入500 μL反应液(75 mmol·L-1咪唑,60 mmol·L-1谷氨酸钠,50 mmol·L-1MgSO4,6 mmol·L-1NH2OH,60 mmol·L-1ATP)和300 μL水, 30 ℃下孵育15 min,加入200 μL酸性FeCl3溶液(88 mmol·L-1FeCl3,670 mmol·L-1HCl, 200 mmol·L-1TCA)终止反应,显色10 min,室温下4 000 r·min-1离心10 min,上清测定OD540吸光值。GS酶活性用每毫克样品每分钟形成的γ-谷氨酰羟肟酸(nmol)表示[16]。
1.3.9谷氨酸合酶活性检测 30 mg样品液氮研磨成粉,加入1 mL提取液 (100 mmol·L-1磷酸钾缓冲液,1.28 mmol·L-1EDTA,10 mmol·L-1β-巯基乙醇),充分混匀后 4 ℃ 12 000 r·min-1离心30 min,向200 μL上清中加入500 μL反应液(200 mmol·L-1磷酸钾缓冲液,20 mmol·L-1Gln,20 mmol·L-1β-酮戊二酸,0.1 mmol·L-1NADH)和200 μL水,30 ℃孵育5 min,加入100 μL 10 mmol·L-1的Na2S2O4(溶解于40 mmol·L-1NaHCO3溶液),30 ℃反应15 min,将温度加热到98 ℃持续5 min,终止反应。取200 μL反应混合物,加入400 μL显色液(80 mg茚三酮溶于4 mL无水乙醇,加入12 μL冰醋酸),400 μL磷酸钾缓冲液(pH 8.04)和1 mL水,100 ℃水浴15 min,冷却至室温后加水稀释至10 mL,测定OD570。GOGAT酶活性用每毫克样品每分钟形成的谷氨酸(nmol)表示[23]。
1.3.10叶酸的提取和检测 叶酸提取液:50 mmol·L-1磷酸钠缓冲液(pH7.0)、1%(质量体积分数)抗坏血酸钠、0.2%(体积分数)β-巯基乙醇,新鲜配置。
水稻叶片液氮研磨后,称取50 mg粉末转移到1.5 mL螺旋帽管中,加入1 mL叶酸提取液,震荡混匀后沸水煮10 min,冰上立即冷却10 min,4 ℃ 13 000 r·min-1离心10 min,取500 μL上清于新的螺帽管中,每管加入35 μL大鼠血清,37 ℃孵育4 h。再次沸水煮10 min,冰上冷却10 min,4 ℃ 13 000 r·min-1离心10 min。取450 μL上清加入3 kD超滤管(UFC5003BK,Millipore)中,4 ℃ 13 000 r·min-1离心20 min,取90 μL超滤后的叶酸溶液加入10 μL MTX(0.2 μg·mL-1,作为内标),由中国农业科学院生物技术研究所公共实验室利用LC-MS/MS(Agilent 1260-6400 QQQ)检测叶酸含量。
1.3.11Real-time PCR检测 使用RNA提取试剂盒提取水稻叶片总RNA,利用反转录试剂盒获得cDNA,利用ABI7500 仪器进行实时定量RT-PCR分析,引物序列如表1所示。反应体系参照SYBR使用说明,反应程序:95 ℃预变性2 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 34 s,40个循环。

表1 实时定量PCR引物序列Table 1 Primers for real time PCR
1.3.12数据分析 每个生理指标的检测进行三次生物学重复,检测结果用三次重复的平均值表示,利用t-test进行数据的差异显著性分析。
2 结果与分析
2.1 不同氮浓度条件下水稻幼苗的生长发育
从图1可以看出,在0.01~2 N条件下,随着营养液中氮浓度的增加水稻幼苗地上部分的长势越好,幼苗地上部长度和鲜重逐渐增加,并在2 N条件下达到最高,然而在2.9和5.8 N条件中水稻幼苗的生长没有进一步提高,幼苗地上部高度和鲜重逐渐降低。在0.01、0.1、0.3、0.5 N条件下观察到水稻幼苗叶片发黄,进一步进行叶绿素含量检测发现随着营养液中氮浓度升高幼苗叶绿素含量逐渐增加。这些结果表明,水稻幼苗的生长发育依赖于培养条件中硝酸根的存在,氮素在2和2.9 N左右时更有利于水稻幼苗的生长,过高的NH4NO3浓度(如5.8 N)反而不利于水稻幼苗的生长。
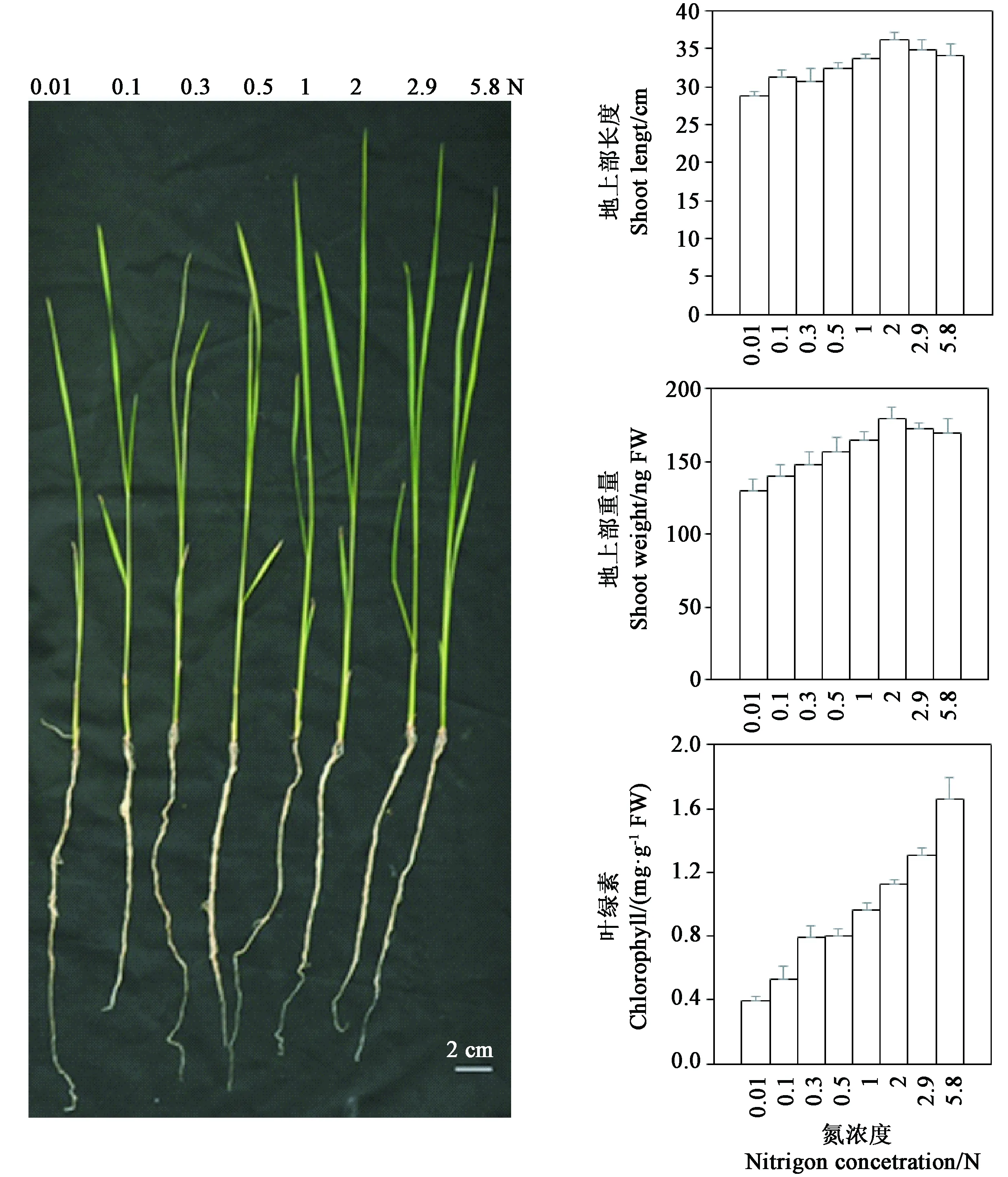
图1 不同氮浓度下水稻幼苗的生长发育Fig.1 Rice seedlings growth in different nitrigon concentration
2.2 施加叶酸对水稻幼苗生长发育的影响
从图2可以看出,在低氮条件(0.01 N)下,施加外源5-F-THF能够促进水稻幼苗的生长,幼苗叶片生长较快。低氮条件下,水稻地上部分的长度、鲜重和第二片叶的叶绿素含量均随着施加5-F-THF浓度的增加而增加,并在外源施加5-F-THF浓度为 200 μmol·L-1时达到最高,在5-F-THF浓度为 500 μmol·L-1又降低。在2 N条件下,当施加10、50 μmol·L-15-F-THF时水稻地上部的长度、鲜重随着叶酸浓度增加而增加,随着5-F-THF 浓度提高到200、500 μmol·L-1时又降低。这些结果表明,无论在氮缺乏或氮充分条件下一定浓度5-F-THF的施加会促进水稻幼苗的生长发育。尤其当培养液中氮素浓度较低时,外源5-F-THF的施加能够缓解水稻幼苗的低氮胁迫现象。
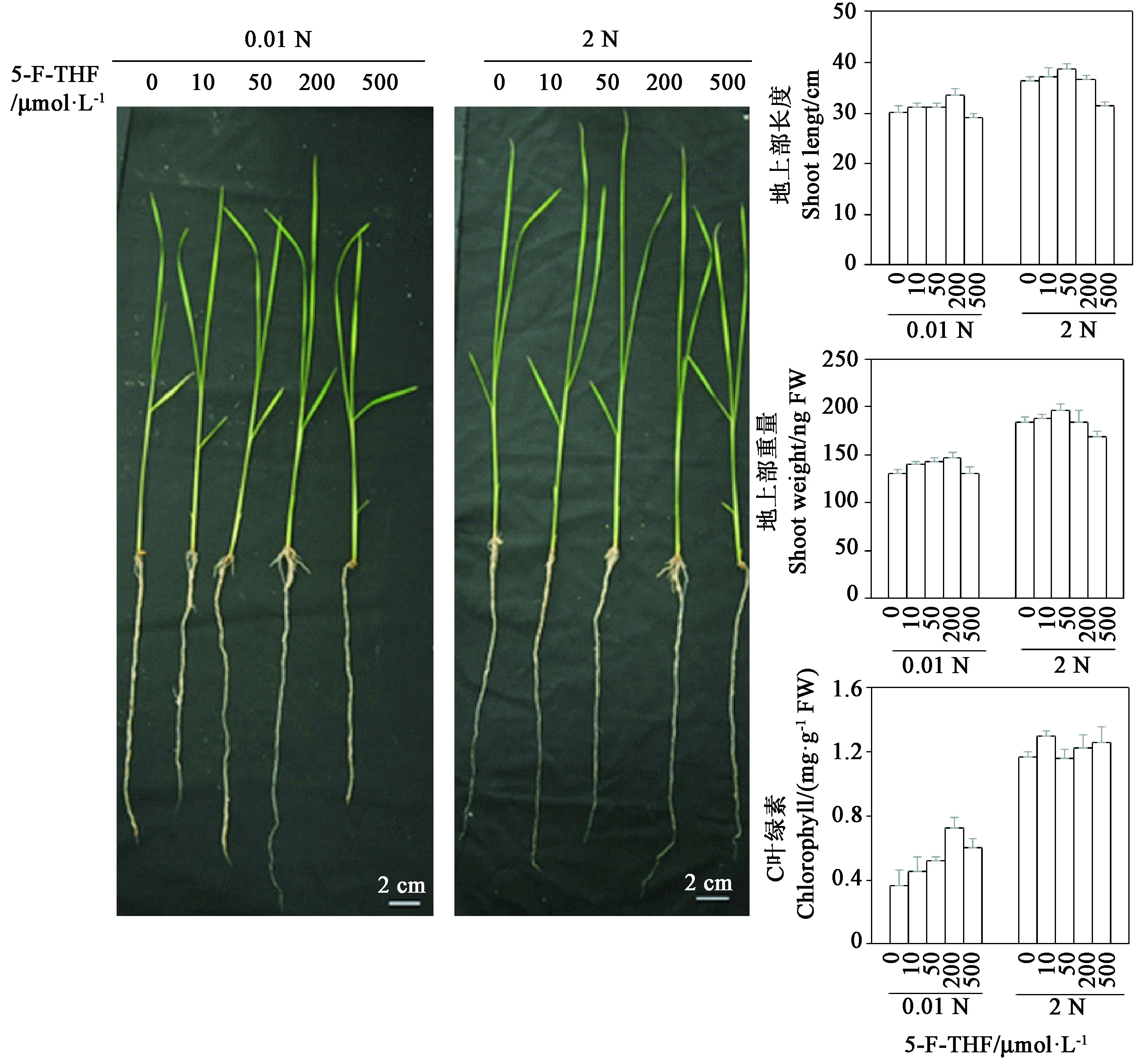
图2 施加不同浓度5-甲酰四氢叶酸时水稻幼苗的生长发育Fig.2 Rice seedlings growth in different folate concentration
2.3 水稻幼苗中叶酸含量的分析
从图3可以看出,在0.01 N条件下,添加50和200 μmol·L-1的5-F-THF,水稻幼苗的叶酸衍生物包括5-F-THF、5,10-次甲四氢叶酸(5,10-CH=THF)、5-甲基四氢叶酸(5-M-THF)、四氢叶酸(THF)含量显著高于未添加时,5-F-THF含量分别为未添加的2.31和5.11倍,5,10-CH=THF含量分别为未添加的4.32和8.42倍,5-M-THF含量分别为未添加的1.28和8.42倍,THF含量分别为未添加的1.59和4.99倍。这表明外源添加的5-F-THF能够被水稻根部吸收,并向叶片运输,同时吸收进入细胞的5-F-THF会转换生成其他形式的叶酸。
在2 N条件下幼苗体内的5-F-THF和5,10-CH=THF含量显著低于0.01 N条件,为0.01 N条件时含量的75%和74%,5-M-THF和THF含量在两种条件中没有显著差异。
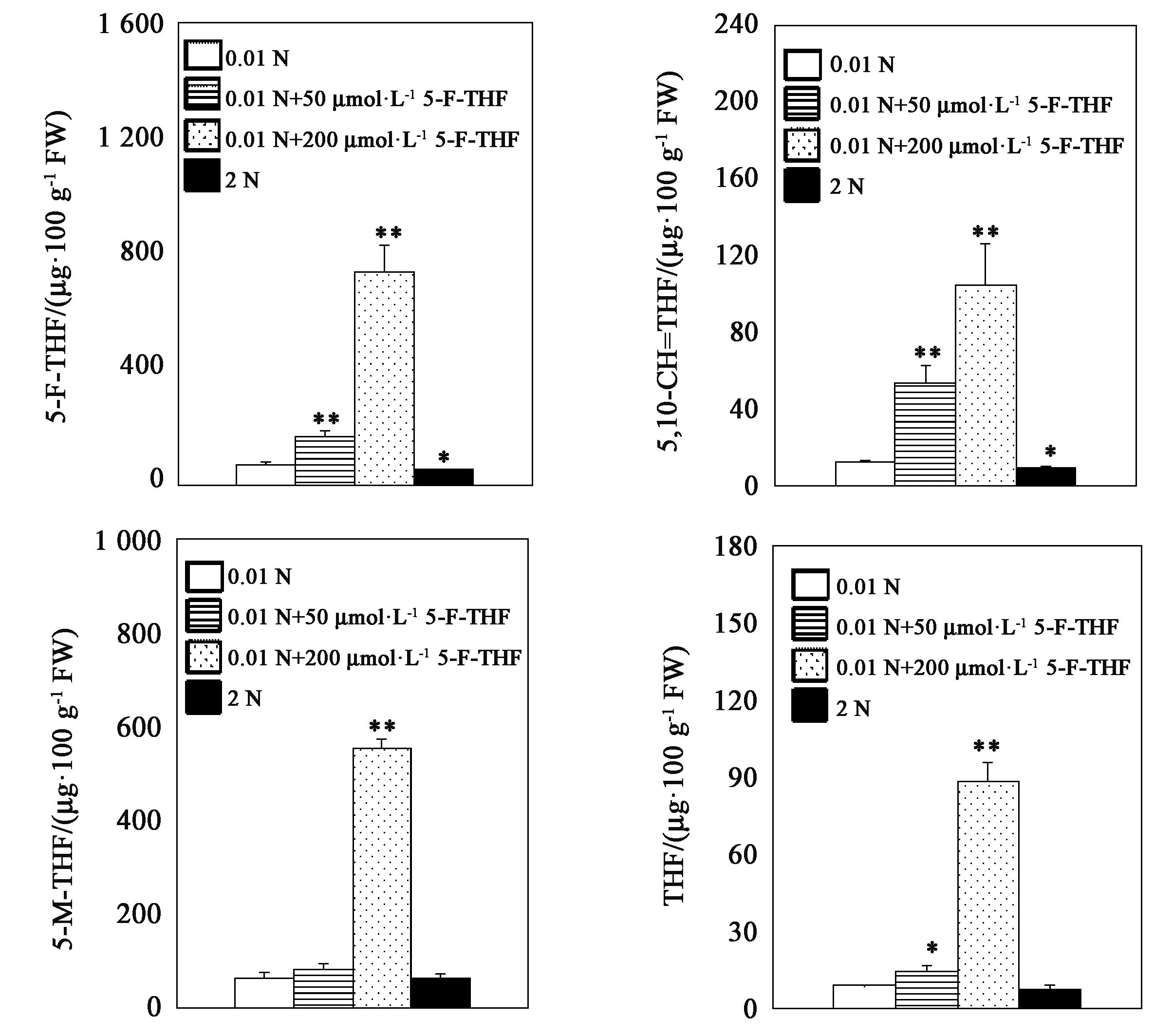
注:*和**分别表示与0.01 N处理相比差异在P<0.05和P<0.01水平具有统计学意义。Note:* and ** indicate significant difference compared with 0.01 N treatment at P<0.05 and P<0.01 levels, respectively.图3 外源添加5-F-THF对水稻幼苗叶酸含量的影响Fig.3 Effects of 5-F-THF on the content of folate in rice seedlings
2.4 水稻幼苗氮代谢相关生理指标的分析
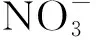
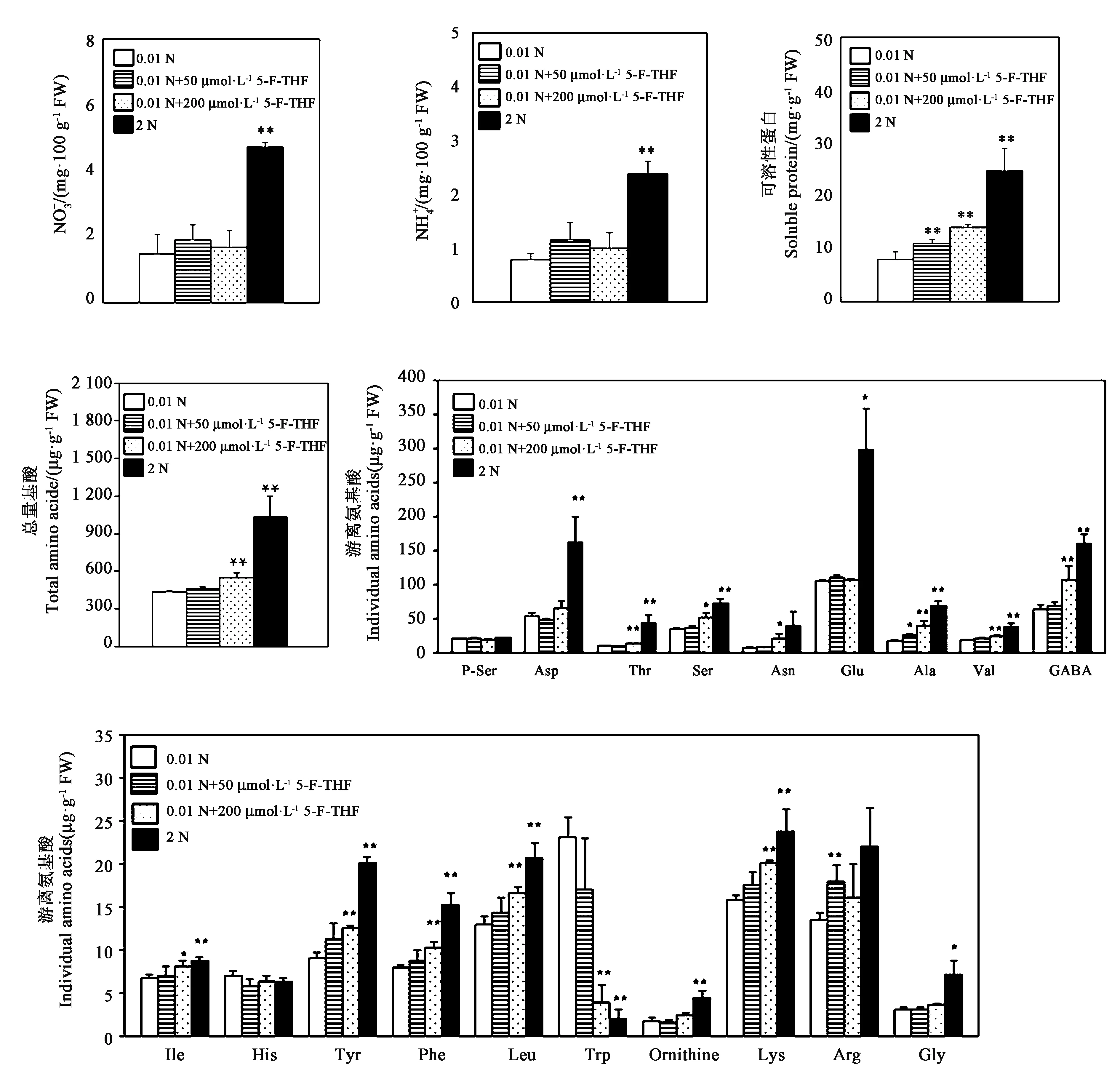
注:*和**分别表示与0.01 N处理相比差异在P<0.05和P<0.01水平具有统计学意义。Note:* and ** indicate significant difference compared with 0.01 N treatment at P<0.05 and P<0.01 levels, respectively.图4 外源添加5-F-THF对水稻幼苗可溶性蛋白和游离氨基酸含量的影响Fig.4 Effects of treatment with 5-F-THF on soluble protein and free amino acid in rice seedlings
2.5 水稻幼苗氮代谢关键酶活性的分析
进一步对参与拟南芥氮代谢的关键酶包括硝酸根还原酶(NR)、亚硝酸根还原酶(NiR)、谷氨酰胺合成酶(GS)和谷氨酸合酶(GOGAT)酶活性进行检测发现, NiR活性在2 N条件下显著低于0.01 N条件下,且在0.01 N条件添加200 μmol·L-15-F-THF时,NiR活性显著降低;GS活性2 N条件下显著高于0.01 N条件,在0.01 N条件外源5-F-THF的添加前后GS活性没有显著变化;0.01 N条件随着外源5-F-THF的添加GOGAT显著增加;NR活性在四种培养条件中没有明显差异(图5)。这些结果表明,外源5-F-THF四氢叶酸添加后,水稻幼苗体内可溶性蛋白的积累增多,幼苗体内GOGAT活性升高,NiR活性降低。
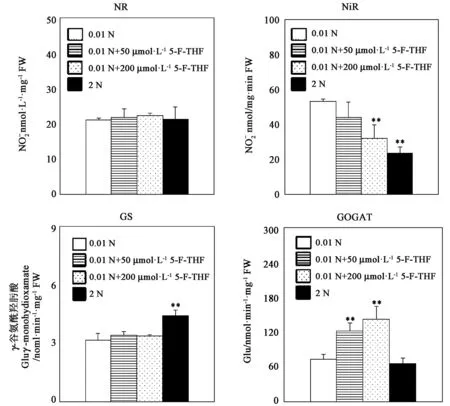
注:** 表示与0.01 N处理相比差异在P<0.01水平具有统计学意义。Note:** indicates significant difference compared with 0.01 N treatment at P<0.01 level.图5 外源添加5-F-THF对水稻幼苗NR、NiR、GS、GOGAT酶活的影响Fig.5 Effects of 5-F-THF on enzymatic activity of NR, NiR, GS, GOGAT in rice seedlings
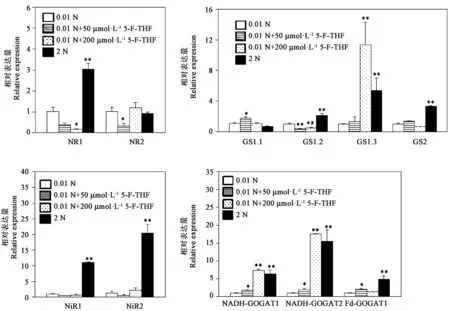
注:*和**分别表示与0.01 N处理相比差异在P<0.05和P<0.01水平差异具有统计学意义。Note:* and ** indicate significant difference compared with 0.01 N treatment at P<0.05 and P<0.01 levels, respectively.图6 外源添加5-F-THF对水稻幼苗NR、NiR、GS、GOGAT基因转录水平的影响Fig.6 Effects of treatment with 5-F-THF on transcriptional expression of NR, NiR, GS, GOGAT in rice seedlings
2.6 水稻幼苗氮代谢相关基因的表达
四种培养条件中水稻幼苗氮代谢相关基因包括硝酸根还原酶(NR)、亚硝酸根还原酶(NiR)、谷氨酰胺合成酶(GS)和谷氨酸合酶(GOGAT)的表达水平如图6所示。2 N条件培养时幼苗体内的NR1、NiR1、NiR2、GS1.2、GS1.3、GS2、NADH依赖的GOGAT1(NADH-GOGAT1、NADH-GOGAT2)和Fd依赖的GOGAT1(Fd-GOGAT1)基因的转录显著高于0.01 N条件,分别为0.01 N条件的3、11、61、2.13、5.37、3.32、6.4、15.57和4.92倍。0.01 N条件添加50 μmol·L-15-F-THF时水稻幼苗的GS1.1、NADH-GOGAT1、NADH-GOGAT2和Fd-GOGAT1基因的转录显著增高,为不添加时的1.73、1.74、1.98和2.03倍;NR1、NR2、GS1.2基因的转录水平显著降低,为不添加时的37%、32%、36%。0.01 N条件添加200 μmol·L-15-F-THF时水稻幼苗的GS1.3、NADH-GOGAT1、NADH-GOGAT2基因的表达水平显著高于0.01 N不添加5-F-THF时,为不添加时的11.32、7.3、17.45倍;NR1、GS1.2转录显著低于未添加时的15%、48%(图6)。这些结果表明,外源5-F-THF的施加后水稻幼苗的NADH-GOGAT1、NADH-GOGAT2基因的转录水平显著提高,这与外源5-F-THF添加后水稻幼苗GOGAT活性增加较为一致。
3 讨论
植物氮代谢包括氮素的吸收转运、还原和同化、再利用、氨基酸合成和代谢、碳氮代谢互作等过程[24-25]。植物氮代谢过程较为复杂,每个环节都可能受到遗传和环境因素的影响。经过几十年的研究,研究者对植物氮代谢过程有了基本认识,但对植物氮代谢调控机制的研究还很缺乏。水稻是世界三大粮食作物之一,水稻产量与世界粮食保障息息相关。近年来,我国科学家发现籼稻品种利用硝酸盐的能力显著高于粳稻品种,并证明水稻编码硝酸盐转运蛋白基因OsNRT1.1B的单碱基突变是导致籼稻和粳稻间氮肥利用效率差异的重要因素[26]。进一步功能研究发现,OsNRT1.1B主要参与水稻对外界硝酸盐刺激的初级应答反应,而OsNRT1.1A则参与水稻对细胞内硝酸盐及铵盐的利用,并发现在低氮条件下过表达OsNRT1.1A能显著提高水稻的氮利用效率和产量[27]。此外发现,水稻G蛋白复合体中的γ亚基编码基因DEP1对氮利用效率具有调控作用[28]。科学家们通过对谷氨酸合成酶突变体suppressor的筛选,发现叶绿体定位的ARE1 对水稻氮素利用效率具有调控作用[29]。这些研究对理解水稻氮代谢调控、提高水稻氮利用效率具有重要意义。
本课题组前期对拟南芥叶酸代谢突变体的研究发现,拟南芥材料叶酸代谢紊乱会引起氮代谢异常。为此推测植物叶酸代谢与氮代谢密切相关。叶酸属于水溶性维生素B9,在机体细胞内主要通过介导一碳代谢转移参与多种代谢途径[14]。本研究在低氮条件下施加外源叶酸培养水稻幼苗的发现,施加叶酸能显著促进低氮条件下水稻的生长发育(图2),初次发现叶酸具有提高水稻应对低氮胁迫、促进水稻生长发育的作用。
外源叶酸的施加显著提高了水稻幼苗体内叶酸含量、可溶性蛋白和游离氨基酸含量(图4),这与之前在拟南芥叶酰聚谷氨酸合成酶突变体dfb、dfc中的研究发现突变体中可溶性蛋白含量和游离氨基酸含量均出现下降的现象较为一致[16-17]。通过对水稻氮代谢关键酶酶学活性发现,施加外源叶酸能促进水稻幼苗体内谷氨酸合酶GOGAT活性的增加、降低幼苗体内亚硝酸根还原酶NiR活性(图5)。基因表达水平分析发现施加外源叶酸后水稻幼苗GOGAT基因表达水平显著上调(图6),推测外源叶酸通过提高GOGAT基因表达水平、促进GOGAT活性的增加进而影响植株的氮代谢。但叶酸作用于谷氨酸合酶GOGAT的分子机制还有待进一步探索。同时发现,低氮条件下水稻幼苗5-F-THF和5,10-CH=THF的含量较高(图3),表明叶酸代谢与植物氮代谢可能存在相互作用关系。上述研究结果将为进一步深入解析叶酸参与植物氮代谢调控的分子机制,为深入理解植物氮代谢调控机制及农业生产中提高作物氮利用效率提供新思路。

