盐胁迫对刺榆种子萌发及幼苗生理特征的影响
杨颖, 王月林, 闫晶秋子, 李钢铁*
(1.内蒙古农业大学沙漠治理学院, 呼和浩特 010018; 2.内蒙古自治区草原工作站, 呼和浩特 010017)
土壤盐渍化对农林业生产和可持续发展造成严重制约,成为当前最突出的生态问题之一[1]。科尔沁沙地在自然因素和人为因素的影响下形成大面积盐碱土。在盐碱土治理方面,国内外许多研究证明,筛选耐盐性品种,利用生物治盐、改盐是盐碱地改良和提高土地利用率的一条有效途径[2-3]。种子萌发阶段是植物对盐胁迫十分敏感的时期,种子能否发芽、发芽率的高低以及发芽速度的快慢决定植物能否在盐碱环境中生存[4]。盐胁迫通常会显著抑制植物种子发芽[5]。但是对一些耐盐植物而言低浓度盐胁迫可以促进种子发芽,高浓度盐胁迫会抑制发芽,并随着胁迫强度的增加抑制作用显著增加,例如栓皮栎[6]、苜蓿[7]、红坚木[8]。部分物种种子在低盐胁迫处理下没有显著影响,但在高浓度盐胁迫下发芽率降低,萌发时间延缓,例如毛红椿和水松等[9],还有部分种子可以在盐胁迫环境中正常生长发育,例如棉花种子在盐胁迫环境下会有浸润作用,可以增强细胞膜的代谢活性,能够提供种子萌发的适宜生长环境[10]。植物幼苗的早期阶段同样容易受到盐胁迫影响[11],对其生理响应的研究可进一步分析盐胁迫机理及植物适应机制[12-13]。对于一些耐盐植物而言,低浓度盐胁迫可以促进其生长,并且每个耐盐指数是正态分布的,会出现低浓度促进和高浓度抑制的现象[14]。植物的耐盐性主要通过避盐性和耐盐性两个方面表现出来,所以目前对植物耐盐机制研究分为以上两个方面进行。植物主要通过稀释盐分、将体内多余盐分分泌出体外、拒绝盐分进入体内的方式来避免盐害;而对盐环境的耐受性主要通过调节细胞渗透势、使离子区室化、保持细胞膜的完整、改变体内代谢方式和保护酶的大量累积来实现。 在不良生境的适应过程中,任何一种植物总是需要与各种耐盐和避盐机制相互配合,它绝不是通过单一机制就可以使植物成功克服盐害的。不同耐盐机制在植物体中的功能各不相同,通过体内不同机制的相互作用从而造就了植物的耐盐性[15]。
刺榆(Hemipteleadavidii)是荨麻目榆科刺榆属植物,为落叶小乔木或呈灌木状[16],为我国珍稀濒危树种。其天然分布区位于内蒙古自治区通辽市科左后旗,作为建群种生长在科尔沁沙地东南缘固定沙地,属于我国新的沙地植被类型[17],也有少量分布于我国东北、华北地区。科尔沁沙地刺榆群落具有温带草原的典型生活型特征[18],与草地相比,刺榆林改善土壤能力及保水能力更强,并且对土壤酸碱度有调节作用[19]。杨允菲等[20]通过对刺榆林地更新与扩展的生物学和生态学机理进行研究,提出果实形态及脱落特性是刺榆在科尔沁沙地局域能形成优势种林,而在其他地理分布区仅为伴生种的生物学根源。刺榆不仅可以作为生物围栏和固沙树种[21],还具有很高的药用价值[22]。可见,刺榆不仅具有经济价值,同时也具有十分重要的生态价值。刺榆主要以种子繁育为主,但刺榆种子极易丧失发芽能力,11月中下旬采集种子, 翌年7月份进行发芽试验,种子发芽率为0[23]。因此,如何扩大刺榆的分布区域应作为这一领域研究和工作的重心。目前对刺榆的研究多集中在其生态作用及药用价值研究,而对盐胁迫环境下刺榆的生理响应与种子萌发特性研究较少。
为了保护和开发利用好刺榆这一种质资源,本研究以刺榆种子为试验材料,研究不同种类和浓度的盐胁迫对其种子萌发和幼苗生理生化特征的影响,探索刺榆在种子萌发和幼苗阶段对不同种类盐胁迫的耐受阈值,最大程度地发挥刺榆的生态效益及经济效益,为下一步模拟生态环境的胁迫处理提供一定的试验基础,并为盐碱地区防风固沙品种的选择提供实践指导。
1 材料与方法
1.1 试验材料
试验所用种子于2017年11月中旬采自内蒙古通辽市科尔沁左翼后旗中部吉日嘎郎镇(N43°18′,E123°00′)。所采集种子置于干燥通风处阴干,筛选饱满且无病虫害的种子备用。种子千粒重为4.56 g。种子表面均使用75%酒精消毒2 min,再用蒸馏水冲洗2~3次。
1.2 试验方法
利用培养皿进行种子萌发试验。每个培养皿中铺入2层滤纸做培养床,加入3 mL不同种类和浓度的盐溶液,以蒸馏水作为对照(CK),加入溶液以能浸透双层滤纸并稍有盈余为准[14]。每个处理设置5个重复,每个重复50粒种子。每天加入等量蒸馏水以始终保持滤纸湿润,并统计种子萌发情况,当胚根突破种皮达种子长度的一半计为萌发[24]。
利用盆栽法进行育苗试验。将种子播种于盛有河沙的育苗钵中,以1/2 Hoagland营养液浇灌。待幼苗萌发4周后通过每天递增20 mmol·L-1盐浓度方式处理,避免盐冲击效应。其中对照组浇灌等量蒸馏水。在达到盐溶液最终浓度后,浇灌终浓度足量盐溶液,冲洗盆中残留盐分使基质盐浓度小幅度波动。期间采用称重法保证土壤含水量,及时补充育苗钵内损失的水分。盐处理7 d后选取长势相同幼苗进行随机取样。
用于测试的盐为NaCl、Na2SO4、NaHCO3和Na2CO3,均为分析纯,购自天津市致远化学试剂有限公司。4种盐的浓度设置见表1。

表1 试验设置Table 1 Test designation
1.3 指标测定
丙二醛(malondialdehyde,MDA)含量测定采用硫代巴比妥酸法[25],过氧化氢酶(catalase,CAT)活性测定采用紫外吸收法[25],过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法[25],超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用NBT还原法[25]。
发芽率、发芽势、发芽指数、活力指数和相对盐害率的计算公式如下。
发芽率(G)=m/N×100%
式中,m为发芽试验结束后种子发芽数,N为供试种子数。
发芽势(Gr)=n/N×100%
式中,n为发芽高峰期种子发芽数,N为供试种子数。
发芽指数(Gi)=∑Gt/Dt
式中,Gt为在t日内发芽数,Dt为发芽日数。
活力指数(Vi)=S×Gi
式中,S为种苗生长量,Gi为发芽指数。
相对盐害率=(对照萌发率-处理萌发率)/对照萌发率×100%
1.4 数据处理
数据统计分析用 Microsoft Excel 2007进行,用SPSS 20.0对各种处理下的指标进行差异显著性分析。
2 结果与分析
2.1 盐胁迫对刺榆种子萌发的影响
2.1.1盐胁迫对刺榆种子萌发率的影响 不同胁迫处理下刺榆种子萌发率结果(表2)可知,在不同浓度4种盐胁迫下刺榆种子均能萌发。当NaCl、Na2SO4、NaHCO3和Na2CO3盐浓度均在试验设置最低浓度时刺榆种子萌发率最大,分别为70.09%、68.40%、58.82%和65.20%,其中NaCl和Na2SO4处理与对照无显著变化,而Na2CO3和NaHCO3处理显著低于对照。种子萌发率随盐浓度的继续增加而持续降低。除100 mmol·L-1NaCl处理与70 mmol·L-1NaCl、15 mmol·L-1Na2CO3处理与10 mmol·L-1NaCl处理差异不显著外,其他浓度处理间均差异显著。说明刺榆种子萌发率对低浓度(10 mmol·L-1)碱性盐(Na2CO3和NaHCO3)表现较为敏感,低浓度(10 mmol·L-1)中性盐(NaCl和Na2SO4)并不影响种子萌发率,100 mmol·L-1NaCl处理种子萌发率为15.2%,相同浓度Na2SO4处理刺榆种子已经不能萌发而未做记录,50 mmol·L-1Na2SO4种子萌发率为33.20%,说明高盐胁迫下摩尔浓度相同时,Na2SO4对刺榆种子萌发影响较大;Na+浓度相同时,相较于Na2SO4,NaCl对刺榆种子萌发的影响更显著。
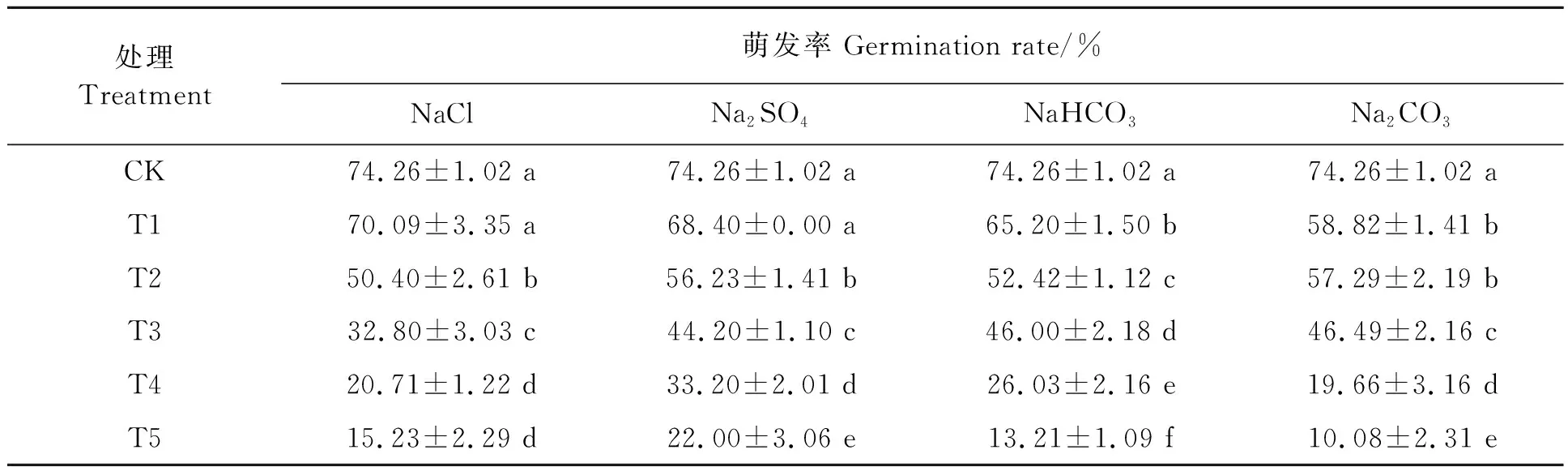
表2 盐胁迫对刺榆种子萌发率的影响Table 2 Effects of salt stress on germination rate of H. davidii seeds
2.1.2盐胁迫对刺榆种子发芽势的影响 不同种类和浓度的盐胁迫对刺榆种子的发芽势结果(表3)可见,在盐浓度为10 mmol·L-1时,NaCl、Na2SO4、NaHCO3和Na2CO34种盐胁迫下刺榆种子的发芽势分别为29.12%、28.40%、28.02%和23.62%,均与对照不存在显著差异。其余盐浓度胁迫下,刺榆种子发芽势均显著低于对照,并随盐浓度增加而降低。这表明刺榆种子对渗透胁迫具有一定的抵抗能力,在低浓度(10 mmol·L-1)的盐土中能够正常发芽出苗也相对整齐,在高浓度的盐土中,刺榆种子虽能萌发,但出苗不整齐。相同摩尔浓度之间比较,Na2CO3胁迫对其影响最为显著。
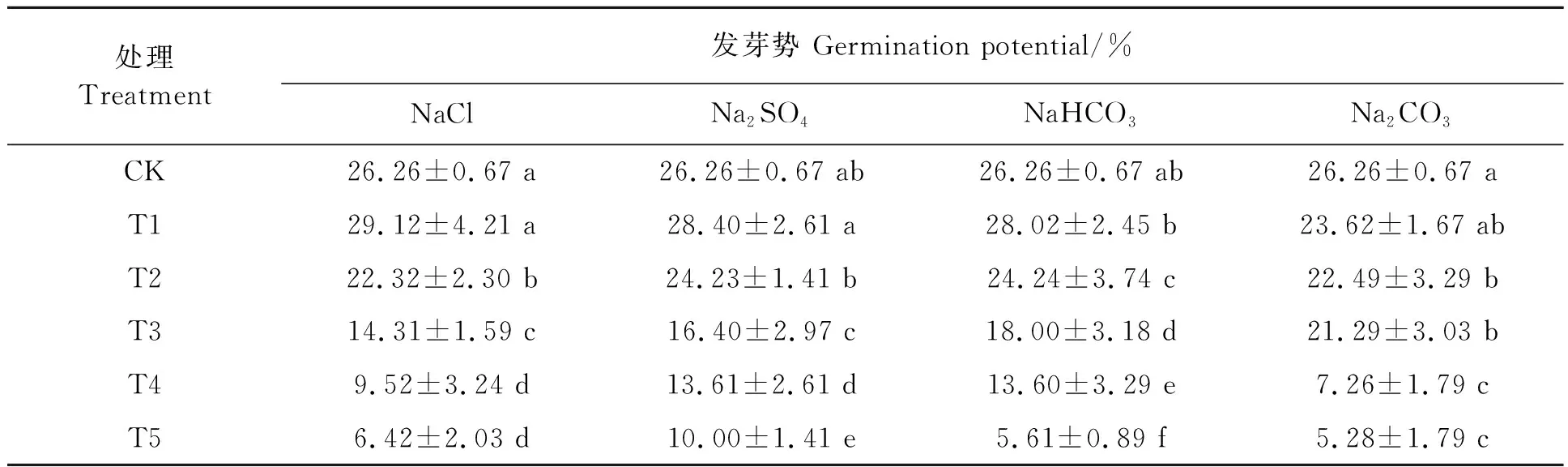
表3 盐胁迫对刺榆种子发芽势的影响Table 3 Effects of salt stress on seed germination potential of H. davidii seeds
2.1.3盐胁迫对刺榆种子发芽指数与活力指数的影响 由表4可知,刺榆种子的发芽指数与活力指数均受到盐胁迫影响,随盐浓度增加而降低。在盐浓度为10 mmol·L-1时,NaCl胁迫发芽指数为5.47,Na2SO4胁迫发芽指数为5.69,两种盐胁迫

表4 盐胁迫对刺榆种子发芽指数和活力指数的影响Table 4 Effects of salt stress on germination index and vigor index of H. davidii seeds
与对照存在显著差异,NaHCO3胁迫发芽指数为5.18,Na2CO3胁迫发芽指数为4.63,两种盐胁迫与对照差异不显著。中性盐在低浓度处的发芽指数表现出增效效应,而碱性盐中不存在这种效应。而后发芽指数随盐浓度的增加迅速下降。因此刺榆种子在低浓度中性盐溶液下的萌发指数超过碱性盐溶液。活力指数中,4种盐胁迫处理均与对照存在显著差异。说明碱性盐溶液在低浓度处虽然可以萌发,但对刺榆幼苗生长已产生抑制作用,Na2CO3作用最为显著,在该浓度下,种子发芽质量显著降低。试验中观察发现,盐胁迫会使种子萌发后出现萎缩、变黄等现象,而浓度增加后部分幼苗死亡。
2.2 盐胁迫对刺榆种子相对盐害率的影响
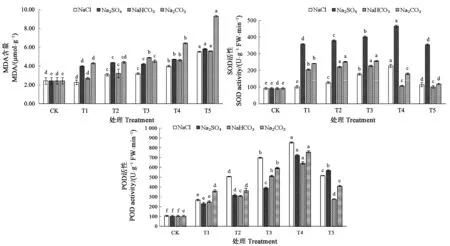
相对盐害率用来反映种子萌发期盐胁迫对种子的伤害程度[26]。由图1可知,刺榆种子相对盐害率随着盐浓度的增加呈上升趋势,并存在显著性差异,这说明4种盐均显著抑制刺榆种子萌发,其中Na2CO3胁迫对刺榆种子的萌发抑制作用最明显,NaCl胁迫对刺榆种子的伤害作用最小,不同盐分对刺榆种子萌发的抑制程度表现为NaCl 图1 盐胁迫对刺榆种子相对盐害率的影响Fig.1 Effects of salt stress on relative salt damage rate of H. davidii seeds注:同种盐分的小写字母表示不同浓度处理间差异在P<0.05水平具有统计学意义。Note:Different small letters of the same salt indicate significant difference among different concentration treatments at P<0.05 level. 4种盐不同浓度胁迫处理的刺榆幼苗MDA含量结果(图2)可知,随着盐浓度的增加,刺榆幼苗MDA含量均有不同程度的增加。其中,在盐浓度为10 mmol·L-1时,NaCl与NaHCO3处理叶片中MDA含量与对照无显著性差异,其他处理间均差异显著。Na2CO3处理与对照组在各个浓度处理均差异显著。在4种盐浓度均为50 mmol·L-1时,NaCl处理叶片中MDA含量为3.19 μmol·g-1,Na2SO4处理MDA含量为4.70 μmol·g-1,NaHCO3与Na2CO3处理MDA含量分别为4.63 μmol·g-1和9.29 μmol·g-1。处于同一浓度时,4种盐胁迫中,Na2CO3处理幼苗的MDA含量最高,说明其过氧化程度最高,细胞膜受到伤害最严重。 由图2可知,刺榆幼苗叶片中SOD活性随着盐浓度的递增呈先升高后降低的趋势,并且4种不同盐胁迫处理下,刺榆幼苗叶片SOD活性均高于对照。在NaCl浓度为70 mmol·L-1时SOD活性达到最大值,较对照显著增加了135%;在Na2CO3浓度为20 mmol·L-1时SOD活性达到最大值,较对照显著增加了165%;NaHCO3与Na2SO4浓度分别为30 mmol·L-1和50 mmol·L-1时SOD活性达到最大值,较对照显著增加。 由图2可知,POD活性的变化基本与SOD一致,呈先升高后降低的趋势。在NaCl浓度小于70 mmol·L-1时POD活性不断显著增加, NaCl浓度为70 mmol·L-1时POD活性达到最大,当NaCl为100 mmol·L-1时,POD活性有所下降,但仍显著高于对照。其他盐类胁迫幼苗POD活性变化基本NaCl处理一致,Na2CO3在浓度为30 mmol·L-1时POD活性达到最大值,与对照存在显著差异,NaHCO3和Na2SO4在浓度为50 mmol·L-1时POD活性达到最大值。说明以上盐浓度可能是刺榆幼苗对该盐的最大耐受浓度。 注:同种盐分的不同小写字母表示不同浓度处理间差异在P<0.05水平具有统计学意义。Note:Different small letters of the same salt indicate significant difference among different concentration treatments at P<0.05 level.图2 不同盐浓度对刺榆叶片MDA含量、SOD和POD活性的影响Fig.2 Effects of different salt concentrations on MDA content, activities of SOD and POD in leaves of H. davidii 植物的生长发育和推广种植在一定程度上由种子质量决定,因此种子作为生产的第一要素,受到人们重视。本研究中,刺榆种子对NaCl、Na2SO4和NaHCO3和Na2CO34种单盐胁迫的响应基本一致,低盐胁迫时,种子自身能够缓解吸胀伤害,对萌发影响不显著。而高浓度盐胁迫处理下,种子萌发率、发芽势、发芽指数及活力指数均受到显著抑制,相对盐害率也随盐浓度升高而增大。这与碱蓬[27]、蒙古扁桃[28]和蜡梅[29]种子在盐胁迫条件下的萌发特性基本一致。从种子萌发率、发芽势、发芽指数、及活力指数等指标来看,在Na+浓度相同时,NaCl溶液对刺榆种子萌发的抑制作用更显著。说明盐分除了对植物的渗透势造成不良影响,其中所含的Cl-对种子萌发也会产生离子毒害作用[30-31]。在摩尔浓度相同时,碱性盐(NaHCO3和Na2CO3)胁迫的萌发率明显低于中性盐(NaCl 和Na2SO4),是因为刺榆种子能抵御一定程度的渗透胁迫,而对于碱性盐所造成的pH效应不能进行有效调节[32]。发芽指数与活力指数随盐浓度升高而降低,说明虽然一部分刺榆种子在高浓度盐胁迫下可以萌发,但萌发质量明显下降,幼苗生长发育也受到抑制。从不同盐胁迫对刺榆种子萌发特性影响分析,在萌发过程中碱性盐造成的pH效应危害最为严重,其次是盐分造成的渗透胁迫,最后是离子胁迫的毒害作用[33]。 本研究发现,一定浓度NaCl、Na2SO4、NaHCO3和Na2CO34种盐对于刺榆的生长均存在不同程度的胁迫作用,在幼苗阶段表现为使幼苗变黄、生长无力、幼苗死亡、种子变黑等。在一定的胁迫范围内作物应对盐碱、干旱的反映首先是迅速的渗透调节[34],胁迫造成氧自由基的积累,进而引起植物细胞发生膜脂过氧化,生成MDA[35]。细胞受到的毒害作用越大,MDA含量越高[36]。本研究结果表明,刺榆幼苗中MDA含量随盐浓度增加而上升,说明随着盐浓度的增加植物受到的氧化胁迫程度逐渐增加。另一方面,植物通过提高体内抗氧化酶活性来清除活性氧。有研究指出,在盐胁迫环境中植物细胞对活性氧水平存在耐受范围,在范围内植物可以采用提高抗氧化酶活性的方式来清除体内活性氧自由基,当活性氧水平过高时抗氧化酶活性便会受到抑制,对植物组织造成伤害[37]。本研究发现,刺榆幼苗叶片内SOD和POD活性随盐浓度增强先升高后降低。低浓度胁迫时,SOD和POD活性的升高在刺榆幼苗抗氧化防御作用中起着至关重要的作用。高浓度盐胁迫环境使SOD和POD酶活性逐渐降低,说明此时胁迫压力超过酶系统的调节范围,将酶系统破坏,酶活性降低,导致植物机体受到不同程度的伤害。因此,在低浓度盐环境中刺榆可以通过渗透调节、过氧化酶系统等自身防御体系有效保护细胞不受损伤。 综上所述,刺榆种子及幼苗对低浓度(10 mmol·L-1)的NaCl、NaHCO3、Na2CO3和Na2SO4胁迫有一定的耐受性,考虑刺榆可以在盐碱化程度较低的环境进行种植和推广。研究结果为刺榆盐胁迫机制的进一步研究提供理论依据,为下一步模拟生态环境的胁迫处理提供一定的试验基础。但是本研究仅对单一盐分进行研究,对几种盐分的交互处理对刺榆种子及幼苗的影响,还需进一步探讨。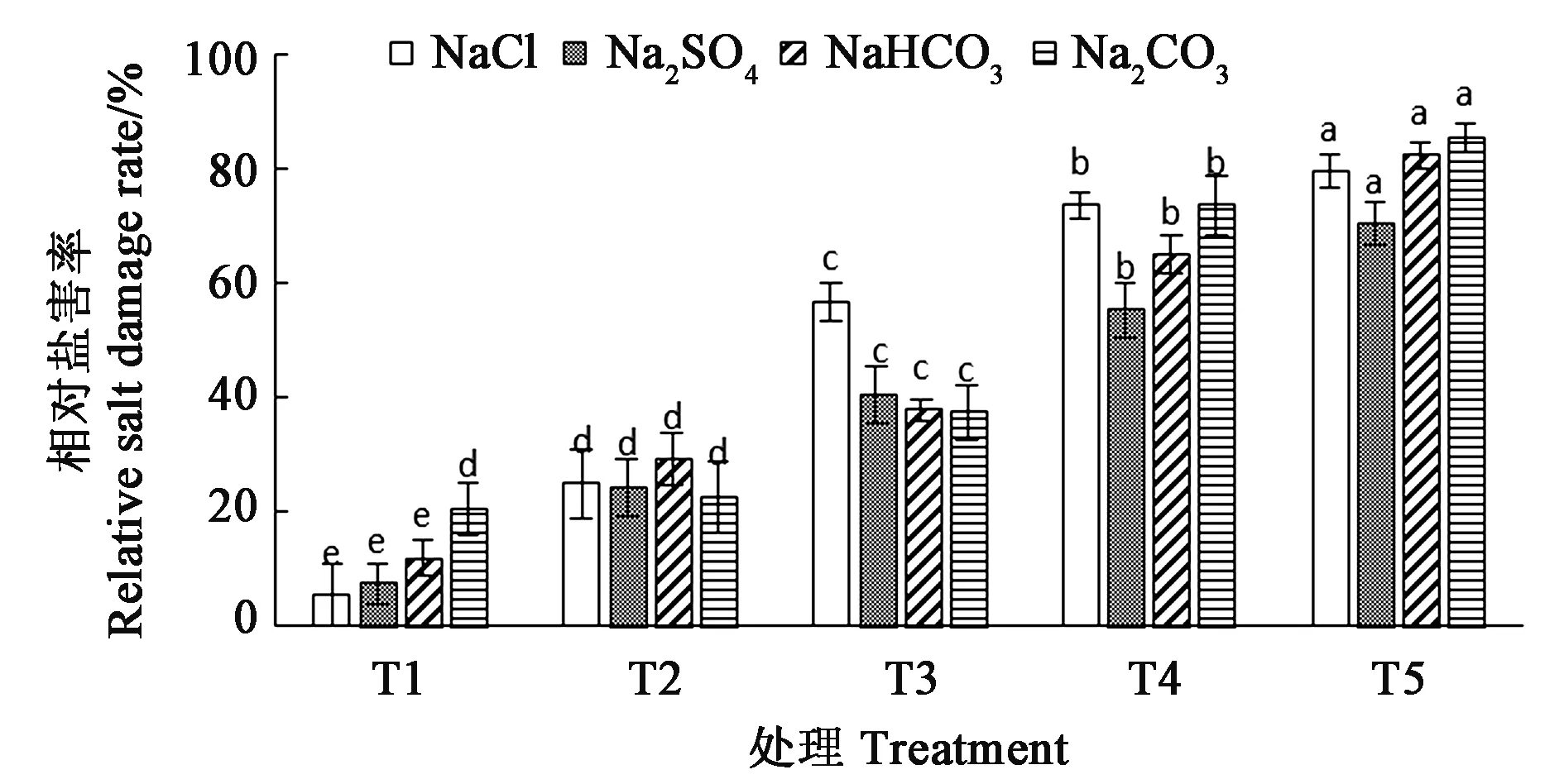
2.3 盐胁迫对刺榆幼苗生理特征的影响
3 讨论

