鞘糖脂的人工合成体系研究进展
陈晓辉,张 雪,杨广宇
(上海交通大学生命科学技术学院,上海200240)
鞘糖脂(glycosphingolipids,GSLs)作为一类典型的糖脂类化合物,是真核生物细胞膜的重要组成部分;在原核生物和病毒中也发现了部分鞘糖脂,如在肠道微生物BacteroidesfragilisNCTC 9343中的α-半乳糖神经酰胺α-GalCerBf和GSL-Bf717,赫希氏大肠杆菌溶解病毒株86(EhV86)包膜中的十四酰GSLs[1-2]。它们在细胞识别、细胞免疫、细胞凋亡及病原入侵等多种生理活动中发挥重要作用,并且与神经退行性疾病、溶酶体贮积症和癌症等疾病的发生和发展密切相关[3]。细胞表面GSLs可以与其他细胞表面的GSLs相互作用参与细胞识别,也可以调节细胞表面受体蛋白参与信号传导[4]。此外,GSLs通常是病毒、细菌和原生动物入侵宿主的识别靶标,与传染性疾病密切相关。GSLs还参与激发多种细胞的先天型和适应型免疫系统,也和肿瘤细胞的生长、发生和转移有关[5]。含有唾液酸的酸性GSLs被称为神经节苷脂类,它们以高浓度存在于大脑组织和神经系统中,在胚胎发生和婴儿的发育过程中发挥重要作用[6]。
多种GSLs具有潜在的药用价值,神经节苷脂具有治疗帕金森病和阿尔茨海默症的潜力[7-8]。科学家还发现了肿瘤细胞中存在GSLs的异常表达,因此GSLs可以作为治疗性疫苗的靶标,在癌症治疗中具有潜在应用,如含有岩藻糖基的鞘糖脂Globo H的衍生物GloboH-KLH-QS21已经进入临床三期用于治疗乳腺癌[9],而Fucosly-GM1a的衍生物Fuc-GM1-KLH-QS21也具有作为疫苗用于治疗小细胞肺癌的潜力[10]。在2015年,一种人类-小鼠抗GD2嵌合单克隆抗体获得批准,用于联合治疗高风险儿童神经母细胞瘤[11]。
然而,GSLs在生物体内含量很低,并且具有高度的微观结构不均一性,导致从动植物组织中进行GSLs的提取效率极低。近年来,基于人工化学酶法合成及人工细胞工厂等人工生物合成研究为解决GSLs的大量获取问题提供了新的途径。
1 鞘糖脂类的简介及天然生物合成途径
GSLs是典型的双亲性分子,由亲水性的寡糖链与疏水性的神经酰胺以糖苷键相连而成,其中神经酰胺又可被分为鞘氨醇碱基及脂肪酸,二者以酰胺键相连(图1)。按其寡糖链的四糖核心序列结构,GSLs通常可被分为7类[12]。脊椎动物的GSLs主要属于ganglio、globo和neolacto系列;而在无脊椎动物中,mollu和arthro系列GSLs占主导地位[13]。GSLs的鞘氨醇碱基主要分成3种:D-鞘氨醇(D-sphingosine)、二氢鞘氨醇(dihydrosphingosine)和植物鞘氨醇(phytosphingosine)[14]。而GSLs中的脂肪酸种类主要是含有14~36个碳原子的饱和脂肪酸链,但也有含有双键或者2-羟基化修饰的脂肪酸链的GSLs存在[15]。由于GSLs的寡糖链模块、鞘氨醇碱基模块及脂肪酶模块均具有丰富的结构修饰类型,它们互相组合构成了数量极为庞大的鞘糖脂类化合物家族,预计自然界中存在至少10万种以上(www.sphingomap.org)。对鞘糖脂类在生物体内不同生理和发育状态下的组成、结构和生理功能的研究催生了“鞘糖脂组学”(Glycosphingolipidology)这一新的研究领域。
GSLs的天然生物合成首先发生于内质网的细胞质面,丝氨酸和棕榈酰-辅酶A通过聚合反应形成3-酮二氢鞘氨醇,之后经过脱氢、酰化等一系列反应生成神经酰胺。之后神经酰胺被转移到高尔基体中,经过糖基转移酶的催化形成葡萄糖神经酰胺或半乳糖神经酰胺[13],作为合成后续GSLs的重要中间体。其中,葡萄糖神经酰胺在乳糖神经酰胺合酶的催化下进一步转化为乳糖神经酰胺(LacCer),并通过一系列糖基转移酶的级联催化形成asialo、ganglio、globo/iso-globo和lacto/neo-lacto等系列GSLs。而半乳糖神经酰胺经过唾液酸酸化后产生GM4神经节苷脂,或硫酸化以产生硫苷脂(图2)。这些合成后的GSLs通过囊泡运输到质膜,形成脂质微区域发挥其各自的生理功能[3]。
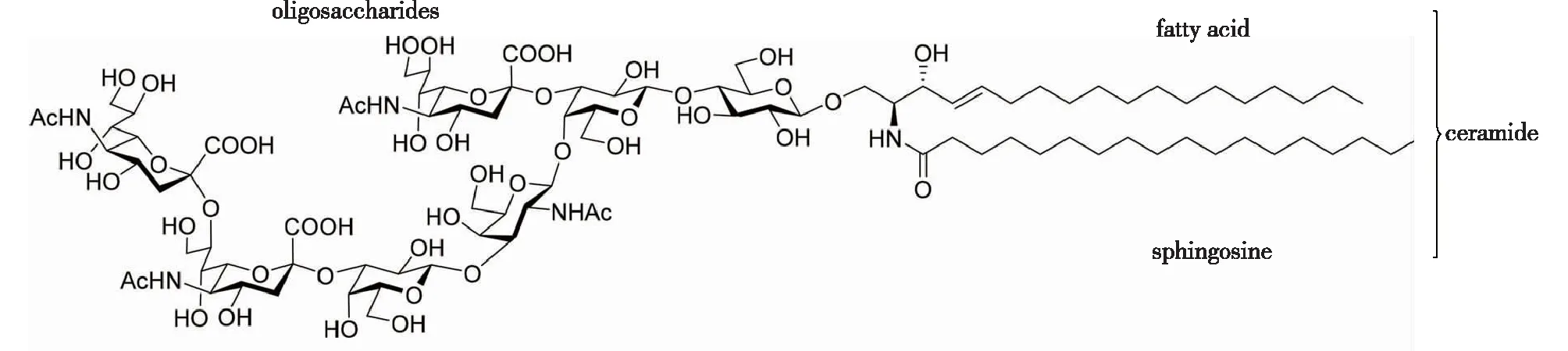
图1 一种典型的GSLs(神经节苷脂GT1a)的化学结构[4]Fig.1 A typical GSL (ganglioside GT1a) structure[4]
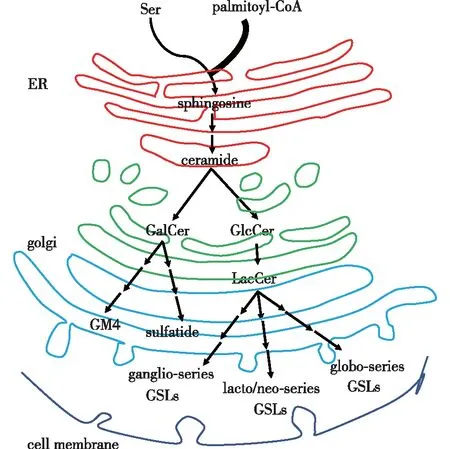
图2 人体内的GSLs天然合成途径[3]Fig.2 Natural synthesis pathway of glycosphingolipids in human[3]
2 鞘糖脂的化学酶法合成
GSLs的化学全合成已经有较多报道[16-17]。但化学合成GSLs需要极为繁琐的保护/去保护步骤来保证其结构中严谨的区域选择性与立体选择性,存在耗时费力、产率低及污染重等缺陷。近年来,科学家开始尝试利用微生物酶良好的特异性与高效的催化能力构建GSLs合成的化学酶法及细胞工厂合成体系,为鞘糖脂类的研究提供了新的机遇。对GSLs的生物合成大体可以分为3个步骤:寡糖链模块的合成、鞘氨醇模块与寡糖链模块的拼接以及脂肪链模块组装,下面分别就这三部分的进展进行介绍。
2.1 糖链模块的合成
GSLs的寡糖链合成以乳糖为核心起始,在一系列具有高度特异性的糖基转移酶催化下形成各类寡糖(图3)[4]。由于糖基转移酶需要昂贵的糖核苷酸作为供体底物,因此人们也开发了可以高效产生糖核苷酸的酶促合成体系,大大降低了寡糖合成的成本[18-20]。
Blixt等[21]利用一系列糖基转移酶实现了GD3、GT3、GM2、GD2、GT2和GM1等GSLs寡糖的合成,可以达到克级产量。他们使用的初始底物乳糖以2-叠氮乙基修饰,这种衍生物可以用于竞争性抑制反应中,并有利于与蛋白质、脂质等进行连接[21]。Tsai等[22]通过体外酶法合成Globo五糖(Gb5)、阶段特异性胚胎抗原4(SSEA4)等GSLs,产量也达到了克级,可用于后续的癌症疫苗及治疗的评价和开发。
陈希课题组的Yu等[18]对合成路径中的糖基转移酶进行了整合应用,系统开发了用于完整神经节苷脂及寡糖链合成的一锅多酶合成体系(one-pot multienzyme systems,OPME),在该合成体系中,把合成糖核苷酸供体的相关酶与糖基转移酶结合,可以用简单的单糖为底物实现复杂糖链的模块化合成,并且产率都在90%以上。该课题组还利用OPME合成了神经节苷脂寡糖GM3、GM2、GM1、GD3和GD2等,并以化学合成的乳糖苷鞘氨醇(LacβSph)为底物,利用OPME糖基化反应完成糖链的延伸,最终再用化学法进行酰化合成完整的神经节苷脂,实现了GD2、GD3及岩藻糖基化GM1的全合成[19-20]。
Geert课题组的Li等[23]开发了一种GSLs的磺酸盐标签,能实现合成中间产物的高效固相萃取和分离,并建立了一种化学酶法合成寡糖的全自动化平台,可以自动进行多达15个合成反应循环,合成不同种类的复杂聚糖,包括聚n-乙酰氨基内酯衍生物、人乳寡糖、神经节苷脂和n-聚糖等。
曹鸿志课题组的Lu等[24]开发了一个氧化还原体系控制的新底物工程策略,该策略是在寡糖的酶法模块化组装中加入对不需要唾液酸酸化位点进行选择性氧化的步骤,从而实现了在未氧化位点上的位点专一性唾液酸酸化,再通过对氧化部位进行还原得到目标产物。2019年,该课题组的Ye等[25]进一步拓展了该底物工程策略,利用唾液酸酸化和岩藻糖糖基化的竞争反应来精准控制岩藻糖基化的修饰位点,最终合成了22个结构均一的Lewis系列具有抗原活性的复杂糖链。
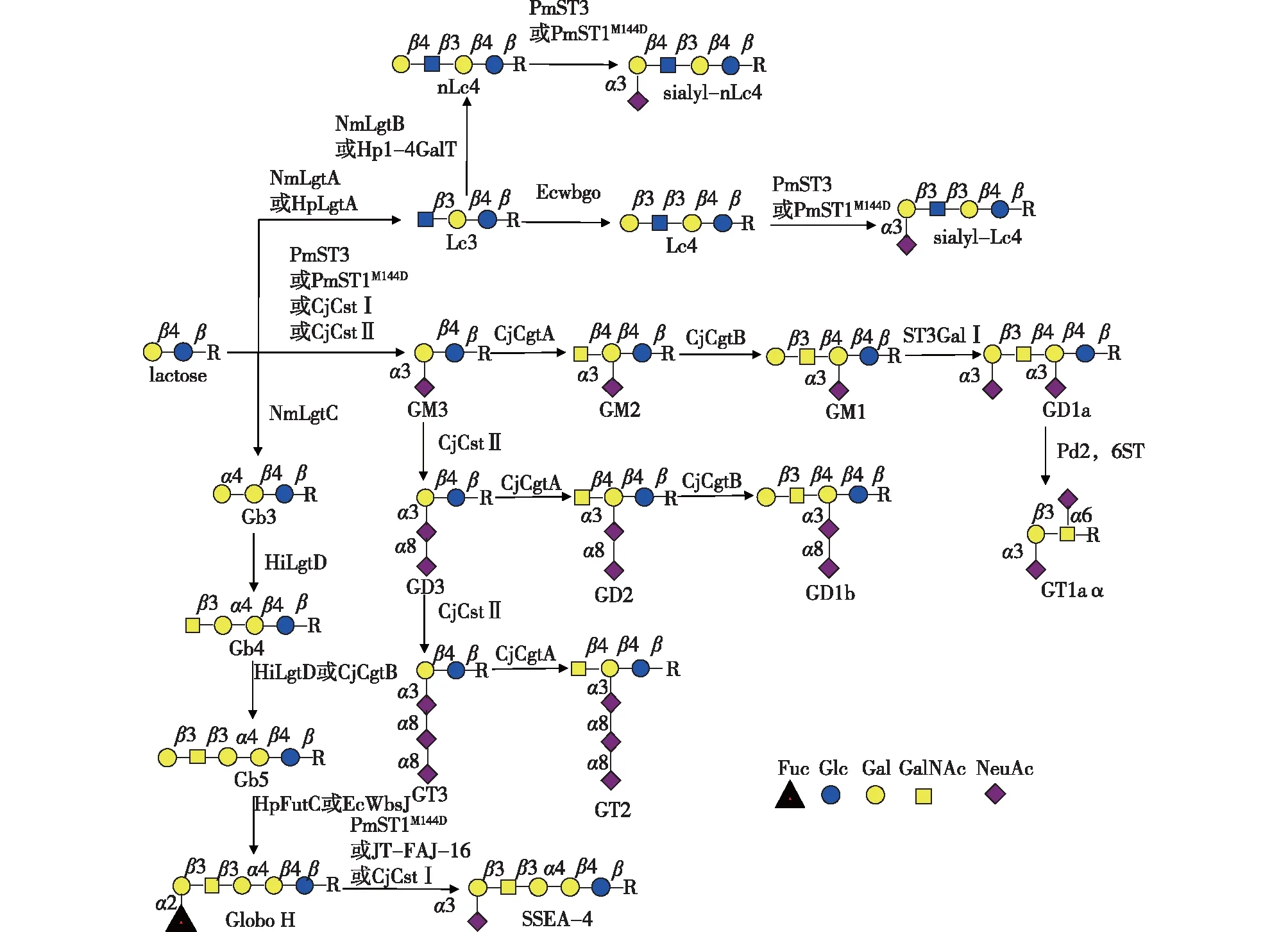
图3 神经节苷脂类鞘糖脂、globo-/isoglobo-类鞘糖脂和lacto-/neolacto-类鞘糖脂的合成[4]Fig.3 Synthesis of ganglio glycosphingolipids,globo-/isoglobo-sphingolipids and lacto-/neolacto-sphingolipids[4]
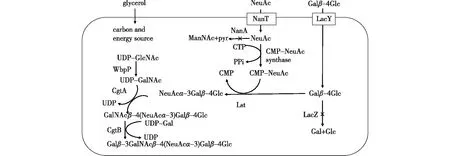
图4 在大肠杆菌中构建的神经节苷脂GM1寡糖链的人工生物合成途径[26]Fig.4 Metabolically engineered pathway of GM1 oligosaccharide biosynthesis in E.coli[26]
体外酶法合成需要对所用到的酶蛋白分别进行表达、提取和纯化,操作步骤较为繁琐,而利用代谢工程手段将相关酶基因组成代谢途径,一并在宿主中进行表达构建细胞工厂,可以更为高效地实现目标产物的合成。2003年,Antoine等[26]首先将糖基转移酶、唾液酸转移酶等酶的基因导入大肠杆菌,构建了一株可以合成GM1寡糖链模块的大肠杆菌菌株(图4);在添加唾液酸和乳糖受体的情况下,每升大肠杆菌发酵液可产生0.89 g的GM1寡糖链和1.25 g的GM2寡糖。2005年,该小组的Antoine等[27]对该系统进行进一步改造,从而能生产神经节苷脂GD3寡糖链,产量达到0.83 g/L,显示了该系统在合成寡糖类化合物方面具有良好的可塑性。2009年,Randriantsoa等[28]进一步利用来自于Helicobacterpylori的α1,2-岩藻糖基转移酶(FutC)实现了六糖Globo H寡糖链的合成。2019年,笔者所在课题组的刘新平等[29]在大肠杆菌JM107中构建了以氟化乳糖和唾液酸为底物的GM3、GM2和GM1这3种α位氟化寡糖的生物合成途径,实现了氟化神经节苷脂类寡糖在大肠杆菌中的人工生物合成途径,为后续神经节苷脂类的全合成打下基础。
2.2 鞘氨醇模块的组装
鞘糖脂内切糖苷酶可以特异性水解GSLs中连接寡糖链和神经酰胺之间的糖苷键。1998年,Mackenzie等[30]首次提出,将糖苷酶活性中心的亲核残基突变为不具备亲核功能的氨基酸,可以去除其天然水解活性;与此同时,利用具有自我夺电子能力的氟化糖作为糖基供体,则可以使糖苷水解酶变成糖苷合成酶,有效催化糖苷键的合成(图5)。Caines等[31]通过对来自于马红球菌Rhodococcussp.M- 777的天然水解神经节苷脂的鞘糖脂内切酶EGCase Ⅱ进行了分子改造,将其转化为GSLs的糖苷合成酶,相应产率达到了95%;之后他们对EGCase Ⅱ再次进行了改造,将其催化糖苷键合成的活性提升了3倍,并对非天然底物植物鞘氨醇产生了明显的催化活性[32]。在此之后,笔者所在课题组的李卓等[33]对该酶做进一步改造,将其催化糖苷键合成的活性又提升了2倍。
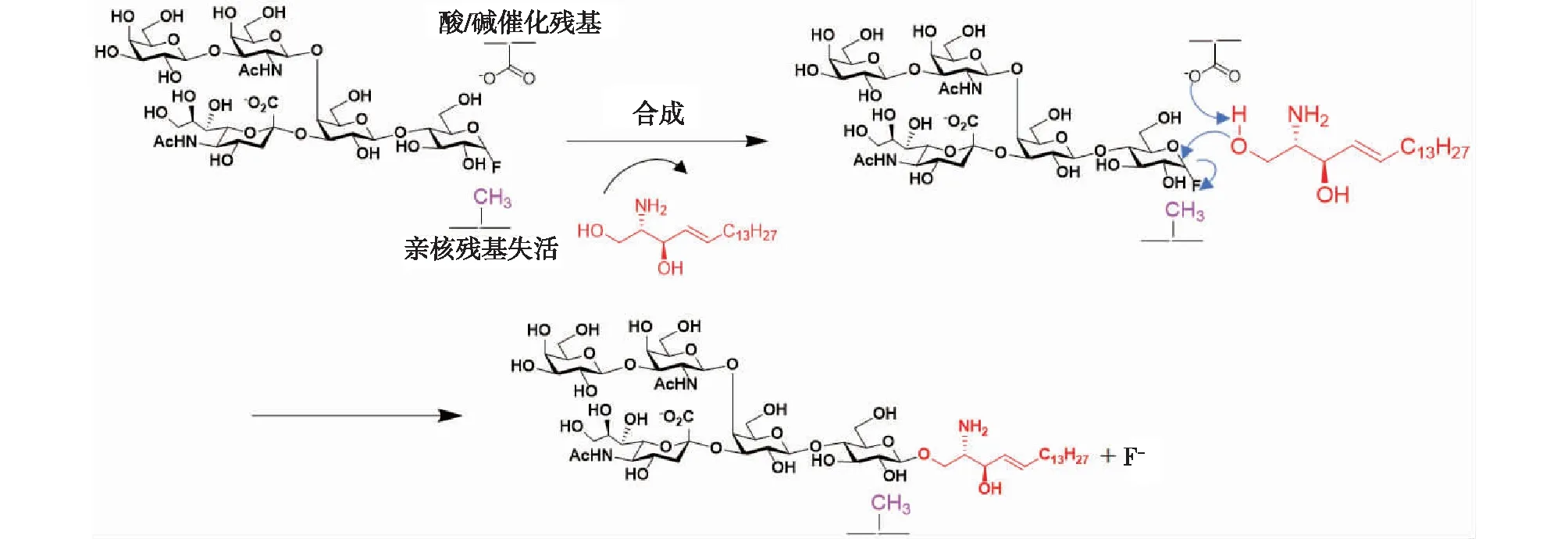
图5 糖苷合成酶EGCase合成lyso-GM1的反应机制Fig.5 Mechanism of EGC glycosynthase-catalyzed synthesis of lyso-GM1
鞘氨醇是GSLs合成中的关键中间体。2012年,德国的Schorsch等[34]利用代谢工程的方法,优化了Pichiaciferrii中四乙酰基植物鞘氨醇(TAPS)的合成代谢途径并过量表达合成途径中的关键酶,使得该菌生产四乙酰基植物鞘氨醇的产量达到199 mg/g。随后德国赢创公司的Schaffer Steffen研究小组对Pichiaciferrii菌株进行改造,获得了1株能够大量产生三乙酰基鞘氨醇的工程菌株,在摇瓶中三乙酰基鞘氨醇的产量为240 mg/L,实验室规模的发酵产量达到890 mg/kg,而三乙酰基鞘氨醇再经过两步化学催化即可获得D-鞘氨醇[35]。
2.3 脂肪链模块的组装
鞘糖脂N-去酰基化酶(sphingolipid ceramideN-deacylase,SCDase)是一种双功能酶,同时能够催化鞘糖脂中脂肪酸链和鞘氨醇链之间酰胺键水解或合成,可以应用于溶血GSLs(lyso-GSL)的制备和GSLs脂肪链的组装。1988年,Hirabayashi等[36]首次在Nocardiasp. 中发现具有这种活性的酶。1995年,Ito课题组的Börgel等[35]在Pseudomonassp.TK4也发现这种活性的酶,首次命名为SCDase。迄今为止,已有4个具有SCDase活性的酶被报道,分别来自于Nocardiasp.[34]、Pseudomonassp.[37]、Streptomycessp.[38]和ShewanellaalgaG8[39]。笔者所在课题组的Han等[40]对来源于ShewanellaalgaG8中的SCDase进行了详细研究,发现其催化活性可以与EGCase实现耦联,不需中间纯化步骤即可合成完整的神经节苷脂,并首次成功建立了鞘糖脂模块的体外酶法组装体系。他们利用反应工程策略,通过调控反应体系实现了SCDase水解活性与合成活性的拆分,产率均达到95%以上,并发展了高效的GM1脂肪酸模块酶法替换体系,制备了一系列含不饱和脂肪酸的GM1衍生物[41]。
3 总结与展望
目前GSLs的化学酶法合成取得了很多成绩,一锅多酶法(OPME)、代谢工程等新技术的发展也进一步完善了其生物合成体系。然而,目前许多GSLs合成的关键酶还存在活性低、底物谱窄等缺陷,而相关细胞工厂构建也仅处于初始阶段。在未来,对关键酶进行新基因挖掘、分子改造与定向进化以及利用合成生物学技术提升细胞工厂的系统整合能力,将有助于拓展人类合成此类关键化合物能力。相信随着GSLs人工合成研究的进一步发展,加强对GSLs结构与功能的认识,可以促进对其生理功能、作用机制及相关药物开发的研究。

