基于表达和反应耦联的羟基化酶催化合成反式-4-羟基-L-脯氨酸
景晓冉,聂 尧,徐 岩,2
(1.江南大学 生物工程学院工业生物技术教育部重点实验,江苏无锡214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡214122)
反式-4-羟基-L-脯氨酸(trans-4-Hpro)是药物合成中一种重要的中间体[1-3],可以用来合成碳青霉烯类抗生素类高附加值药物[4-5],同时在材料化工、食品营养和护肤美容方面也具有广泛的应用价值[6-7]。目前,随着生物技术的快速发展,生物合成trans-4-Hpro的研究引起人们的广泛关注。
1995年,Serizawa等[8]发现一株可被命名为ClonostachyscylindrosporaSANK 14591的菌株,外源添加L-脯氨酸(L-Pro)可以合成13.8 mg/L的trans-4-Hpro。1996年,Lawrence等[9]从StreptomycesgriseoviridusP8648 中纯化出脯氨酸4-羟化酶,并对该酶的特性进行了初步研究,每毫克蛋白每分钟的羟脯氨酸产量仅为907 pmol/L。2000年,Shibasaki等通过全细胞酶活测定筛选出来源于Dactylosporangiumsp. RH1活性最高的P4H[10],以Escherichiacoli(E.coli)W1485 作为宿主菌进行重组表达,并以E.coliW1485 pTrS2-4OH为菌株进行发酵培养,在发酵罐中外源添加L-Pro获得了15 g/L的trans-4-Hpro[11]。2006年,Bontoux等[12]在反应体系中添加10 mmol/L的L-Pro为底物,在250株野生菌中筛选出5株可转化生成trans-4-Hpro,产率均在5%~10%。2013年,刘合栋等[13]将优化后的P4H基因插入含有色氨酸串联启动子的pUC19 质粒,并导入E.coliBL21(DE3)中,在摇瓶水平添加200 mmol/L L-Pro为底物发酵8 h,可积累0.492 g/L 的trans-4-Hpro。2017年,周海岩等[14]将源于BradyrhizobiumjaponicumUSDA 6的脯氨酸4-羟化酶在E.coliBL21(DE3)中进行重组构建,采用全细胞催化反应体系,经过体系的优化,trans-4-Hpro的合成量达到34.86 mg/L。
虽然目前已有许多生物催化转化羟基脯氨酸研究的相关报道,但能够高效羟基化L-Pro的酶资源仍然有限。微生物合成法生产trans-4-Hpro的过程中,菌体生长缓慢,很难达到高密度发酵,L-Pro的有效转化率较低,从而造成生产原料的浪费。本研究中,笔者利用功能酶基因探矿方法挖掘获得羟基化L-Pro的新型Fe(II)/2-酮戊二酸(2-OG)依赖型双加氧酶KaPH1,对羟基化酶表达和反应耦联过程进行调控,通过监测体系中菌体生长、蛋白表达及底物转化进程,以期实现在不添加共底物2-OG的情况下L-Pro的高效转化,为生物合成trans-4-Hpro高效转化体系的建立提供理论和实践基础。
1 材料与方法
1.1 试剂与仪器
Kutzneriaalbida(白色库茨涅尔氏菌),中国普通微生物菌种保藏中心(CGMCC);E.coliJM109和E.coliBL21(DE3)保存于本实验室;表达载体pET-28a,Novagen公司;克隆载体pMD-19T、限制性内切酶和连接酶,TaKaRa公司;PCR纯化试剂盒、DNA回收试剂盒、质粒提取试剂盒,OMEGA生物科技公司;E.colipET-28a-KaPH1(E.coliKaPH1)、E.colipET-28a-P4H(E.coliP4H)本研究中构建;标准品L-Pro、trans-4-Hpro、顺式-4-羟基-L-脯氨酸(cis-4-Hpro),美国Sigma 公司;卡那霉素、IPTG,上海生工生物技术有限公司;其他分析纯试剂,国药集团化学试剂有限公司;PCR引物、P4H的基因序列由上海睿迪生物科技有限公司合成。
Mastercycler nexus X2型PCR仪,Eppendorf公司;GelDoc 2000型凝胶成像系统,Bio-Rad公司;酶标仪,Thermo公司;pH计,美国Mettler Toledo公司;Waters 2695型高效液相色谱仪,沃特世科技有限公司;Waters ACQUITY UPLC-MS/MS液质联用仪,沃特世科技有限公司;Avance 400型核磁共振波谱仪,Bruker公司;JY-IIN型超声波细胞粉碎机,宁波新芝生物公司;UV-3102PC型分光光度仪,美国UNIC公司;Avanti J-E型冷冻高速离心机,Beckman Coulter公司。
1.2 实验过程
1.2.1 目的基因片段的获得
参照大肠杆菌密码子偏好性、GC含量,对来源于Dactylosporangiumsp.的脯氨酸4-羟基化酶基因(P4H,GenBank No.BAA20094.1)进行序列的优化和设计,将合成的基因片段连接到表达载体pET-28a中。
利用基因挖掘工具,将已报道的P4H在NCBI数据库中通过BLAST进行同源序列比对后,选取与其序列同源性为51%的基因作为候选基因进行重组克隆表达。以Kutzneriaalbida的全基因组为模板,以KaPH1-F-NdeⅠ(5’-T ̄G ̄C ̄A ̄T ̄C ̄A ̄T ̄A ̄T ̄G ̄C ̄T ̄C ̄A ̄C ̄C ̄G ̄A ̄T ̄T ̄C ̄G ̄C ̄A ̄G ̄T-3)和KaPH1-R-HindⅢ(5’-T ̄T ̄A ̄A ̄G ̄C ̄T ̄T ̄T ̄C ̄A ̄T ̄G ̄C ̄G ̄C ̄C ̄C ̄A ̄G ̄G ̄C-3’)为引物,扩增目的片段KaPH1。PCR反应体系:ddH2O 22 μL,引物F(50 pmol/μL) 1 μL,引物R(50 pmol/μL) 1 μL,基因组DNA 1 μL,PrimeSTAR Max Premix(2×)25 μL。PCR反应过程:95 ℃预变性3 min;95 ℃ 10 s,47 ℃ 5 s,72 ℃ 45 s,循环30次;72 ℃延伸10 min。用PCR纯化试剂盒纯化DNA片段,将获得的基因片段连接到克隆载体pMD-19T中。
1.2.2 重组菌株的构建
用限制性内切酶NdeⅠ、HindⅢ对克隆载体pMD-19T-KaPH1和表达载体pET-28a分别进行双酶切,回收目的片段用T4 DNA连接酶于20 ℃过夜连接,转化E.coliJM109 感受态细胞中,涂布含50 μg/mL 卡那霉素的LB平板,37 ℃培养12 h;挑取阳性克隆子,经菌落PCR和DNA测序验证正确后,将重组质粒pET-28a-P4H、pET-28a-KaPH1分别转化至E.coliBL21(DE3)感受态细胞中,构建重组菌E.coliP4H和E.coliKaPH1。
1.2.3 重组大肠杆菌的培养和诱导表达
挑取重组大肠杆菌单菌落接种至5 mL含50 mg/L卡那霉素的LB液体培养基中,于37 ℃、200 r/min 培养过夜,并以2%的接种量转接至50 mL 含50 mg/L卡那霉素的LB液体培养基中,于37 ℃、200 r/min 振荡培养至OD600为0.6~0.8,为了探究重组菌株目的蛋白最优的表达条件,设置添加的IPTG浓度为0.1、0.5和1.0 mmol/L,并将诱导温度分别设置为20、25和30 ℃,于200 r/min 下诱导培养12 h后通过SDS-PAGE检验蛋白可溶性表达情况[15]。
1.2.4 全细胞酶活测定方法
酶活测定体系(mmol/L):葡萄糖20,L-Pro 20,L-抗坏血酸5,2-OG 20,FeSO4·7H2O 0.5,MgSO47H2O 2,CaCl20.5;加入一定量的全细胞,在28 ℃、200 r/min条件下反应30 min,测定体系中trans-4-Hpro的生成量。
酶活定义:在28 ℃下,1 min生成1 mmol/Ltrans-4-Hpro所需要的全细胞的量定义为一个酶活单位(U)。
1.2.5E.coliKaPH1转化合成trans-4-Hpro
全细胞反应体系(mmol/L):葡萄糖20,L-Pro 20,L-抗坏血酸5,2-OG 20,FeSO4·7H2O 0.5,MgSO4·7H2O 2,CaCl20.5,菌体质量分数5%,初始 pH 7.0。将经过诱导培养后的发酵液离心,称取湿菌体质量,然后用MES缓冲液将细胞冲洗悬浮后,在28 ℃摇床中200 r/min培养24 h,然后在沸水中加热2 min,灭活菌体,终止酶反应,测定体系中trans-4-Hpro产量[16]。
分别在不同温度梯度(20、25、30、35、40和50 ℃)和pH梯度下测定重组菌E.coliKaPH1全细胞活性,探究反应体系的温度和pH对trans-4-Hpro合成的影响。不同pH梯度的反应体系分别采用100 mmol/L MES-Tris缓冲液(pH 3.5~7)和100 mmol/L Tris-HCl缓冲液(pH 7~9)。
分别在不同2-OG浓度梯度(0~45 mmol/L)、Fe2+浓度梯度(0~3.5 mmol/L)和L-抗坏血酸浓度梯度(0~30 mmol/L)下测定重组菌E.coliKaPH1转化体系中trans-4-Hpro产量,探究转化体系中共底物和辅因子对trans-4-Hpro合成的影响。
考察转化体系中的葡萄糖浓度(0~50 mmol/L)和CaCl2浓度(0~4 mmol/L)对重组菌E.coliKaPH1转化L-Pro活性的影响。
1.2.6 表达和反应耦联合成trans-4-Hpro的过程调控
取重组大肠杆菌单菌落接种至5 mL含50 mg/L卡那霉素的LB液体培养基中,于37 ℃、200 r/min 培养过夜,并以6%的接种量转接至50 mL 含50 mg/L卡那霉素的自诱导液体培养基(添加一定浓度的L-Pro)的500 mL挡板锥形瓶中,于37 ℃、225 r/min 振荡培养3 h后,于20 ℃、225 r/min培养80 h,将发酵液离心,测定发酵上清中trans-4-Hpro的产量[16]。
对体系中产酶和催化耦联过程进行温度阶段性调控,在诱导培养时分别控制表达和转化最适温度条件的时间,确定最优调控途径。
在不同诱导剂浓度(10~30 mmol/L乳糖)下测定trans-4-Hpro的产量及全细胞的酶活,考察乳糖浓度对重组菌株E.coliKaPH1合成trans-4-Hpro的影响。
对耦联转化体系中底物 L-Pro设置浓度梯度(20~100 mmol/L),考察体系中trans-4-Hpro的产量和生物量(OD600)的变化,以分析底物浓度的增加对重组菌株E.coliKaPH1生长和转化L-Pro活性的影响。
1.2.7 底物和产物的分析
使用芴甲氧羰酰氯(Fmoc-Cl)柱前试剂对样品进行衍生化反应[17],终止反应后用于HPLC 检测。底产物的分析方法:Diomansil C18 柱(250 mm×4.6 mm),紫外检测波长263 nm,流动相A 为(0.05 mol/L NaAc-HAc缓冲液(pH 4.2)与乙腈的体积比90∶ 10),流动相B 为(0.05 mol/L NaAc-HAc缓冲液(pH 4.2)与乙腈的体积比20∶ 80),流动相A和流动相B采用梯度洗脱程序,流速1.0 mL/min。
1.2.8 产物结构鉴定
采用液相色谱-质谱( LC-MS)联用技术及核磁共振仪(NMR) 对反应产物进行结构表征。LC-MS 条件:采用液质联用仪Waters ACQUITY UPLC-MS/MS系统,色谱柱为Waters ACQUITY UPLC HSS C18反相色谱柱(1.8 μm)。流动相A为0.02 mol/L NH4Ac-HAc缓冲液(pH 4.2),流动相B为乙腈,进行梯度洗脱。流速200 μL/min,柱温 25 ℃,进样量 5 μL。将10 mg的产物粉末溶于600 μL D2O后,转移至直径为5 mmol/L核磁管。由核磁共振波谱仪测定核磁共振氢谱(1H NMR)和碳谱(13C NMR)[18],反应产物核磁数据如表1所示。

表1 化合物的核磁共振氢谱及碳谱分析
2 结果与讨论
2.1 羟基化酶的表达及其催化合成转化trans-4-Hpro
在前期研究工作中,笔者利用基因挖掘工具基于已报道的P4H序列通过同源序列比对获得K.albida来源的新型羟基化酶KaPH1(GenBank No.WP_030110684.1),并对其酶学性质进行了测定[19]。功能性验证试验表明KaPH1可将L-Pro高效地立体选择性羟基化形成trans-4-Hpro,KaPH1纯化后的蛋白条带大小约为2.9×104,其最适pH为6.5,最适温度为30 ℃;以L-Pro为底物,其Km和kcat值分别为1.07 mmol/L和 0.54 s-1[19]。在本研究中,笔者进一步对重组菌E.coliKaPH1的表达条件进行探究,结果如图1所示。由图1可见,E.coliKaPH1在分子量3×104处发现一条明显的条带,与目标条带分子量大小一致。通过对E.coliKaPH1表达条件优化,结果表明:KaPH1在25和30 ℃条件下蛋白的总表达量较高,但是在上清中无法观察到明显目的条带,大部分呈现为包涵体的形式;相比之下,KaPH1在20 ℃条件下虽然蛋白的总表达量较少,但可溶性表达效果最好。在考察的IPTG浓度(0.1、0.5、1 mmol/L)下,E.coliKaPH1均可表达可溶性的KaPH1,0.5和1 mmol/L IPTG条件下诱导的蛋白表达量一致且明显高于0.1 mmol/L IPTG浓度下的蛋白表达量。由此确定E.coliKaPH1最适表达条件:20 ℃、0.5 mmol/L IPTG。

(a) M—标准蛋白;1、2—在20 ℃条件下KaPH1的总蛋白及可溶性蛋白;3、4—在25 ℃条件下KaPH1的总蛋白及可溶性蛋白;5、6—在30 ℃条件下KaPH1的总蛋白及可溶性蛋白;(b) 1′、2′—0.1 mmol/L IPTG浓度下KaPH1的总蛋白及可溶性蛋白;3′、4′—0.5 mmol/L IPTG浓度下KaPH1的总蛋白及可溶性蛋白;5′、6′—1 mmol/L IPTG浓度下KaPH1的总蛋白及可溶性蛋白图1 重组大肠杆菌E.coli KaPH1在不同温度(a)和IPTG浓度(b)诱导下的异源表达情况Fig.1 Heterologous expression of E.coli KaPH1 induced at different temperature (a) and IPTG concentration (b)
L-Pro的羟基化过程需要分子氧、2-OG和Fe2+等辅因子和共底物的协同作用[11],L-Pro的羟基化过程与共底物2-OG的脱羧反应耦联进行。本研究采用E.coliKaPH1全细胞转化体系,通过外源添加底物、共底物和辅因子等,对重组菌转化L-Pro的活性进行比较分析。
在全细胞体系中加入20 mmol/L的L-Pro作为底物,通过检测反应体系中trans-4-Hpro的产量来比较重组菌株E.coliKaPH1转化L-Pro的活性,结果如图2所示。由图2可知,在反应前期阶段,E.coliKaPH1转化体系中trans-4-Hpro迅速积累,在反应12 h后临近反应终点,体系中trans-4-Hpro的产量最终达到1 051 mg/L,转化率为40.1%;与此同时,对照E.coliP4H菌株反应体系中trans-4-Hpro的积累量也达到825 mg/L,转化率为31.4%。全细胞反应转化结果表明,在相同菌体浓度(质量分数5%)下,重组菌株E.coliKaPH1展现出很高的L-Pro转化活性。在接下来的研究中,笔者将对E.coliKaPH1转化体系中影响trans-4-Hpro合成的因素进行探究,并对产酶和催化耦联过程进行调控。

图2 E.coli KaPH1转化合成trans-4-Hpro的活性验证Fig.2 Catalytic activity of E.coli KaPH1 for trans-4-Hpro synthesis
2.2 E.coli KaPH1转化体系调控结果
为探究转化合成trans-4-Hpro过程中的影响因素,通过对反应条件及转化体系中各组分的浓度进行调控,检测E.coliKaPH1活性或体系中trans-4-Hpro产量的变化。
2.2.1 温度和pH对E.coliKaPH1 活性的影响
为了考察反应温度及pH对E.coliKaPH1活性的影响,在其他因素不变的条件下,分别设置温度梯度(20、25、30、35、40和50 ℃)及pH梯度(MES缓冲液pH 3.5~7,Tris-HCl缓冲液pH 7~9),结果如图3所示。由图3可知,在25~40 ℃温度范围内,E.coliKaPH1活性维持在75%以上,并在30 ℃时达到最高值。在温度低于30 ℃时,E.coliKaPH1活性随着温度的升高逐渐升高;在温度高于30 ℃时,E.coliKaPH1的活性逐步降低,在50 ℃时,E.coliKaPH1活性损失超过了50%。
在pH 3.5~5.0范围内,E.coliKaPH1活性很低维持在25%以下,E.coliKaPH1活性在pH 5.5时迅速上升,并在pH 6.5时达到最高;在pH 7.0~9.0范围内,E.coliKaPH1活性下降,且活性测定体系的颜色发生变化(Fe2+在碱性环境下发生反应)。综上,本研究选择30 ℃和pH 6.5为接下来单步转化体系的反应条件。
2.2.2E.coliKaPH1转化体系各组分对trans-4-Hpro合成的影响

图3 温度(a)和pH(b)对E.coli KaPH1 活性的影响Fig.3 Effect of temperature (a) and pH (b) on E.coli KaPH1 activity
1)2-OG对trans-4-Hpro合成的影响。Trans-4-Hpro合成是由酶促羟基化反应与2-OG氧化脱羧反应相耦联[20],通过改变反应体系中2-OG的添加量探究其对重组菌的转化活性及trans-4-Hpro合成的影响。由于2-OG具有极大的酸性,使用Tris将2-OG母液的pH调至7.0再添加至体系中,结果如图4(a)所示。由图4(a)可知,当2-OG的浓度在0~30 mmol/L变化时,2-OG对trans-4-Hpro的产生具有显著的促进作用,在20 mmol/L处产量达到最高,为1 220 mg/L。随着2-OG浓度的继续增加,trans-4-Hpro的产量增长趋势不明显,反应体系的pH上升至8.6~8.9,这是由于2-OG在反应过程中不断被消耗,对反应体系的缓冲影响很大,造成体系pH的变化,从而影响了重组酶KaPH1的活性。
2)Fe2+对trans-4-Hpro合成的影响。Fe2+是2-OG依赖的双加氧酶的金属中心与底物相互作用的辅因子,所以Fe2+浓度会对重组酶的活性和羟基化反应有很大的影响[21]。针对全细胞催化系统(底物添加浓度20 mmol/L),考察反应体系中Fe2+浓度对重组菌转化活性的影响,结果如图4(b)所示。由图4(b)可知,Fe2+浓度在0~1.5 mmol/L变化时,对trans-4-Hpro的产生没有很大影响。随着Fe2+浓度的继续增加,羟脯氨酸的产量逐步上升,在2.5 mmol/L处达到最大产量为1 246 mg/L。因此,Fe2+最适添加浓度为2.5 mmol/L。
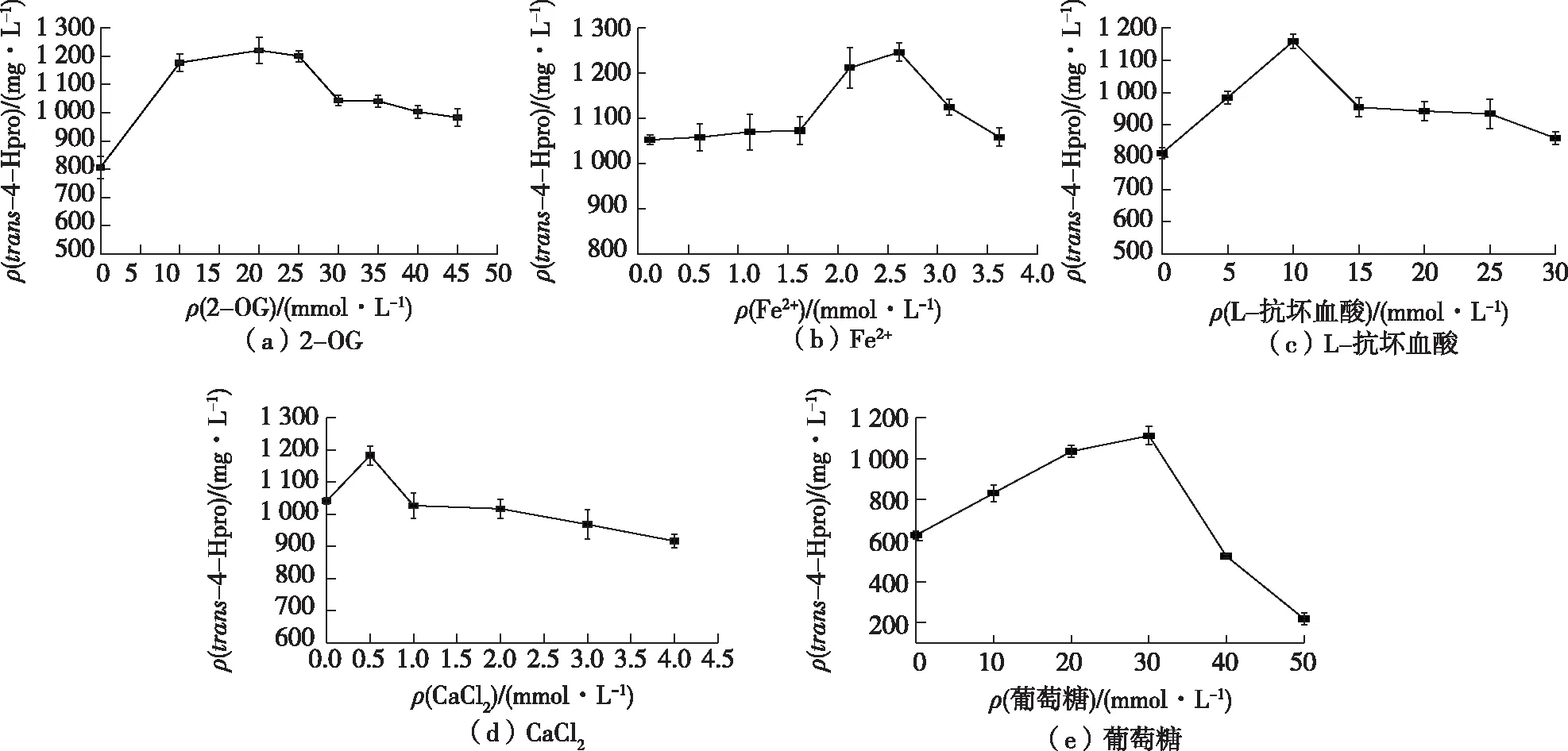
图4 E.coli KaPH1转化体系各组分对L-Pro羟基化的影响Fig.4 Optimization of components in E.coli KaPH1 transformation system for L-proline hydroxylation
3)L-抗坏血酸对trans-4-Hpro合成的影响。Fe2+在水溶液中极易容易被氧化,在针对Fe(II)/2-OG 依赖型双加氧酶催化机制的研究发现[21],该反应过程在某些情况下与抗坏血酸的氧化耦联,在体外系统中添加抗坏血酸或其他还原剂对Fe(II)/2-OG 依赖型双加氧酶具有一定的激活作用[22]。在考察反应体系中L-抗坏血酸浓度对重组菌催化活性的影响时,将L-抗坏血酸浓度设定为0~30 mmol/L。由图4(c)发现:添加L-抗坏血酸更有利于trans-4-Hpro的合成;添加10 mmol/L抗坏血酸时,trans-4-Hpro的产量达到最高水平(1 158 mg/L)。随着L-抗坏血酸浓度的持续增加,它对转化系统的缓冲体系也造成很大影响,因此,将L-抗坏血酸浓度设定为10 mmol/L。
4)CaCl2对trans-4-Hpro合成的影响。CaCl2虽然并未直接参与L-Pro的羟基化反应,但CaCl2与菌株细胞膜的通透性有关,从而影响到产物的释放,避免产物抑制。对转化体系中的 CaCl2设置 0.5~4.0 mmol/L浓度梯度,所得数据结果如图4(d)所示。由图4(d)可知,较低浓度的CaCl2对trans-4-Hpro酸的产量有一定程度的提高,在0.5 mmol/L达到最高水平(1 182 mg /L)。
5)葡萄糖对trans-4-Hpro合成的影响。葡萄糖经TCA循环化生成中间代谢产物2-OG[23],2-OG氧化脱羧反应与L-Pro的羟基化反应相耦联,葡萄糖含量会对trans-4-Hpro的合成有一定影响,因此对转化体系的葡萄糖设浓度梯度,结果如图4(e)所示。由图4(e)可知,在添加浓度为0~30 mmol/L的范围内,葡萄糖浓度的升高对L-Pro的羟基化反应较为有利,在30 mmol/L时trans-4-Hpro产量达到最高水平(1 112 mg/L)。但过高的葡萄糖浓度会急剧减少trans-4-Hpro的产生,是因为葡萄糖浓度过高,导致重组菌的代谢副产物乙酸浓度增加[24],从而对重组菌的转化活性产生影响。
2.3 表达和反应耦联的过程调控
Studier[25]针对表达型质粒自发诱导问题建立了自诱导表达系统,解决了原核生物高效表达过程中存在的问题。本研究中,笔者采用自诱导培养基进行产酶表达,在体系中加入L-Pro和其他辅因子,目的是将产酶表达和催化过程进行耦联,并对体系进行调控以建立高效发酵转化体系(图5)。
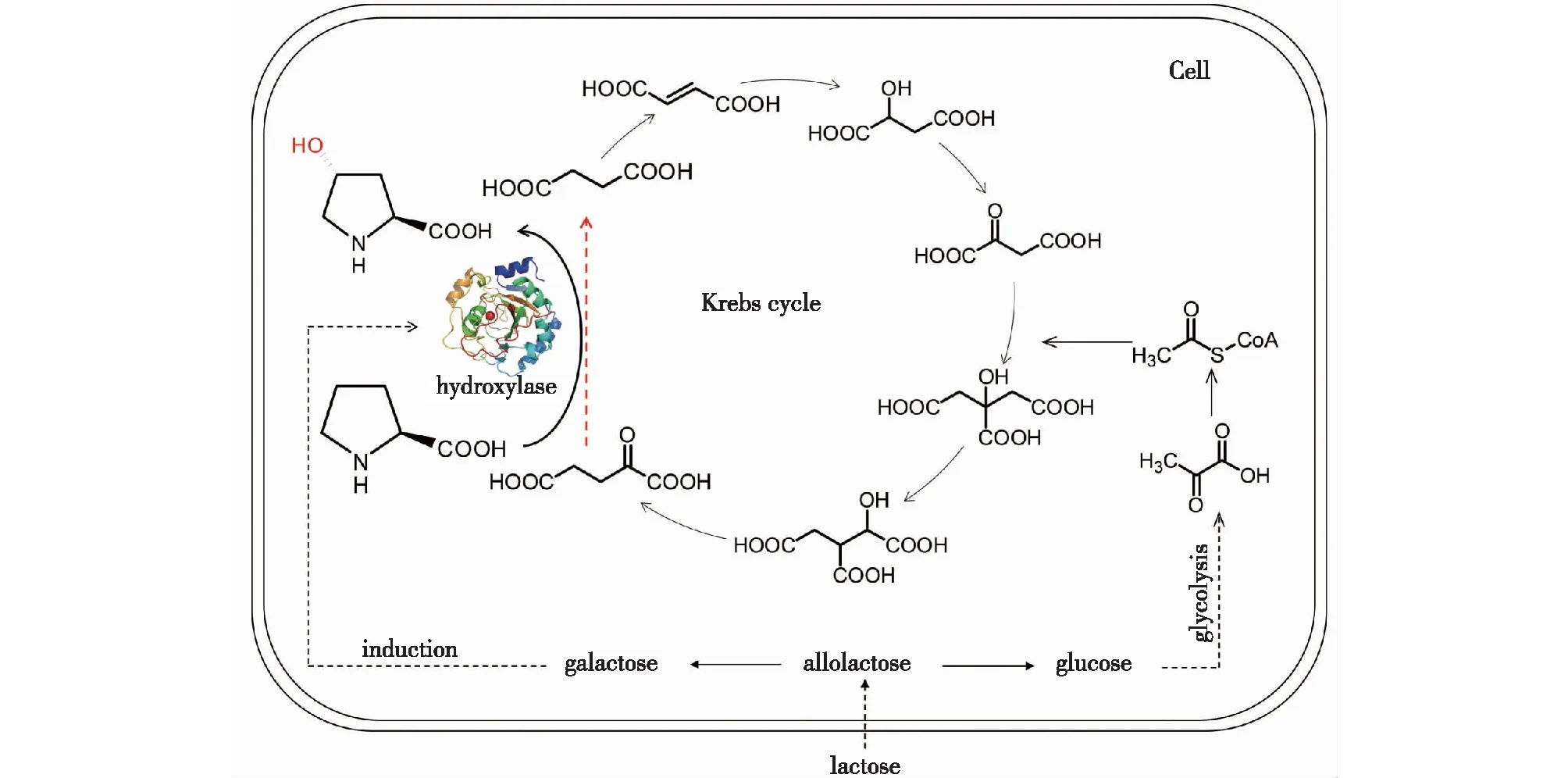
图5 酶表达与反应耦联合成trans-4-HproFig.5 Enzyme expression and reaction coupling system for the synthesis of trans-4-Hpro
2.3.1 表达和反应耦联过程的温度调控
重组酶KaPH1在20 ℃的条件下可溶性表达最好,同时通过全细胞酶活测定确定最适反应温度为30 ℃。现在对整个反应过程进行阶段性温度调控,设置底物初始添加浓度为20 mmol/L,然后将反应时间设为80 h,转化结果如图6所示。由图6可知:在温度调控途径一条件下,trans-4-Hpro的产量为1 662 mg/L,产率为63.4%;在温度调控途径二条件下,trans-4-Hpro为2 165 mg/L,产率82.6%;在温度调控途径三条件下,trans-4-Hpro的产量为2 512 mg/L,产率95.8%;在温度调控途径四条件下,trans-4-Hpro的产量为2 450 mg/L,产率92%。
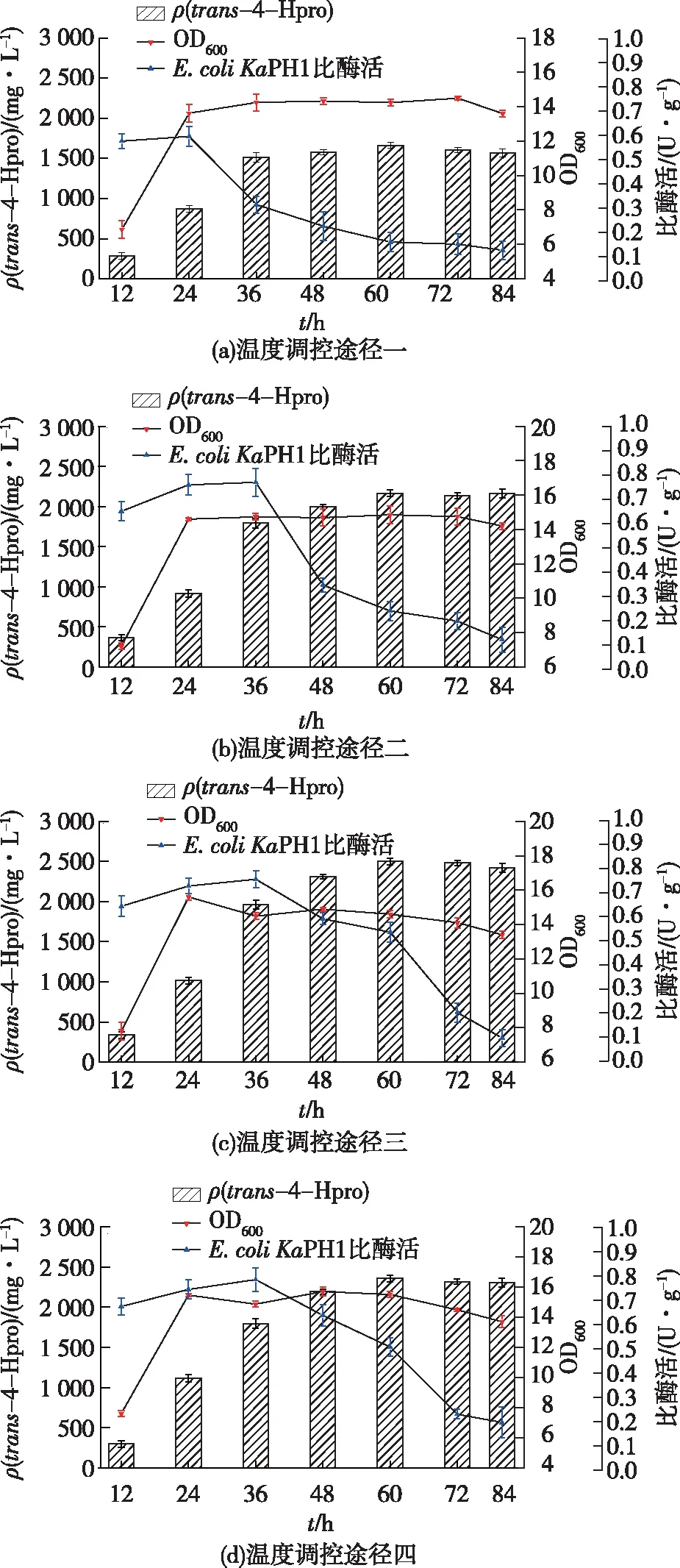
图6 耦联体系合成trans-4-Hpro的温度调控Fig.6 Temperature gradient-based regulation of coupling- system for the synthesis of trans-4-Hpro
(a)温度调控途径一:将E.coliKaPH1接入耦联体系37 ℃培养3 h后,变温为20 ℃诱导培养20 h,将温度转为30 ℃反应60 h。(b)温度调控途径二:将E.coliKaPH1接入耦联体系37 ℃培养3 h后,变温为20 ℃诱导培养40 h,将温度转为30 ℃反应40 h。(c)温度调控途径三:将E.coliKaPH1接入耦联体系37 ℃培养3 h后,变温为20℃诱导培养60 h,将温度转为30 ℃反应20 h。(d)温度调控途径四:将E.coliKaPH1接入耦联体系37 ℃培养3 h后,变温为20℃诱导培养80 h。
由图6结果可知,温度调控对OD600的积累没有太大影响,转化过程中E.coliKaPH1最高OD600均达到15左右。同时,温度的改变对细胞活性影响很大,其中途径一、二体系在变温之后,全细胞活性迅速下降。而在途径三中,将E.coliKaPH1接入耦联体系37 ℃培养3 h,变温为20 ℃诱导培养60 h后全细胞比酶活仍保持在0.55 U/g,最终将温度转为30 ℃反应20 h,产率可达到95.8%。综上,温度调控途径三为有利于trans-4-Hpro的合成。
2.3.2 乳糖浓度对表达和反应耦联合成trans-4-Hpro的影响
重组菌株高密度生长表达异源蛋白,以乳糖作为诱导剂可以提高蛋白表达量,降低生产成本[26]。考察乳糖浓度对表达和反应耦联合成trans-4-Hpro的影响,结果如图7所示。由图7可见,在乳糖为5 g/L时,体系中trans-4-Hpro的产量仅2 802 mg/L,产率为53%。在5~20 g/L的范围内,随着乳糖浓度的提高,体系中trans-4-Hpro的合成速率及生物量有增长的趋势,酶活在36 h时达到最高。当乳糖为15 g/L时,trans-4-Hpro的产量达到最高为3 782 mg/L,产率为72%;当乳糖提高至25 g/L时,产量、E.coliKaPH1 OD600及比酶活均有所降低。高浓度的乳糖虽然会加快trans-4-Hpro的前期合成速率,但是由于乳糖分解生成的半乳糖无法被大肠杆菌所利用,会造成原料的浪费。综上,笔者选择在体系中添加15 g/L的乳糖浓度来诱导合成trans-4-Hpro。
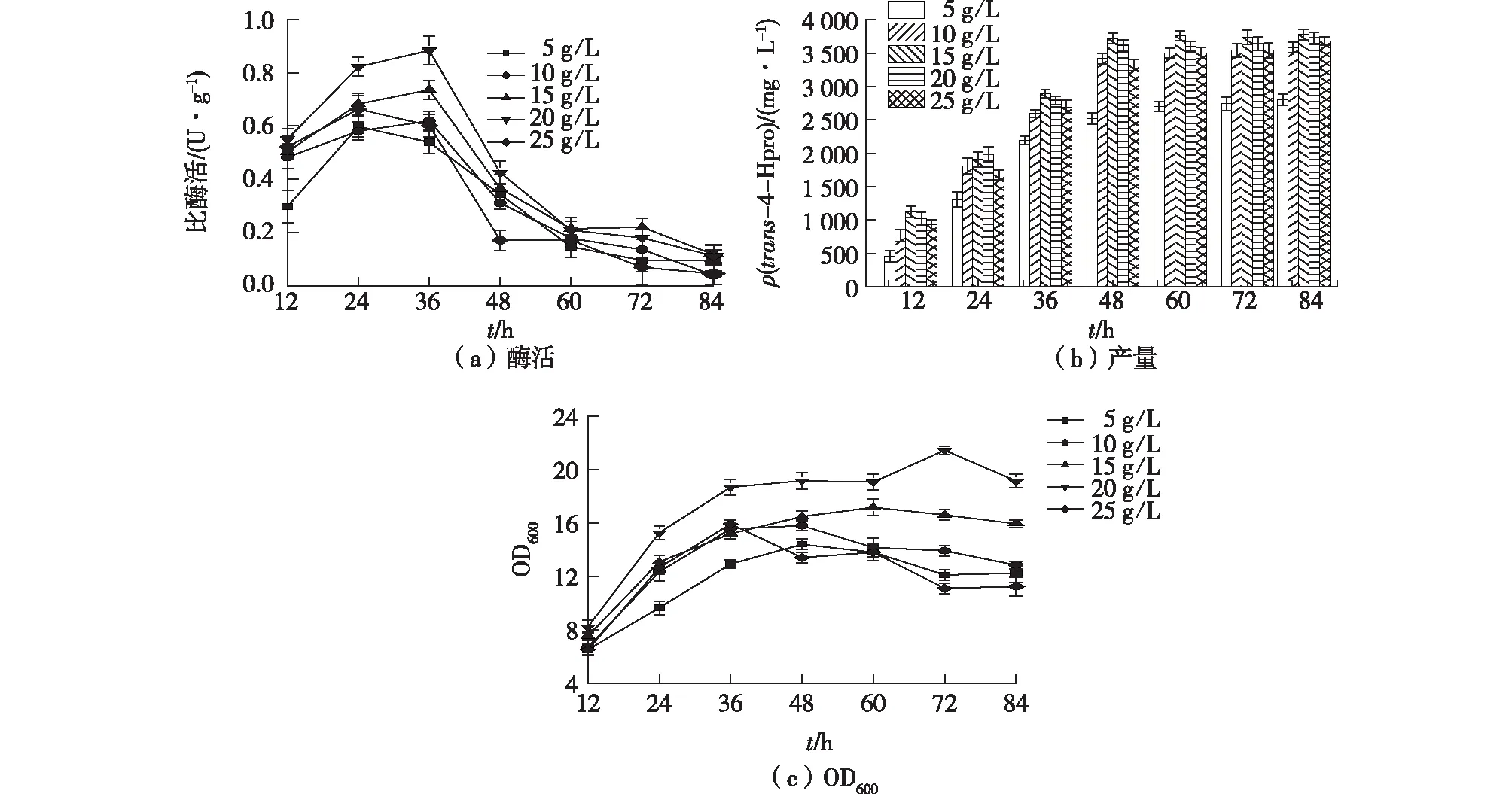
图7 乳糖浓度对生物合成trans-4-Hpro的影响Fig.7 Effects of lactose concentration on the synthesis of trans-4-Hpro
2.3.3 底物浓度对E.coliKaPH1合成trans-4-Hpro的影响
为进一步探究底物浓度对耦联转化过程的影响,保证体系中其他因素不变的情况下提高L-pro的浓度,检测体系中trans-4-Hpro的变化,结果如图8所示。由图8可知:L-Pro浓度为20 mmol/L时,trans-4-Hpro的产量为2 223 mg/L,OD600达到20.89,产率为84.8%;L-Pro浓度为40 mmol/L时,trans-4-Hpro的产量为3 960 mg/L,OD600达到22.14,产率为75.5%;L-Pro浓度为60 mmol/L时,trans-4-Hpro的产量为4 871 mg/L,OD600达到21.12,产率为60.3%;L-Pro浓度为80 mmol/L时,trans-4-Hpro的产量为6 007 mg/L,OD600达到23.16,产率56.4%;在培养基中L-Pro浓度为100 mmol/L时,trans-4-Hpro的产量为7 860 mg/L,OD600达到22.82,产率为59.9%。在不同的底物浓度下,耦联转化体系反应过程中中生物量的积累量变化不明显,随着底物浓度的升高,OD600有一定的提高。反应终点时,笔者发现在不同的底物浓度下体系中L-Pro均无剩余,但随着底物浓度的提高,L-Pro有效转化率逐步下降。针对E.coliKaPH1高底物浓度下有效转化率降低和底物的异常消耗现象[27],还需从代谢角度分析并对菌株进行进一步的工程改造,以满足工业化生产需求。
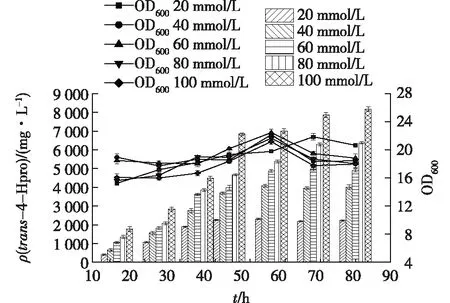
图8 底物浓度对trans-4-Hpro的合成及生物量的影响Fig.8 Effects of substrate concentration on the synthesis of trans-4-Hpro and biomass
3 结论
基于已报道的P4H的基因序列,采用功能酶基因探矿方法,挖掘获得可以高效羟基化L-Pro的新型羟基化酶KaPH1,对E.coliKaPH1转化体系合成trans-4-Hpro进行过程优化,将产量提高了18.5%。为了拓展新酶KaPH1的高效利用,将产酶和催化过程耦联并调控,添加100 mmol/L的L-Pro作为底物,有效转化率可达到60%,OD600可达到20以上。通过过程调控,提高了新酶资源的高效利用,为生物合成trans-4-Hpro高效转化体系的建立提供理论和实践基础。

