细胞工厂氧化还原状态的荧光探针检测与调控
俞 杰,秦 磊,许 可,冯旭东,李 春
(北京理工大学化学与化工学院,北京100081)
氧化还原反应(redox reaction)是一类氧化剂和还原剂之间发生电子转移的反应,贯穿细胞的整个生长代谢过程。氧化还原状态是表征细胞生理状态的一项重要指标。在正常情况下,细胞内的氧化还原反应维持在一个平衡状态,随着外界条件的变化或细胞自身的代谢失衡,细胞内的氧化还原状态会发生改变,细胞内活性氧(ROS)大量累积,造成DNA、蛋白质损伤以及脂质过氧化等,影响细胞结构和功能,严重情况下会造成细胞凋亡[1]。
氧化还原平衡的维持关系着细胞的生长与代谢,氧化还原状态的实时监测以及调控对于研究细胞的生长和高效生物转化具有重要意义。由于复杂的氧化还原系统与调控网络,细胞内氧化还原状态的检测以及调控面临着巨大的挑战。荧光探针信号稳定、检测设备简单等优点成为实时检测细胞氧化还原状态的有力工具。本文中,笔者阐述氧化还原状态与细胞代谢的关联,以荧光探针为主,介绍了检测细胞氧化还原状态的方法,并对调控细胞氧化还原状态的常用方法及其在细胞工厂高效生物转化中的应用进行了总结,展望了氧化还原状态检测及调控的发展趋势。
1 细胞的氧化还原代谢物
细胞内氧化还原反应十分复杂,参与的反应物质种类繁多,氧化还原代谢物按照其反应性质可分为以下3种:以活性氧为代表的氧化剂类、以谷胱甘肽为代表的抗氧化剂类以及以NAD(P)H为代表的辅酶类。
1.1 活性氧

图1 活性氧的产生及转化过程Fig.1 Generation and conversion of reactive oxygen species
1.2 谷胱甘肽

谷胱甘肽是一种小分子三肽,由半胱氨酸(Cys)、谷氨酸(Glu)和甘氨酸(Gly)组成,其中Cys的巯基(—SH)基团是谷胱甘肽的活性基团。谷胱甘肽的生物合成过程如图2所示,先通过由gsh1编码的γ-谷氨酰半胱氨酸合成酶(Gsh1)催化在细胞质中合成γ-谷氨酰半胱氨酸,再由gsh2编码的谷胱甘肽合成酶(Gsh2)催化γ-谷氨酰半胱氨酸与Gly合成谷胱甘肽。虽然谷胱甘肽在细胞质中合成,但是它可以游走于线粒体、细胞核和内质网等各种细胞器。谷胱甘肽在细胞内以还原形式(GSH)和氧化形式(GSSG)两种形式在,GSH被活性氧氧化形成GSSG,GSSG可以通过glr1编码的谷胱甘肽还原酶,用NADPH作为还原力量供体被还原为GSH(图2)[5]。细胞内的GSH浓度较高(1~13 mmol/L),通常是GSSG的30~100倍。GSH与GSSG之间的平衡,通常可以作为细胞氧化还原状态的表征方式。谷胱甘肽的氧化还原电位(GSH potential,EGSH/GSSG)是量化表征谷胱甘肽氧化还原状态的方式,通常由GSH与GSSG的比例经能斯特方程(EGSH/GSSG=-264+30lg[(c(GSSG)/c(GSH))2])计算得出,一定程度上反映细胞的抗氧化性能[6]。正常状态下细胞内的EGSH/GSSG较低,中点电位在-240 mV左右。由于GSH在不同细胞器之间的分布存在差异,因此各个细胞器之间的EGSH/GSSG也各有不同,线粒体中EGSH/GSSG的中点电位大约为-280~-250 mV,细胞质的中点电位为-290 mV,内质网由于要维持氧化状态,中点电位约为-185 mV[7]。由于谷胱甘肽重要的抗氧化作用,常用作细胞工厂抗氧化改造的靶点。
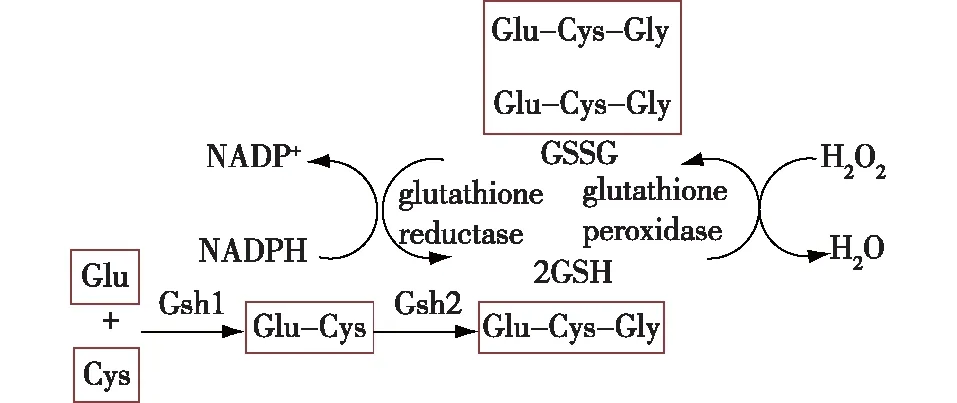
图2 谷胱甘肽的合成及氧化还原Fig.2 Synthesis and redox of glutathione
1.3 NAD(P)+和NAD(P)H的浓度和比例
烟酰胺腺嘌呤二核苷酸(NAD)是参与细胞内多种反应的关键辅酶,主要作为一些氧化还原酶的电子载体发生作用,还能够经NADH激酶(NADH kinase)催化合成另一种重要的辅酶烟酰胺腺嘌呤二核苷酸磷酸(NADPH)[8]。NADPH参与许多氧化还原过程的调节,包括两大抗氧化系统的反应等。
GSSG转化为GSH时需要NADPH提供还原力,硫氧还蛋白也需要NADPH作为还原剂维持其氧化还原平衡[9]。但NADPH氧化酶也可以催化NADPH氧化的同时产生ROS[10]。因此,NADP+/NADPH是重要的氧化还原信号。
NADH和NADPH对于ROS的产生和清除是至关重要的。NADH作为生物氢的载体和电子供体,除了在线粒体内膜上通过氧化磷酸化过程,转移能量供给ATP合成以外,有可能将电子转移至O2产生ROS;NADPH在维持抗氧化防御方面起主要作用,但在某些组织中也可作为自由基生成反应的辅助因子。两种辅酶都充当“电子载体”,在细胞内发生的氧化还原反应之间传递还原力。它们都可以通过接收电子,产生还原形式的NADH或NADPH。两者之间的作用错综复杂(图3),都是重要的氧化还原状态的表征信号。

图3 NADH及NADPH的氧化还原代谢Fig.3 Redox metabolisms of NADH and NADPH
1.4 氧化还原状态与细胞代谢
氧化还原状态与细胞的能量代谢、生长代谢以及合成与转化息息相关。其中,活性氧能参与细胞的免疫应答,在病原体侵入细胞时,活性氧能够作为第二信使调控免疫相关基因的表达,并启动某些基因的转录进而启动相应的凋亡程序[3]。此外,活性氧还与细胞壁中糖蛋白交联过程有关,有助于识别病原体,启动相应的防御程序[11]。虽然活性氧是细胞免疫反应的信号分子,但是活性氧的过度累积会危及生物体的结构和功能。例如攻击蛋白质的氨基酸残基形成分子内或分子间非极性作用,进而影响其构象和功能[12]。H2O2能够发生跨膜作用,与相应的大分子反应,导致脂质过氧化、DNA双链的断裂和蛋白质结构的损伤等[13]。
谷胱甘肽除了作为抗氧化剂清除细胞内的活性氧外,其氧化形式与还原形式之间的比例决定了一些蛋白质中半胱氨酸的状态,进而影响了这些蛋白的结构和功能,GSH的大量消耗和蛋白质的谷胱甘肽化修饰是细胞凋亡的关键调节因子,在细胞的衰老及凋亡中作为细胞标志物[14]。
NAD+/NADH的变化影响着众多的生理过程。例如,通过调节细胞质中NAD+/NADH比例,能调节糖酵解反应的速率。在线粒体中,作为还原力的主要供体,NADH可以经呼吸链氧化为细胞提供能量。此外,NAD+/NADH还影响细胞内的信号传导和一些大分子生物合成等。NADP+/NADPH主要在磷酸戊糖途径(PPP途径)中起作用,还与一些信号传导途径的调节以及二氢叶酸、脂肪酸等生物大分子的合成有关[15]。
对细胞工厂的氧化还原状态进行精细调控不仅要了解细胞的氧化还原代谢过程,而且对于氧化还原状态的监测方法也有着较高的要求。研究者尝试使用电子自旋共振、拉曼光谱、免疫吸附及核磁共振等方法检测细胞内的活性氧[16-18],使用酶联免疫、液相色谱或电化学方法等测定细胞的谷胱甘肽氧化还原电位[19-21];使用色谱法、电化学法、毛细管电泳法以及代谢物间接指示法来检测NADP+/NADPH等[22-25]。
这些方法能够较为准确地反映相关信号,但是都存在固有的局限性,即破坏了细胞或生物体的完整性,无法在活细胞内实时反映氧化还原状态。荧光探针法由于其信号稳定、设备简单且能够实现实时原位检测等优点受到了青睐。
2 检测氧化还原状态的荧光探针
氧化还原反应代谢物中,NAD(P)H存在微弱的自发荧光,可以用于评估线粒体的状态,但在细胞质内浓度较低,无法相互区分且波长较短,极大可能干扰细胞的氧化还原代谢,利用荧光寿命成像技术(FLIM)可以区分结合形式的NADH和NADPH[26],但是该方式对精密仪器和复杂计算的要求较高,很难广泛应用于实验室研究。因此,化学荧光探针和遗传编码的荧光探针更适用于基础的实验室研究。
2.1 化学荧光探针
检测氧化还原状态的化学荧光探针大多具有能与信号分子结合的识别基团以及发出荧光信号的基团,发出荧光的强度反映氧化还原状态。化学荧光探针种类较多,目前用于活细胞ROS检测的最常用探针是二氯荧光素(DCFH-DA)、罗丹明123(DHR123)和氢化乙啶(HE)[27],用于检测谷胱甘肽的化学荧光探针则包括5,5′-二硫代双(2-硝基苯甲酸)(DTNB)探针、基于吖啶橙的荧光探针等[28],有研究通过外源添加GSH还原酶与辅酶,同时定量GSSG和GSH以实现EGSH/GSSG的测定,但是该方法操作较复杂,不适合基础实验使用[29]。检测NAD(P)H的化学探针则大多需要先对细胞进行破碎提取,因此不适合实时反映细胞内的状态变化。
化学荧光探针特异性较好、信号稳定且荧光强度较强,但不可避免地具有一定的细胞毒性,难以实现氧化还原状态的区域化检测以及实时动态在线成像,遗传编码的荧光蛋白则是细胞氧化还原状态实时检测最有前景的工具。
2.2 遗传编码的荧光蛋白探针
遗传编码的荧光蛋白探针根据其作用机制可以分为基于循环置换荧光蛋白家族(cpFPs)的探针、氧化还原敏感的荧光蛋白探针(roFPs)以及荧光共振能量转移型荧光探针(FRET)这3种。
2.2.1 基于循环置换荧光蛋白的探针
循环置换型荧光蛋白是将普通荧光蛋白的N端和C端经过互换并用一个短肽接头重新连接形成的荧光蛋白,这些改造使得荧光发色团的位置发生变化,容易感受外界条件的变化,从而发生相应的构象变化[30]。常见的循环置换型的荧光蛋白主要有循环置换的黄色荧光蛋白(cpYFP)和循环置换的红色荧光蛋白(cpRFP)。利用循环置换荧光蛋白易于感知外界条件变化的特性,将其插入到氧化还原转录因子当中可以实现一系列氧化还原代谢物的检测。目前应用较为广泛的主要是特异性检测H2O2的比率型探针荧光探针HyPer(H2O2)、检测NADH水平的Frex探针和SoNar探针等。
HyPer探针是将cpYFP插入到大肠杆菌转录因子OxyR的调节结构域中形成的[31],该探针表面有2个Cys可以被氧化形成二硫键,构象的改变使cpYFP在420 nm的激发光下荧光强度降低、500 nm激发时荧光强度升高,荧光强度的比值随H2O2浓度的增加而增加。为了获得更高的灵敏度和动态范围,Bilan等[32]通过突变HyPer的OxyR-RD 得到了HyPer-2和HyPer-3。HyPer-2是HyPer的Ala406Val突变体,动态范围扩展,但反应速率较低,有较大的缺陷;HyPer-3是HyPer的His34Tyr突变体,突变后动态检测范围与HyPer-2相近,但反应速率提升。在这3种探针中,HyPer-3的动态检测范围广,反应速率适中,更可能获得广泛的应用[32]。为了扩展Hyper荧光探针的光谱范围,用循环置换的红色荧光蛋白cpRFP替换cpYFP产生了Hyper Red荧光探针,该探针的反应速度更快、灵敏度更高,但作为一个强度型荧光探针,Hyper Red易受到环境干扰,较难实现H2O2的稳定测量[33]。HyPer系列探针的光谱特征和特点见表1。
Frex探针是将cpYFP插入来自枯草芽孢杆菌的转录因子B-Rex二聚体的亚基之间形成的,Rex上有与NADH特异性结合的区域,能够响应NADH变化[34]。Frex探针的缺点是对pH的变化敏感,使用时需要对pH进行控制。SoNar是将cpYFP插入去除DNA结合结构域的T-Rex单个亚基中形成的,利用Rex单亚基与NAD+和NADH结合能力的强弱不同形成NAD+/NADH的比率探针[35]。SoNar的亮度和动态响应范围是cpFP系列荧光探针中最大的(~15倍),应用最为广泛,但是它无法表征细胞内总NAD的量,因为其对细胞内生理pH的变化敏感,在使用时需要控制体系pH或设置相应对照。
除了通用的几种探针以外,还有将cpYFP插入到T-Rex的单个亚基中形成的RexYFP探针。与Frex不同,RexYFP荧光信号的变化是由T-Rex蛋白的一个亚基内的构象重排引起的。RexYFP是一种强度测量探针,在490 nm处具有单个激发峰,在516 nm处具有发射峰。 NADH的结合诱导指示剂荧光降低2倍。因此,该指示适用于反映细胞中NAD+/NADH的动态变化,不适合测定总NADH水平[36]。RexYFP的缺点在于荧光较弱且易受到pH的影响。Peredox探针则是将循环置换宝石蓝荧光蛋白T-Sapphire插入到来自嗜热杆菌转录因子NADH结合结构域T-Rex两个亚单位之间构建而成,通过定点突变消除了探针的pH敏感性[37]。Peredox是一种强度计指示剂,在400 nm处具有单个激发峰,在510 nm处具有发射峰。为了开发具有比率读数的探针,Peredox分别与红色荧光蛋白(mCherry)和黄色荧光蛋白(mCitrine)融合,获得新的比率型荧光探针[38],Peredox的主要优点是它不受pH影响,能够抵抗生理范围内的pH变化,缺点是容易氧化饱和,因此只适合于细胞质和线粒体的检测。
综上所述,基于循环置换蛋白的探针性质和特点见表1。

表1 基于循环置换蛋白的探针性质和特点
2.2.2 氧化还原敏感的荧光蛋白家族
氧化还原敏感的荧光蛋白(roFP)是在通用的荧光蛋白基础上经突变引入2个半胱氨酸残基形成的。当细胞内氧化还原状态发生变化时,2个Cys残基经氧化形成二硫键,使得蛋白质的质子化状态发生变化,影响发光基团。目前应用最广泛的氧化还原敏感型绿色荧光蛋白roGFP是将增强型绿色荧光蛋白(eGFP)β链上的S147和Q204突变为Cys后形成的[39]。roGFP经氧化后,2个Cys残基形成二硫键,构象重排使得激发波长发生变化,在405 nm处激发的荧光强度下降,而488 nm处激发的荧光强度增强,二者比值的改变能够反映氧化还原状态的变化[39]。roGFP的检测反应时间较长、还原性较强、易于过氧化,因此检测范围有限,更适用于氧化强度较低的亚细胞结构,如细胞质、线粒体等。研究者通过C48S和S65T两处点突变,获得了更高强度且具有更高动态范围的roGFP2,但仍未解决roGFP2检测速度慢和特异性较差的问题[39-40]。
将roGFP2与氧化还原相关酶的融合这一策略为roGFP2选择性和灵敏度的提升以及广泛应用提供了新的视野。将roGFP2酵母过氧化物酶Orp1实现了细胞内H2O2的特异性检测[41],为了提升灵敏度与反应速度,Morgan等[42]将roGFP2分别与酿酒酵母的所有过氧化物酶融合,最终筛选获得了较高灵敏度的过氧化物酶Tsa2,再经过单个氨基酸突变提高了反应速度。除了融合过氧化物酶检测H2O2,融合谷胱甘肽氧化还原酶Grx1特异性检测谷胱甘肽也是一个很好的研究方向,其反应原理是通过GSSG与Grx1反应,再经过分子内重排产生二硫键,改变蛋白的构象,进而影响激发波长[43]。Grx1与roGFP2的融合提升了检测的灵敏度和反应速度,但是没有影响roGFP2的光谱特征,而且Grx1-roGFP2对谷胱甘肽氧化还原电位具有高度特异性,不与硫氧还蛋白系统发生反应,是优良的EGSH/GSSG检测器。
除了roGFP以外,还有一系列基于相同原理开发的荧光蛋白探针。例如,roCherry是将红色荧光蛋白mCherry的150Ala和203Lys突变为Cys后形成的,再与Grx1融合可以实现谷胱甘肽的特异性检测;Grx1-rocherry的激发和发射波长分别为589和610 nm,中点氧化还原电位为-310 mV。该荧光探针的亮度较高且具有pH稳定性[44],是检测活细胞EGSH/GSSG很有潜力的工具。
氧化还原敏感的黄色荧光蛋白(rxYFP)中相邻的β链上有2个Cys残基,可以与GSSG发生反应,再经过分子内重排形成二硫键导致荧光强度降低。rxYFP是一个强度指示性的荧光探针,最大激发波长在512 nm处,最大发射波长在523 nm处[45]。rxYFP的中点氧化还原电位为-261 mV。因为生理条件下,细胞内EGSH/GSSG为-270~-120 mV,所以rxYFP能够检测细胞内大多数的EGSH/GSSG变化[45]。rxYFP已成功用于监测酵母和哺乳动物细胞中不同亚细胞区室中谷胱甘肽的氧化还原状态,如细胞质、细胞核、线粒体基质和线粒体膜间隙[46-48]。rxYFP的缺点是对细胞内生理pH变化和Cl-具有敏感性。
综上所述,氧化还原敏感的荧光蛋白的性质和特点见表2。

表2 基于氧化还原敏感的荧光探针性质和特点
2.2.3 基于FRET的荧光对
荧光共振能量转移(FRET)是2个相邻生色团之间的非辐射能量传递过程。当供体生色团和受体生色团之间的距离发生改变时,荧光的情况也会发生相应的变化。检测氧化还原的荧光对通常是由一段含有2个Cys残基的多肽链连接形成的,在氧化条件下,2个Cys形成分子内二硫键,FRET供体和受体之间的距离发生改变,从而使得荧光发生变化。最经典的FRET荧光对是ECFP和EYFP,通过改变荧光对之间的接头,开发出了一系列灵敏度各不相同的探针。最初,Lam等[49]利用酿酒酵母转录因子能够感知氧化还原状态的特点,选择其感知区域作为多肽接头,开发了感知谷胱甘肽氧化还原电位的荧光探针。为了提升反应速度,将半胱氨酸残基随机插入EAAAK重复序列的多肽中,筛选出一种名为RL5的多肽作接头,可以迅速响应氧化还原状态变化[50]。而为了扩展荧光对的动态范围,人们开发了clover和mRuby2,它们是迄今为止最亮的绿色和红色荧光蛋白对,用带有Cys的多肽将它们连接,并通过分子模拟选择最合适的反应距离,开发的clover-mRuby2探针具有响应EGSH/GSSG的能力[51]。基于FRET还开发了一系列检测辅酶含量和比例的探针,如NADP+/NADPH探针Apollo-NADP[52]、NADP+荧光探针NADPsor[53]及NAD+荧光探针ligA-cpVenus[54]等。但是这些探针由于动态范围较小、反应条件苛刻等原因,目前应用范围较窄。
虽然基于FRET的荧光探针发展迅速,但是该类荧光探针的稳定性和敏感性都不够高,而对检测条件要求较高,目前在氧化还原状态的测定上尚未获得普遍应用。
2.2.4 基于转录因子的荧光探针
基于转录因子的荧光探针是利用转录因子能与相应代谢物结合的特性[55],构建基因线路,使得转录因子与代谢物结合后,启动下游基因转录实现相应的检测。例如,Zhang等[56]和Liu等[57]分别利用酿酒酵母转录因子Yap1和大肠杆菌转录因子Rex设计基因线路实现NAD+/NADH的检测。这一类荧光探针无需对荧光蛋白结构进行改造,但是在不同的细胞中需要选择不同的转录因子重新进行线路设计,不具有普适性。
3 氧化还原状态调控在细胞工厂中的应用
氧化还原的平衡能够使得细胞处于良好的生理状态,对细胞工厂稳定生长以及生物燃料、生物医药、化学品的高效合成具有重要意义。因此,对氧化还原状态的调控是实现细胞工厂高效生产的有效途径。早期由于实验条件的限制,大多通过增加溶氧或改善发酵条件的方式来实现氧化还原状态的调控。随着生物技术的发展,氧化还原状态的检测方法更加多元化,基因编码的荧光探针也在研究氧化还原的机制和原理上发挥着重要作用。而氧化还原代谢机制的深入发展使得对细胞氧化还原状态实现更精细有效的调控成为可能。目前常用的调控细胞工厂氧化还原状态的策略主要包括对细胞抗氧化系统、氧化还原相关转录因子、氧化还原关键的辅酶等的调控。
3.1 抗氧化系统的调控
改造细胞的抗氧化系统是调节细胞工厂氧化还原状态最直接也是最有效的方式。Xu等[58]通过在酿酒酵母中导入植物及极端微生物来源的抗氧化酶构造了一种人工抗氧化防御系统,实现了酿酒酵母的耐热性以及乙醇产量的提升,乙醇产量与对照相比提升了66%,还通过DCFA-HA探针检测了细胞内的ROS,证明了氧化防御系统在维持线粒体和细胞膜完整性上具有明显作用。另外,过表达谷胱甘肽合成途径的关键基因gsh1、cys3和glr1也可以调节细胞的氧化还原状态,增加GSH的含量和比例,进而减轻木质纤维素水解副产物在发酵中的抑制作用,使得菌株的鲁棒性和发酵性能提升,而谷胱甘肽的含量以及EGSH/GSSG的测定则是由DTNB荧光探针来完成的[59]。Xu等[60]在产油酵母中的研究证明,谷胱甘肽还原酶以及相关脱氢酶的过量表达能够改善酵母细胞的形态,促进脂质的高效合成,细胞含油量达到81.4%,产量接近工业生产需求。
此外,引入外源的谷胱甘肽合成和还原路径,也是调控细胞氧化还原状态、实现细胞工厂抗胁迫性能和生产性能的有效方法[61-62]。除了调节细胞酶促抗氧化系统,也可以引入外源抗氧化剂合成途径实现氧化还原状态的调节以及细胞工厂的高效生物转化。例如,番茄红素作为抗氧化剂被广泛用于食品药品行业,在酵母中引入异源番茄红素合成途径不仅可以通过积累番茄红素来增加细胞活力,还可以提高厌氧发酵过程中乙酸耐受性和乙醇生产水平[63]。这一系列的研究结果中,抗氧化系统的改造对于提升细胞的抗胁迫性能和产能有着重要的意义。
3.2 辅酶调控
NAD(P)+和NAD(P)H不仅与氧化还原代谢有关,还耦联细胞的碳代谢和能量代谢,参与的代谢网络复杂。基因编码的荧光探针能够实现细胞内辅酶水平的实时监测,分析辅酶的代谢机制和影响辅酶的因素,进而对参与氧化还原的辅酶进行精准的调控[64]。根据辅酶的代谢机制,调控辅酶的策略主要有以下几种。
1)敲除辅酶竞争途径是一种增加辅酶可用性以驱动目标代谢物形成的有效方法。在糖酵解中,NADH的消耗与多种产物的生物合成有关,包括乙醇、乳酸盐和某些氨基酸等。Saini等[65]研究发现,通过敲除乳酸脱氢酶的基因ldh或激活丙氨酸脱氢酶的基因ald,可以让更多的NADH驱动大肠杆菌中丙二醇、丁醇和其他醇的产生。而敲除编码乙酸激酶和乳酸脱氢酶的基因,并过表达编码丁酸激酶的基因可以更多地生产丁酸盐[66]。
2)调节辅酶合成或再生途径的关键酶也可以调节辅酶的状态,影响细胞状态和产量。例如,将NAD再生途径引入工程化生产异丁醇的大肠杆菌中,由于NADH水平的增加,提升了糠醛耐受性,从而提高了其发酵生产能力[67]。Wu等[68]研究表达了多种不同来源的NADH脱氢酶,提升了NADH的再生能力,实现了赖氨酸在谷氨酸棒杆菌中的高效生产。而在植物甾醇发酵系统中,通过添加NAD的前体以及表达来自短乳杆菌的NADH氧化酶,改善了NAD+和NADH在细胞内的比例,使得工程菌株甾醇的转化率最终提高了147%[69]。通过突变磷酸戊糖途径中的葡萄糖-6-磷酸脱氢酶和6-磷酸葡糖酸脱氢酶,降低它们对细胞内代谢物抑制剂的敏感性,可以富集细胞内的NADPH,得到的谷氨酸棒杆菌甲硫氨酸产率提高了53.2%[70]。
3)改造天然辅酶的特异性也可以调节氧化还原平衡。用来自枯草芽孢杆菌的NADP+依赖性的甘油醛-3-磷酸脱氢酶取代谷氨酸棒杆菌内源的NAD+依赖性甘油醛-3-磷酸脱氢酶,提高了细胞内NADPH的水平,使得NADPH依赖性化合物的合成水平获得了提高[71]。利用辅酶结合的特异性对辅酶进行修饰也可以调节细胞的氧化还原平衡。通过对谷氨酸棒杆菌甘油醛-3-磷酸脱氢酶的NADH结合区域的保守序列进行突变[71],或者引入非天然的异柠檬酸脱氢酶基因idh都实现了L-赖氨酸产量的提高[72]。在能够生产L-乳酸的酿酒酵母工程菌株中敲除细胞质的NADH脱氢酶,提高了细胞内NADH的水平,工程菌株在酸性条件下L-乳酸产量实现了32.6%的提升[73]。
综上可知,基因编码的荧光探针检测辅酶水平的变化与代谢工程方法调控辅酶结合在实现细胞工厂的高效生物转化过程中有着重要意义。
3.3 转录因子调控
细胞内氧化还原相关的转录因子除了用于开发相应的生物传感器以外,还可以作为智能精细调控细胞工厂生物转化的有力工具。酵母中氧化还原相关转录因子Yap1的过表达能够促进氧化防御相关基因的转录,提高细胞的抗氧化能力,减少氧化应激引起的蛋白质错误折叠,从而提高细胞分泌蛋白的能力[74]。而氧化应激调节转录因子Ybp1的过表达能够消除ROS,增强细胞活力最终在酵母细胞工厂中实现人参二醇的高效生产[73]。Zhang等[75]利用转录因子Rex上调idh的表达,idh可以调节NADH/NAD+的比例,最终实现丙酮和丁醇的高效生产。大肠杆菌的转录调节因子Hdfr可以显著提高NADPH的利用率,加强NADPH依赖性谷氨酸合成[76]。这些研究表明,氧化还原相关转录调节因子是一种调控氧化还原状态的有效方法。
4 结论与展望
氧化还原状态的调控在开发生产生物燃料、生物医药以及生物基化学品的细胞工厂中发挥了重要的作用,优良的检测方法是进行精确调控的基础。基因编码的氧化还原探针飞速发展,其灵敏度与检测限都在不断提升,更是开发出了能够定位于不同细胞器的氧化还原荧光探针。但是其检测原理较为单一,大多基于半胱氨酸氧化形成二硫键,改变荧光蛋白的构象,而且由于基因编码的荧光探针需要对宿主细胞进行基因操作,不可避免对细胞工厂的代谢产生影响。
随着新一代测序和基因操作的发展,细胞工厂的代谢机制将会更加清晰。检测氧化还原反应的荧光探针不仅需要更快的反应速度与灵敏度,还需要更加广泛的监测范围,能够监测更多的氧化还原相关的代谢物和反应,更需要扩展现有荧光蛋白的光谱特征,不能仅局限于常见的红色和绿色荧光,红外领域也可以作为开发的目标。同时,荧光探针方法还可以与电子自旋共振、电化学等方法相结合,综合表征细胞的氧化还原状态。氧化还原状态作为重要的生理指标,其监测与调控都需要更多的研究探索,进而在工业微生物中进行精准有效的调节,减少冗余的基因线路带来的负担,实现细胞工厂中目标产物的高效生产。

