基于细菌裂解酶的功能性生物材料及其应用
吴 瑕,龚国利,查 健
(陕西科技大学食品与生物工程学院,陕西西安710021)
抗生素是对抗细菌感染的有力武器,其广泛使用拯救了无数生命,也极大提高了人类生活水平。然而,抗生素的过度使用已引发一系列严重问题,包括耐药菌甚至“超级细菌”的涌现。此外,作为典型的广谱抗菌药物,抗生素的使用易引起人体肠道菌群失调。为此,新型高效窄谱抗菌剂的开发具有重要的医学及社会价值[1]。
噬菌体疗法起源于20世纪20年代,但由于质控困难,被抗生素疗法逐渐替代[2]。近年来,伴随着耐药细菌的肆虐,噬菌体疗法以其高效性再次引起关注[3-4]。然而,噬菌体具有潜在的生物安全隐患,现有技术难以保证其效用的稳定发挥,不利于该方法的推广[4-5]。噬菌体杀菌作用的发挥主要取决于其所产生的噬菌体裂解酶,一类细菌细胞壁水解酶。相比于噬菌体,酶的可操作性及可控性较强,稳定高效酶制剂的制备相对容易[4]。目前,噬菌体裂解酶以及其他细菌细胞壁水解酶(统称细菌裂解酶)在小鼠、兔子等动物模型中已展现出优异、专一的抗菌性能。这些酶对耐药菌株有效,且不易诱发菌体抗性,被视为抗生素的一种可能的替代品[1,6-8]。本文中,笔者简要介绍以细菌裂解酶为基础的功能性生物材料的制备及其在食品加工、病原细菌检测、医药卫生等方面的应用。
1 细菌裂解酶
细菌裂解酶(bacteriolytic enzymes,lytic enzymes)是一类天然存在的高特异性细菌细胞壁水解酶,通过高效识别并降解特定结构的细胞壁肽聚糖,引起细菌快速破裂、死亡[1]。虽然肽聚糖在不同物种间具有相似的基本结构,然而,不同细菌、甚至同种细菌的不同菌株之间,在肽聚糖的交联度、肽链的组成及链长、糖链的组成单元、低丰度糖单元的含量及排列方式等方面有显著差异[9],此差异可保证细菌裂解酶的高选择性,即一个酶只裂解一种或少数几种细菌。
细菌裂解酶按照活性可分为糖苷酶、酰胺酶和肽酶三大类[1,6]。糖苷酶断裂糖苷键,按照其作用位点可分为氨基葡萄糖苷酶(1)(降解从N-乙酰葡糖胺到N-乙酰胞壁酸的β-1,4糖苷键)、N-乙酰胞壁质酶(2)(溶菌酶,可降解从N-乙酰胞壁酸到N-乙酰葡糖胺的β-1,4糖苷键)、裂解性糖基转移酶(3)(切断从N-乙酰胞壁酸到N-乙酰葡糖胺的β-1,4糖苷键,并在N-乙酰胞壁酸形成一个分子内糖苷键,严格意义上不属于水解酶)[6]。酰胺酶(4)作用于N-乙酰胞壁酸与肽链相连部位的酰胺键。肽酶(5)主要为内肽酶活性,作用于与糖链相接的肽链,或者两条肽链交联形成的肽桥(图1)。
细菌裂解酶按照来源划分,主要分为病毒相关裂解酶(virion-associated lysin,VAL)、噬菌体裂解酶(endolysin)、细菌自溶素(autolysin)和Ⅲa类细菌素(bacteriolysin)四大类[1]。病毒相关裂解酶作用于噬菌体侵染初期,在局部降解细菌细胞壁,协助噬菌体将其基因组注入宿主细胞。此类酶通常为噬菌体的结构蛋白,分子量大,且热稳定性强[10-11]。噬菌体裂解酶作用于侵染末期,从宿主细胞内部降解细胞壁,使子代噬菌体得以释放[12-13]。细菌自溶素由细菌产生作用于自体,在细胞壁的合成、更新、重构以及细胞分裂等方面发挥重要作用[14]。Ⅲa类细菌素由一种细菌产生并分泌到胞外,作用于有竞争关系的另一种细菌,以抑制其生长[1,15]。
对抗革兰氏阴性菌的细菌裂解酶具有多样化的结构。相比之下,对抗革兰氏阳性菌的细菌裂解酶通常具有较为规整的模块化结构,其N端具有至少一个催化域(catalytic domain),可选择性地切断肽聚糖的某一特定化学键;C端具有至少一个底物结合域(cell wall-binding domain,CBD),可特异性地识别并结合具有特定结构的肽聚糖[1]。两个区域互补却互不干扰,可独立存在并保持各自功能,这一特性有利于细菌裂解酶的嵌合化改造[16]。目前,已有诸多研究将不同细菌裂解酶的活性域和底物结合域进行随机组合,创造出自然界中不存在的、具有新型细胞壁裂解活性或新型底物特异性的嵌合酶[17-20]。

图1 细菌细胞壁结构及细菌裂解酶作用位点Fig.1 Schematic diagram of bacterial cell wall structure and the cleavage sites of various bacteriolytic enzymes
2 基于细菌裂解酶的功能性生物材料的制备
目前,基于细菌裂解酶的应用研究主要集中于噬菌体裂解酶和Ⅲa类细菌素两大类。这些酶大多稳定性差,无法耐受蛋白酶、表面活性剂、持续加热等处理,故而在实际生产生活环境中的应用受到极大限制。通过固定化的方法将酶结合于特定材料表面或内部,一方面可提高酶稳定性,拓展其使用范围,另一方面可赋予这些材料特殊的生物学功能,使其成为功能性生物材料。对于细菌裂解酶与材料的结合,常用的固定化方法为包埋、共价结合以及亲和配基结合(图2)[21-23]。
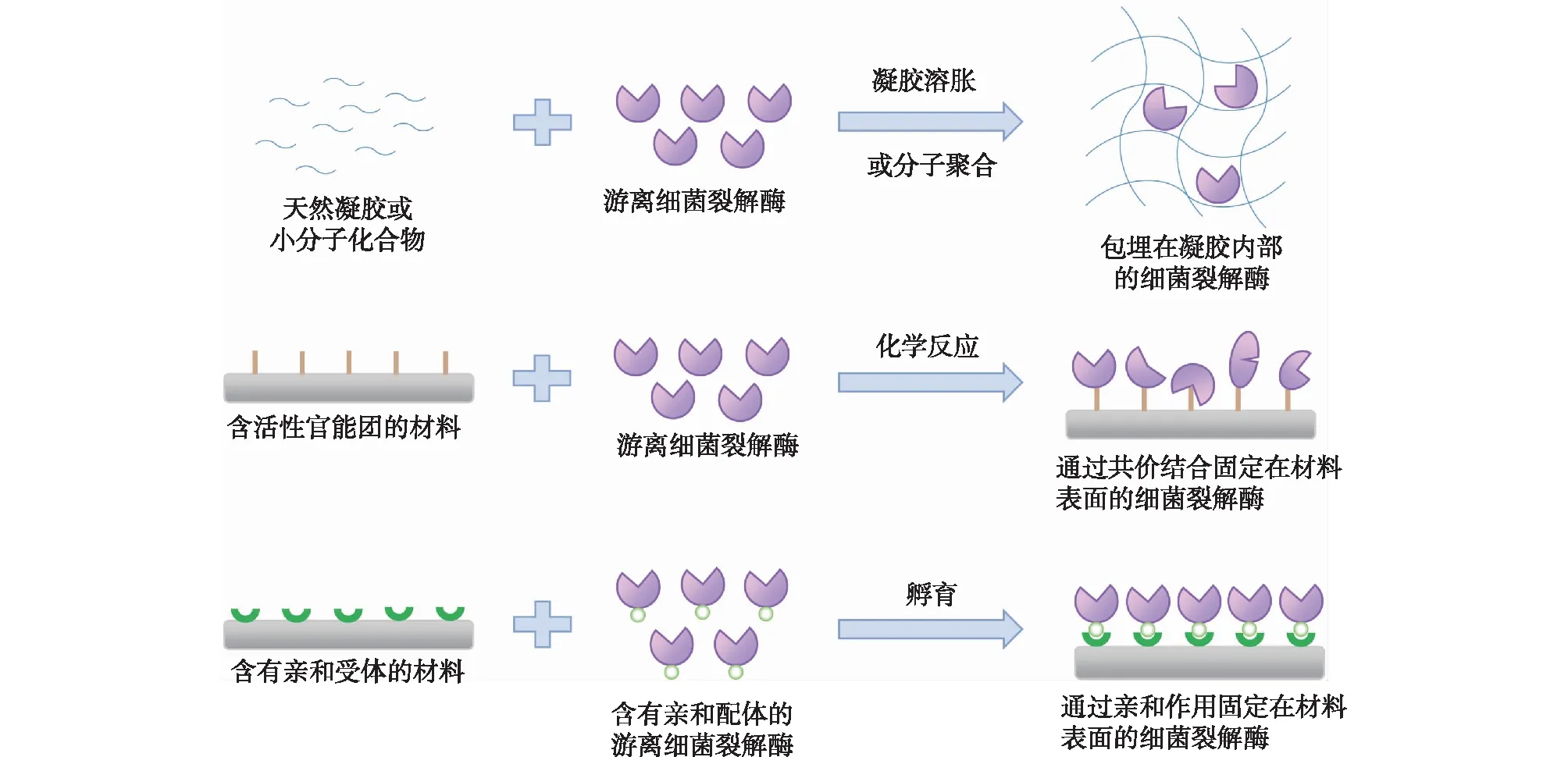
图2 细菌裂解酶的常用固定化方法Fig.2 Commonly used strategies for immobilization of bacteriolytic enzymes
包埋式固定化利用凝胶或高分子聚合物等材料的溶胀或聚合性质,将酶分子包裹在多孔载体内部,可有效保持酶分子的结构和功能完整性,防止其与蛋白酶等有害物质接触(图2)。当酶促反应的底物或产物是大分子时,扩散成为主要的限制性因素,故孔隙率的优化至关重要[24]。细菌裂解酶的底物为细菌细胞,具有微米级尺寸且不溶于水,因此,细菌裂解酶的包埋式固定化多被作为可控释放体系,使固定化的酶与细胞实现物理隔离,而受到应激释放的酶可与细胞保持良好接触,从而发挥其抗菌功效。例如,噬菌体裂解酶LysK的活性域CHAPk以及Ⅲa类细菌素溶葡球菌酶(lysostaphin,Lst)可高效对抗金黄色葡萄球菌(Staphylococcusaureus,金葡菌)。这两种酶被包埋在温敏型聚N-异丙基丙烯酰胺材料中,在36 ℃时材料融化,释放出的酶可快速杀死金葡菌[25]。
传统的共价结合法利用酶分子上的活性官能团(—OH、—NH2等)与固定化载体上的化学基团进行反应,形成共价键,使酶分子紧密固定在材料上。该方法结合力强,酶分子不易脱落,可用于复杂环境下(变性剂、表面活性剂或强酸强碱等物质存在时)的酶促反应(图2)[21,26]。然而,活性官能团在酶分子氨基酸侧链上分布广泛,因此,固定化位点杂乱且不可预测,导致酶结构改变、活性下降[27-28]。细菌裂解酶多具有特殊的模块化结构,且其作用底物为细菌细胞,酶分子需要保持足够的柔性,以便与底物有效结合。为此,可在载体和酶分子之间引入适当长度的连接体[29-30]。Pangule等[31]在羧基修饰的多壁碳纳米管上共价固定Lst,发现酶的抗金葡菌活性几乎丧失。通过在酶与碳纳米管之间引入聚乙二醇连接体,酶活性极大提高。然而,连接体的嵌入依赖化学反应,嵌入位点随机,使得同一批次固定化酶的结构及固定方式不均一。
利用亲和配基进行非共价强相互作用结合,是近年发展起来的一种新型表面固定化方法。亲和配基可通过基因工程的方法便捷精确地添加于酶分子的任何所需位置,与含有对应受体的材料通过亲和作用形成紧密结合,可最大限度保持酶结构的稳定(图2)。该固定化过程可在温和条件下通过孵育完成,对酶分子无变性作用[32-36]。如需在酶与亲和配体之间引入连接体,可在基因层面加入适当长度的连接肽基因,保证酶分子的柔性,防止亲和配基或受体对酶结构造成干扰。较常用的亲和配基有组氨酸标签、材料结合肽等。Yerosiavsky等[37]将带有C端组氨酸标记的Lst与聚多巴胺修饰的玻璃片在磷酸缓冲液(pH 7.4)中孵育48 h,即可实现Lst在玻璃材料表面的有效固定及其活性的有效保持。Wu等[38]将Lst的C端融合SiO2结合肽,与玻璃片在室温条件下在含有400 mmol/L NaCl、0.3% (体积分数) Tween 20的磷酸缓冲液(pH 7.4)中孵育1 h,可将Lst固定于玻璃表面。然而,直接固定的Lst活性丧失严重。通过添加柔性连接肽,固定化的Lst可在3 h内实现99.99%的杀菌率,比游离酶或不加柔性连接肽的固定化酶具有更高的热稳定性和pH稳定性[38]。
3 细菌裂解酶基生物材料的应用
将细菌裂解酶固定于材料表面或内部,制备细菌裂解酶基生物材料,在保证抗菌活性及特异性的同时,还可有效稳定酶的结构及功能,极大地拓展了其应用范围,在食品检测与加工、疾病诊疗、环境除菌等方面有良好的应用前景。
3.1 食品加工
食品中常见的一种污染性致病细菌为李斯特杆菌,其感染可在短时间内引起死亡,因此,多国的食品监管机构都对其实行“零容忍”。为提高食品加工过程的安全性,减少李斯特杆菌污染,Solanki等[39]选取由美国FDA批准可在食品行业使用的硅纳米颗粒(silica nanoparticles,SiNPs),将李斯特杆菌(Listeriamonocytogenes)裂解酶Ply500共价结合于其表面,制成Ply500-SiNP复合材料,可有效清除游离的李斯特杆菌。进一步将Ply500-SiNP包埋于聚甲基丙烯酸羟乙酯,形成选择性抗菌膜,既可杀死游离的李斯特杆菌,又可抑制其在材料表面或生菜叶片上附着生长,故可用作食品加工设备的涂层,或用于食品包装。此外,该课题组在Ply500的N端融合麦芽糖结合蛋白,利用亲和作用将其固定于淀粉纳米颗粒表面,可在24 h内杀灭99.9%的游离李斯特杆菌。该技术可用于生产可食用的抗菌食品包装材料。
3.2 病原细菌的检测
病原细菌的检测包括定量检测和定性检测。以抗体为核心的定性检测技术通常不能很好地区分同一细菌的不同亚型[40],细菌裂解酶可有效解决这一问题。Loessner课题组的Schmelcher等[41]首先选取了一系列李斯特杆菌裂解酶,可分别识别李斯特杆菌的不同血清型;其次,将这些酶的底物结合域分别融合于不同的荧光蛋白,构建出融合蛋白库。最后,通过同时选用两种融合蛋白,结合荧光显微技术,即可在混菌体系中精确快速地定性检测并有效区分李斯特杆菌的特定血清型。
定量过程通常涉及细菌细胞的富集及计数分析,较常用的方法包括基于抗体的免疫磁珠分离技术以及基于PCR的基因检测技术。然而,前者检测限较高,且常伴有非特异性识别[42],后者不能有效区分死菌和活菌,且检测过程常受到待检样品(如食品、血液)中某些成分的干扰[43]。细菌裂解酶对细菌细胞的高特异性及高亲和力使其在检测领域有良好的应用前景。Kwon等[44]选用金葡菌裂解酶Lst,、炭疽芽孢杆菌(Bacillusanthracis)裂解酶AmiBA2446以及英诺克李斯特杆菌(Listeriainnocua)裂解酶Ply500,将其底物结合域分别加上生物素标签,同时对葡萄糖氧化酶(GOx)进行生物素标记,将两者共结合于链霉亲和素(SA),制成CBD-SA-GOx复合蛋白体系,在混菌体系中与对应菌体结合并与杂菌分离后,可在葡萄糖存在条件下利用产生的H2O2实现相应细菌的快速定量检测,检测限可达到103~104cfu/mL。为进一步提高检测灵敏度并降低检测限,该研究将GOx替换为DNA条码,通过实时荧光定量PCR(qPCR)技术可在混菌体系中检出<10 cfu/mL的特定细菌,在真实样品中(脱脂牛奶、10%人血浆或5%牛肉提取物)保持相同的灵敏度和检测限。这两种检测方法操作简单,可在数小时内完成。
3.3 疾病治疗
目前,着眼于医疗用途的细菌裂解酶基生物材料的开发主要集中于金葡菌感染。金葡菌是一类常见致病菌,其感染可引起伤口脓肿、皮肤大面积溃烂等症状,严重时可导致全身败血症、器官衰竭,甚至死亡。金葡菌极易对抗生素产生耐受性,使得临床治疗周期长、难度大、复发率高。Lst对金葡菌有极强的杀菌效果,故而被广泛用于抗金葡菌生物材料的开发。
Miao等[45]将Lst共价固定于纤维素纳米纤维表面,在体外皮肤细胞模型中可有效清除金葡菌,有望用作消毒绷带,在伤口处预防金葡菌感染。在另一项针对皮肤伤口感染的研究中,Hathaway等[25]利用感染部位皮肤温度由32 ℃升至37 ℃的现象,将Lst和CHAPk包埋在温敏型材料聚N-异丙基丙烯酰胺中,该材料在36 ℃融化,释放出两种细菌裂解酶,可在感染部位迅速杀死金葡菌,达到治疗效果。
对于长期使用体内植入器具(如导尿管)的病人,器具与人体细胞的接触部位为细菌附着生长提供了有利条件,严重危害人体健康。具有银涂层的植入器具可一定程度抑制细菌生长,然而,其长期使用效果欠佳[46-47]。使用非特异性抗菌酶(如可产生H2O2的纤维二糖脱氢酶)作为涂层[48],可破坏植入环境中正常菌群的生长。在一项针对人工植牙的研究中,Nileback等[49]将金葡菌裂解酶PlySs2和SAL-1固定于丝蛋白涂层,可预防金葡菌在涂层上的附着生长。在针对疝病的研究中,Satishkumar等[50]将Lst吸附于聚丙烯材质的疝病修护网表面,一方面可清除周围环境中的游离金葡菌,另一方面可抑制金葡菌的附着,在小鼠模型中亦展现出良好的效果。
3.4 环境除菌
社区、医院和学校等人口密集的公共场所是细菌感染的重要传播源头。保障公共环境清洁卫生,是从源头减少细菌感染的有效方法之一。传统的公共环境消毒采用酒精、甲酸或次氯酸等化学试剂,气味重,且不具有选择性,将有益细菌和有害细菌一并杀灭。在门把手、水龙头等接触性部件添加含银涂层,杀菌效果较弱,且同样不具有选择性。
为利用细菌裂解酶的高特异性进行环境消毒,Pangule等[31]将Lst共价结合于碳纳米管表面并制成乳胶涂膜,可在6 h内杀死金葡菌的普通菌株及耐药菌株。该材料可在干燥环境中使用至少6个月并完全保持抗菌性能,有望作为优良的抗菌涂层在公共环境使用。Wu等[38]将Lst通过亲和作用固定在NiNTA琼脂糖颗粒表面,在工业表面活性剂存在条件下仍能有效杀死金葡菌,有望制成除菌喷雾,或添加于抗菌洗手液中。另一项研究中,Kim等[51]将金葡菌裂解酶Lst和炭疽芽孢杆菌裂解酶PlyPH的底物结合域通过银结合肽分别固定于银纳米颗粒表面,赋予银纳米材料选择性杀菌特性,使其可在对应细菌细胞表面富集,以较低浓度实现高效杀菌。该方法及其拓展策略有利于对玻璃、陶瓷和不锈钢等材料表面进行抗菌修饰,有望作为抗菌涂层使用于接触性公共设施表面。
4 结论与展望
细菌裂解酶是一类细菌细胞壁水解酶,对细菌细胞有强大的杀菌功效,高效、温和、特异性强、对耐药细菌有效,且靶向菌体不易对其产生耐受性,有望成为新一代抗菌剂,缓解耐药细菌感染带来的一系列问题。尽管细菌裂解酶在许多动物模型中已展现出优异的杀菌性能,并且几种金葡菌裂解酶正处于人体临床试验阶段,但是,细菌裂解酶在真实环境中的使用仍然存在一系列问题。首先,细菌裂解酶具有免疫原性,可在生物体内引起免疫反应,产生严重的后果,故应对酶进行特殊处理;其次,细菌裂解酶作为蛋白质,可被生物体内的蛋白酶降解,因此,有必要对酶进行修饰或改造,以减少其降解,延长其半衰期;再次,细菌裂解酶在生物体内的使用通常需要依赖较高的酶浓度,以达到较好的杀菌效果,且研究表明,细菌在血液、小肠等真实环境中对细菌裂解酶的敏感性降低[52];最后,酶作为抗菌剂的生产及使用成本较高,相比于传统抗生素,酶稳定性较差。这些问题都限制了细菌裂解酶的大规模使用。然而,细菌裂解酶可以作为现有抗菌剂的补充,在耐药细菌感染的防治领域发挥作用。
目前,细菌裂解酶的相关研究主要集中在游离酶的发现、鉴定、性能表征和工程化改造等方面,以其为基础制备功能性生物材料的研究为数不多。基于细菌裂解酶的功能性生物材料是一种新型生物材料,在食品加工、细菌检测、抗菌等方面有良好的应用前景,相比于这些领域使用的传统生物材料(如基于溶菌酶或多聚赖氨酸的抗菌生物材料),具有更高的底物特异性和更强的酶-底物结合力。
细菌裂解酶基生物材料的开发关键在于选择合适的载体材料、合适的固定化方法以及合适的连接肽,使固定化的酶保持高度的柔性及选择性抗菌活性或底物结合特异性。此外,根据该复合材料的具体用途及使用环境,需要考虑材料的安全性、稳定性、与使用环境中其他物质的相容性、重复利用率等因素;如用作临床治疗,还需考虑酶的免疫原性。随着新材料的出现以及新型固定化技术的建立,基于细菌裂解酶的新型生物材料的开发周期将缩短,应用范围也将极大拓展。

