莼菜体外胶的分离及其体外功能活性研究
孙雨欣,毛水芳,陈银宁,丁喆,李雨潼,夏玺越,程浩,冯思敏
(浙江工业大学 食品科学与工程系,浙江 杭州, 310014)
莼菜(Braseniaschrebei)是一种稀有的和有价值的食用蔬菜。莼菜体外胶是存在于莼菜芽以及叶柄表面透明的凝胶黏液,所含的营养物质主要是多糖和多酚,以及少量的蛋白质和黄酮,同时含有锌、钙、铁等微量元素[1]。
目前,莼菜体外胶的分离通常是利用碱浸提法,但该方法极易破坏体外胶立体旋光活性结构,且污染环境、成本较高,不适合规模化生产。王倩等[2]利用碱提醇沉法提取莼菜多糖,所得莼菜多糖纯度为70.3%,提取率大约为79%;周毅峰等[3]表明莼菜体外胶质溶解的溶剂是NaOH,最佳条件为浓度0.10 mol/ L,但碱提法则对多糖的空间结构和生物活性均有破坏作用。超声波提取由于具有简单、方便、快速、得率高且不影响有效成分等优点,近年来被广泛应用到植物活性成分的提取中。
SESHADRI等发现,超声处理可以改善果胶凝胶的光学特性,在食品工业中迫切需要透明和较少混浊的凝胶[4]。目前,超声波处理对莼菜体外胶的流变性,持水性和物理性质的研究仍然有限。本实验将结合超声处理研究莼菜体外胶流变学、质构性以及生物学等特性的影响,为优化莼菜的加工,推进莼菜多糖产品的开发并赋予其更高的附加值奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
新鲜莼菜,杭州千盛食品厂。
各标准单糖样品,购于Sigma公司(MO,USA),其余均为国产分析纯或化学纯。
1.2 仪器与设备
AY-120/BL-220H 电子天平,日本Shimadzu公司;DHG-9140A 电热恒温鼓风干燥箱,上海一恒科技有限公司;BTP pro真空冷冻干燥机,美国Virtis公司;HH-6 数显恒温水浴锅,江苏国华电器有限公司;EYELA 旋转蒸发仪,上海爱朗仪器有限公司;SHB-III循环水式真空泵,郑州长城科工贸有限公司;98-2 磁力搅拌器,上海司乐仪器有限公司;DELTA 320 pH计,梅特勒-托利多仪器有限公司;CR21N 离心机,日本国茨城县常陆那珂有限公司;FS-1200pv 超声波处理器,上海生析超声仪器有限公司;MDF-U3386 超低温冰箱,上海松下健康医疗器械有限公司;SH2-B 恒温水浴振荡槽,上海一恒科技有限公司;DZF-6050 高温真空烘箱,杭州全谱实验室设备有限公司;R/S-plus 流变仪,美国Brookfield公司;TA.XT Plus 物性测试器,英国 Stable Micro Systems公司。
1.3 方法
1.3.1 分离莼菜体外胶
在分离实验之前,将新鲜莼菜漂洗3次并沥干。准确称取20 g新鲜莼菜样品置于烧杯中。并在不同条件下处理:(1)样品在40 ℃下水浴振荡分离0.5~4 h,转速为220 r/min;(2)在能量密度2 400~8 000 J/g下对样品进行超声处理;(3)将样品放置于-80 ℃至0 ℃的变温冰箱中冷冻24 h,然后在30 ℃下解冻;(4)在(3)步骤的基础上再在能量密度为2 400 J/g下超声处理。
在上述步骤之后,将样品在7 000 r/min下离心10 min后,测残渣质量,计算方法如公式(1)所示:

(1)
1.3.2 体外胶的基本成分测定
为测定超声对基本活性成分的影响。用机械振荡法将莼菜样品在40 ℃下水浴振荡分离2 h后离心10 min(转速为7 000 r/min),取上清液冷冻干燥或在恒温鼓风干燥箱内热风干燥得莼菜体外胶样品。称取0.5 g上述未超声的冷冻或热风干燥的多糖胶,先加入少量0.1 mol/L NaOH进行溶解,之后用0.1 mol/L NaOH稀释至100 mL,并用2 mol/L HCl调节pH至中性。超声处理后(超声频率20 kHz,8s一个循环,600 W,1 min)进行测定。总糖采用苯酚-硫酸法[5];还原糖含量测定[6]:参照GB 5009.7—2016;蛋白含量测定[7]:参照GB 5009.5—2016 分光光度法;总酚含量的测定采用福林酚法[8];总黄酮含量测定[9]:参照SN/T 4592—2016。
1.3.3 体外胶多糖的单糖组成测定
使用GC-MS法测定体外胶多糖的单糖组成[10]。将5 mL 2 mol/L的三氟乙酸(TFA)加入到2 mg体外胶中,并在110 ℃水解2 h,在40 ℃下减压浓缩蒸干,加入3 mL甲醇减压浓缩蒸干,重复4~5次以完全除去残留的TFA。然后将样品还原并乙酰化,最后用氯仿稀释至5 mL。
色谱柱DB-23(30 m×0.25 mm×0.25 μm),载气流速(N2)(1 mL/min),程序升温,起始温度100℃,以5℃/min升至200℃,保持1 min,再以10 ℃/min上升至250 ℃,保持5 min,进样口温度250 ℃,检测器温度250 ℃,分流比1∶50,氢气流速(35 mL/min),空气流速(350 mL/min),尾气流速(30 mL/min)。
1.3.4 体外胶的质构性测定
为测定超声对体外胶质构性的影响。称取1.3.2中所述未超声的体外胶样品1.2 g溶解于100 mL蒸馏水中得到1.2 g/L的体外胶悬浮液,在95℃下加入0.1 mol/L的CaCl2,再加入蔗糖使其质量分数达到60%,然后继续加热磁力搅拌以使钙离子和蔗糖充分溶解形成均匀的溶液,然后置于超声波发生器中(超声频率20 kHz,8 s一循环,400~800 W,0~7 min)。之后将凝胶储存在30 mm×50 mm的密封称量瓶中,在4℃下过夜后进行质构测定。
1.3.5 体外胶的流变特性测定
将1.3.2所述0.05 g干燥的体外胶(未超声)溶解于20 mL蒸馏水中得到2.5 g/L的体外胶悬浮液,之后进行超声处理(超声频率20 kHz,8 s一循环,600 W,1 min),将约1~2 mL样品装载到流变仪的板上并维持2.0 min以等待应力和温度的平衡。选用直径为25 mm的平行板系统,平行板间距为1 mm。测定条件:温度25 ℃,剪切速率:0.01~800 1/s,振荡频率扫描范围:0.1~20 Hz。
1.3.6 体外胶的体外酶活性抑制实验
(1)将α-淀粉酶溶于0.1 mol/L 的磷酸钾缓冲液(pH 6.8)配成0.1 U/mL备用。试管中加入1 mL体外胶溶液(1.2、1.4、1.6、2.0、2.4、2.8、3.2 mg/mL),0.3 mL α-淀粉酶溶液,在37 ℃下水浴20 min,加入0.4 mL 1%的淀粉溶液。之后在37 ℃下水浴反应8min,加入0.2 mL DNS,于沸水浴中反应5 min,取出冷却定容至25 mL,于540 nm 处测定吸光值(A1),用缓冲液代替体外胶溶液测其吸光值(A0),用缓冲液代替酶液测其吸光值(A2)。(2)取不同浓度体外胶溶液1 mL加入到2 mL pH 6.8的磷酸钾缓冲溶液中,再加入1 mL 0.1 U/mL α-葡萄糖苷酶混匀,在37 ℃下水浴10 min后加入5 mmol/L的PNPG溶液0.5 mL,于37℃下保温20 min,加入0.1 mol/L Na2CO3溶液2 mL终止反应,在400 nm 处测其吸光值(A1),用缓冲液代替体外胶溶液测其吸光度值(A0),用缓冲液代替酶液测其吸光值(A2)。阳性对照为阿卡波糖。酶活抑制率计算方法如公式(2):

(2)
1.3.7 数据分析
实验数据以平均值±标准差(SD)表示,数据分析使用SPSS Version 16.0。
2 结果与分析
2.1 不同因素对体外胶分离率的影响
由图1-A可知,随着振荡时间从0.5 h增加到4 h,体外胶的分离率刚开始随着振荡时间的增加上升较快,当振荡时间超过2 h时,分离率的增加则变得十分缓慢。由振荡产生的机械力可以促进体外胶的分离,虽然延长振荡时间可以提高体外胶的分离率,但可能会使体外胶发生降解且会消耗大量的时间[11]。最佳的振荡时间为2 h时,体外胶的分离率为(43.34±0.94)%。由图1-B可以看出,当温度低于0 ℃时,分离率随着温度的升高而增加,这可能是由于缓慢冷冻形成的大颗粒冰晶,有利于体外胶的分离[12]。当冷冻温度为-4 ℃,超声能量密度为2 400 J/g时,分离率最大为(63.93±6.11)%。由图1-C可知,体外胶的分离率随着超声能量密度的增加而增加,超声能量密度达到4 800 J/g时,分离率达到最大,进一步增加超声能量密度,多糖胶体外胶的分离率呈下降趋势。当能量密度低于4 800 J/g时,可能由于剪切力过小不足以完全分离体外胶,当能量密度高于4 800 J/g时,反而造成体外胶分离率的下降[20]。当超声能量密度为4 800 J/g时,体外胶的分离率最大为(78.97±3.83)%。
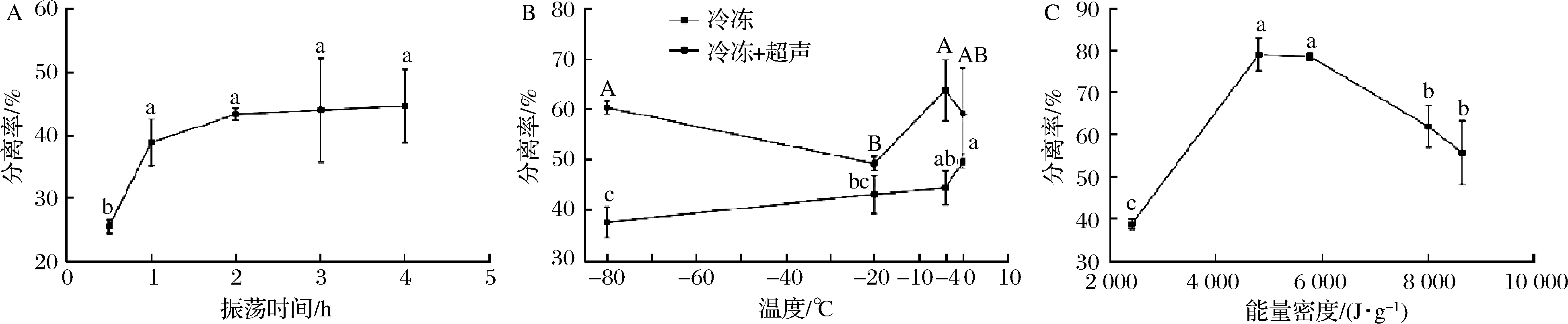
A-振荡时间;B-冷冻温度;C-超声能量密度
2.2 体外胶化学物质的含量
图2给出了经不同方式处理后的莼菜体外体外胶的总糖、还原糖、总蛋白、总多酚和总黄酮含量。冷冻干燥体外胶的各化学物质含量均高于热风干燥,这可能是由于热风干燥时体外胶被空气氧化造成的。而超声处理和未超声处理的体外胶的各化学物质含量几乎相同,总糖含量为524.4~552.8 mg/g,还原糖含量为26.8~32.3 mg/g。体外胶的主要成分是多糖约为520.5 mg/g,与KAKUTA等的结果一致[21],而且远高于果胶中的含量(326 mg/g)[15],是多糖的良好来源,具有很多生物活性。体外胶的总多酚含量为208.3~228.5 mg GAE/g,这使得它具有较高的抗氧化活性。此外,它还含有少量的蛋白质(16.9~21.5 mg/g)和黄酮(1.8~5.1 mg/g),这与ZHAO等的研究结果一致[16]。
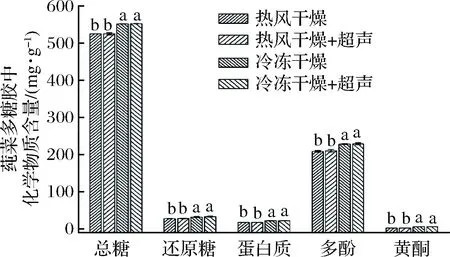
图2 超声处理或未处理的不同干燥方式体外胶的化学物质(总糖、还原糖、总蛋白、总多酚、总黄酮)的含量
2.3 体外胶多糖的单糖组成
如图3所示,由体外胶多糖释放的单糖组分完全可以彼此分离。通过比较未知峰与参考标准糖的保留时间,可以得出体外胶多糖含有9种单糖,含量较高的单糖为半乳糖(41.79%),木糖(18.72%)和鼠李糖(7.13%),这与 KAKUTA等发现的莼菜体外胶胶多糖富含半乳糖(32%~40%),鼠李糖(6%~9%)和木糖(2%~7%)的结果一致[14]。还通过比较其质谱碎裂模式与MS确定了一些含量较少的单糖,如甘露糖(4.29%)、葡萄糖(4.55%)、阿拉伯糖(1.02%)和可能的物质(1,2,3-苯三酚,三乙酸酯)。

1-1,2,3-苯三酚,三乙酸盐(9.26%);2-未知单糖(3.01%);3-鼠李糖(7.13%);4-木糖(18.72%);5-甘露糖(4.29%);6-葡萄糖(4.55%);7-半乳糖(41.79%);8-未知单糖(2.18%);9-阿拉伯糖(1.02%)
2.4 超声对体外胶质构性的影响
2.4.1 超声功率对体外胶质构性的影响
为了研究超声处理对多糖胶质构性的影响,在超声频率为20 kHz,超声脉冲方式为8 s,时间为3min的条件下,用不同的超声功率(400~800 W)处理多糖胶。由表1可见,超声处理显著降低了冷冻干燥和热风干燥体外胶样品的硬度、弹性、内聚性和黏附性。随着超声功率的增加,上述参数均先增大后减小,超声功率为600 W时达到最大值。冷冻干燥体外胶的硬度,弹性,内聚性和黏附性均高于热风干燥体外胶,且超声处理对冷冻干燥体外胶的影响更大。超声波的作用不同于化学降解和热降解,它是一种非随机过程,优先作用于大分子。在超声处理过程中,大量低摩尔质量的多糖大分子可能会被降解,这有助于增加超声波降低黏性的有效性。然而,高超声能量会损害体外胶的结构并降低黏度[17]。
2.4.2 超声时间对体外胶质构性的影响
在超声频率20 kHz,8 s一循环,超声功率600W的条件下分析超声时间对多糖胶质构性的影响。不同方式干燥后,体外胶的质构性(硬度,弹性,内聚性和黏附性)见表2。结果表明,与初始值相比,增加超声处理时间会降低冷冻干燥和热风干燥体外胶的上述参数值,且冷冻干燥体外胶的上述参数值均显著高于热风干燥体外胶。随着超声时间的增加,体外胶的上述参数值均先增加后减小,冷冻和热风干燥体外胶的上述参数分别在5 min和3 min时达到最大值。通过增加超声处理时间可以产生较软的凝胶。
2.5 超声对体外胶流变特性的影响
由图4-A可见,冷冻干燥体外胶与热风干燥体外胶的黏度较接近,未经超声处理的体外胶呈现假塑性流体行为,超声处理后的体外胶黏度显著下降且表现近牛顿流体行为。
由图4-B可知,4种样品溶液的储能模量(G′)随着频率的增加而增加,并且呈现出相似的形状和趋势,同时超声处理体外胶的G′略低于未经超声处理的体外胶。而图4-C对于未经超声处理的体外胶,在低频处损耗模量(G″)高于经超声处理的体外胶,在大约1.72 Hz的角频率处,经超声处理体外胶的G″迅速增加超过了未经超声处理体外胶的G″。超声处理降低了体外胶的弹性行为并且在较高频率下增加了黏性行为,这可能是由于超声处理降低了体外胶的分子量,破坏了体外胶的致密均匀结构造成的[18]。

表1 超声功率对不同干燥方式体外胶质构性的影响
注:数据表示为平均值±标准偏差(n=3);a,b,c表示通过ANOVA分析不同超声功率之间的显着差异(P<0.05);*表示通过t检验分析在相同超声处理下冷冻干燥和热风干燥体外胶之间的显着差异(P<0.05)。下同。
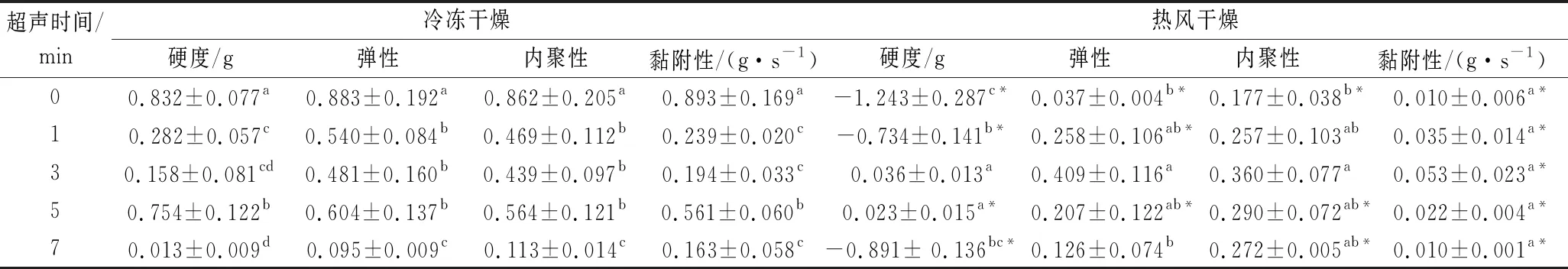
表2 超声时间对不同干燥方式体外胶质构性的影响
注:数据表示为平均值±标准偏差(n=3);a, b, c表示通过ANOVA分析不同超声时间之间的显著差异(P<0.05);*表示通过t检验分析在相同超声处理下冷冻干燥和热风干燥体外胶之间的显著差异(P<0.05)。.
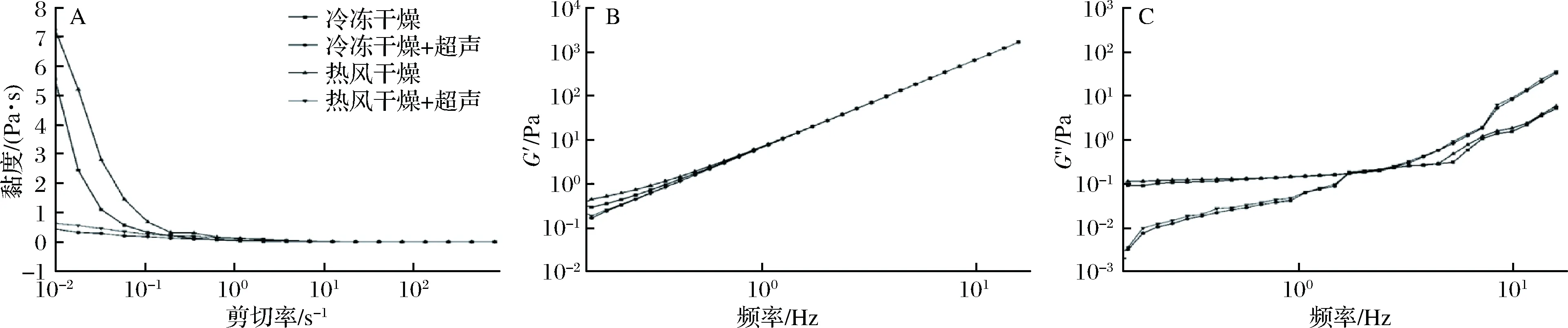
A-流动行为;B-动态储能模量;C-损耗模量
2.6 超声对体外胶抑制酶活的影响
如图5-A所示,经不同方式处理后的体外胶对α-葡萄糖苷酶具有一定的抑制活性,且呈浓度依赖性。随着体外胶浓度从1.2 mg/mL增加到3.2 mg/mL,体外胶对α-葡萄糖苷酶抑制活性增加。抑制剂的半数抑制率(IC50)值可用于评估抑制剂的抑制效率,从图中经计算得到经冷冻、冷冻和超声、热风、热风和超声处理后体外胶对α-葡萄糖苷酶的IC50值分别为1.832、1.770、2.256和2.023 mg/mL。超声处理对体外胶抑制α-葡萄糖苷酶的活性影响不大,但热风干燥显著降低了体外胶抑制α-葡萄糖苷酶的活性,可能是因为热风干燥使得体外胶中部分化学活性物质分解造成的[19]。
由图5-B可知,经不同方式处理后的体外胶对α-淀粉酶具有一定的抑制活性,且呈浓度依赖性。随着体外胶浓度从1.2 mg/mL增加到3.2 mg/mL,体外胶对α-淀粉酶的抑制率呈上升趋势。从图中经计算得到,经冷冻、冷冻和超声、热风、热风和超声处理后体外胶对α-淀粉酶的IC50值分别为2.156、2.151、2.392和2.249 mg/mL。冷冻干燥体外胶对α-淀粉酶具有较高的抑制活性,可能是因为冷冻干燥可以很好地保留体外胶中的化学活性物质。
由图5-C知,在浓度为0.4~3.2 mg/mL,阿卡波糖对α-葡萄糖苷酶和α-淀粉酶活性的抑制都是剂量依赖关系,随剂量的加大,抑制率增大。阿卡波糖对α-葡萄糖苷酶和α-淀粉酶活性的半抑制浓度分别0.916、1.377 mg/mL,抑制效果略好于莼菜胶。

A-α-葡萄糖苷酶;B-α-淀粉酶;C-阿卡波糖
3 结论
超声耦合离心法分离莼菜体外体外胶可获得最大分离率。而且,超声处理降低了冷冻干燥和热风干燥体外胶的硬度、弹性、内聚性和黏附性。
体外胶本身含有丰富的多糖和多酚,超声耦合离心法分离莼菜体外胶,可快速分离莼菜体外胶,既不破坏莼菜组织,又可以充分保持多糖胶的化学物质含量、抗氧化活性以及酶抑制活性,且操作工艺简单,成本较低,生产过程对环境污染小,值得继续深入探讨,是否可以对莼菜其他成分提取有所帮助,以及其活性成分的生理功能研究。

