两种养殖模式下大黄鱼肌原纤维蛋白流变学特征研究
邹咪,郭全友,汤嘉慧,谢晨,熊泽语,包海蓉,3,4*
1(上海海洋大学 食品学院,上海,201306) 2(东海水产研究所,上海,200090)3(上海水产品加工及贮藏工程技术研究中心,上海,201306)4(农业部水产品加工贮藏保鲜质量安全风险评估实验室(上海),上海,201306)
大黄鱼(Pseudosciaenacrocea)隶属鲈形目、石首鱼科、黄鱼属[1],富含不饱和脂肪酸,根据现代人们对食品高蛋白、低脂的需求,是适合人类摄取的动物性营养食品[2],是重要的海洋经济鱼类之一,有中国海洋四大经济鱼类之称[3]。正是由于其肉质鲜美、营养高导致了人们对大黄鱼的过度捕捞,其野生资源迅速减少,几近枯竭。到了20世纪80年代末,随着育苗技术的突破,养殖大黄鱼的成活率大大提高,人工养殖技术越来越成熟,出现了筏式网箱养殖和池池养殖等传统模式,并出现了围网养殖和深水网箱等新型养殖模式,主要分布于福建、广东和浙江等地,大黄鱼成为我国六大海产养殖品种之一[4-5]。大黄鱼多通框网箱是筏式网箱的一种优化,即将多个小网箱连起来形成的大网箱,但依然存在养殖密度大、水体交换不充分及大黄鱼的肉质不紧致、鱼肉含有较多的脂肪,导致鱼肉的口感差等一些品质问题。随着养殖技术的进一步的发展,出现了新型的养殖模式—深海围网,这种养殖模式可使养殖空间变大,利于围网内海水与外界海水充分交换,养殖的大黄鱼其品质更加接近野生大黄鱼[6]。
鱼肉肌原纤维蛋白很大程度决定了其组织学品质,同时其形态特征也是肉质的组织学基础,因此鱼体肌肉的品质通常由鱼肌原纤维特征来评定[7]。复杂流体的微观结构反映在流体的流变性质中。在许多流变测量中,动态测试或小幅度振荡剪切(SAOS)测试已被最广泛使用,因为它对微结构敏感,易于使用,并具有良好的数学背景。大黄鱼养殖方式和外界环境差异,其肌原纤维蛋白的组成也会有所不同,这就使得大黄鱼的质地和流变学特性上形成一定的差异。为了研发符合消费者需求的产品,在微观上应该清楚大黄鱼蛋白的差异,为后期的处理和加工优化提供支撑。本研究选用新鲜大黄鱼提取其肌原纤维蛋白,通过测试其蛋白的温度扫描、应变扫描、频率扫描、表观黏度和大振幅振荡剪切的流变学方法探讨不同的养殖模式下大黄鱼肌原纤维蛋白质流变学特性的差异,通过流变学特性的分析方法,从微观角度给予品质差异的解释。
1 材料与方法
1.1 材料与试剂
通框养殖和围网养殖的大黄鱼分别购于福建宁德和浙江台州养殖场,新鲜大黄鱼捕捞后装在铺满碎冰的泡沫箱中通过物流车快速送达实验室,取其脊背肉,除去鱼鳞、鱼皮及鱼骨;NaCl、KCl、三羟甲基氨基甲烷(Tris)、顺丁烯二酸(Maleicacid)、曲拉通(Triton-100)等均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
SG2pH计,梅特勒-托利多仪器(上海)有限公司;LRH-100 CL型低温培养箱,上海一恒科学仪器有限公司;D-130 电动匀浆机,维根技术(北京)有限公司;GL-20B高速冷冻离心机,上海安亭科学仪器厂;FPG12800微射流高压均质机,英国SFP有效公司;UV1100型紫外分光光度计,广州罡然机电设备有限公司;MCR301流变仪,奥地利安东帕仪器(上海)有限公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取
肌原纤维蛋白的提取参照KATOH等[8]的方法。准确称量5 g鱼肉,加入40 mL 40 mmol/L Tris-Maleat缓冲液(内含0.16mol/L KCl,20% TritonX-100,pH7.5),均质速率为12 000 r/min,每次10 s,停顿5 s,共均质2 min,均质后离心, 5 000 r/min,离心10 min。离心后,除去上清液,继续添加40 mL 40 mmol/L Tris-Maleat缓冲液(内含0.16mol/L KCl,pH 7.5),均质,离心,完成后再重复操作一次。除去上清液后,加入20 mL 0.1 mol/L NaCl溶液,均质,离心。弃去上清液,加入40 mL 0.1 mol/L NaCl溶液,均质离心,用2层纱布过滤,离心后得到沉淀,即为纯净的肌原纤维蛋白样品,碎冰冷藏。
1.3.2 肌原纤维蛋白溶液样品的制备
将肌原纤维蛋白用0.6 mol/L KCl溶液稀释,通过微射流高压均质机进行均质,得到均匀黏稠,无絮状物体的溶液,用Biuret法[9]测定溶液的蛋白浓度,将2种养殖模式下的鱼肉样品浓度用0.6 mol/L KCl溶液调整至5 mg/mL。
1.4 肌原纤维蛋白溶液的流变特性测定
1.4.1 温度扫描
本测试探头型号为DG26.7,将准备好的两种肌原纤维蛋白溶液(浓度5 mg/mL)样品,吸取5 mL加入到圆筒间隙中。固定应变为1%,角频率1 rad/s,按1 ℃/min的升温速率从20℃ 升温到80 ℃,获得试样的弹性模量(G′)。
1.4.2 应变扫描
探头选用DG26.7,应变扫描在20℃下测试,角频率为1 rad/s,应变0.01%~100%,测其弹性模量。
1.4.3 频率扫描
探头选用DG26.7。在温度20 ℃,固定应变1%,频率范围0.1~10 Hz进行测试,获得试样的弹性模量。
1.4.4 表观黏度测试
探头选用DG26.7,在温度为20 ℃,剪切速率从0.1 s-1升到100 s-1,获其黏度值。
1.4.5 大振幅振荡剪切测定
探头型号为DG26.7,温度20 ℃,角频率0.1 rad/s,应变1%~1 000%,获其弹性模量,对其曲线上取点分析,做出Lissajous曲线。
1.5 数据分析
采用Origin 8.0,SPSS 19.0软件进行数据分析。
2 结果与分析
2.1 温度扫描测试
肌原纤维蛋白在流变学的温度扫描测试过程中,随着温度的提高可较好显示出形成凝胶的物理变化[10]。按照一般规律来说,肌原纤维蛋白的G′(弹性模量)在整个加热过程中可以分成3个阶段:低于34℃为凝胶的准备阶段(gel setting);温度为30~40 ℃,会出现凝胶的弱化阶段(gel weakening);温度在40~80℃为凝胶的强化阶段(gel strengthening)[11],XIONG等研究鸡胸肉肌球蛋白的流变学特性上得到相似的结论[12]。在中间过程中,凝胶的G′值降低可能是由于升温将肌球蛋白尾部的螺旋结构解开,使得蛋白的流动性增强,对蛋白的网络结构产生一定的破坏[13]。随着温度的进一步升高,凝胶逐渐增强主要是因为蛋白在凝聚过程中相互交错的数量越来越多。因此蛋白在加热凝聚过程中变性的程度越高, 最后形成的凝胶就有越大的强度。
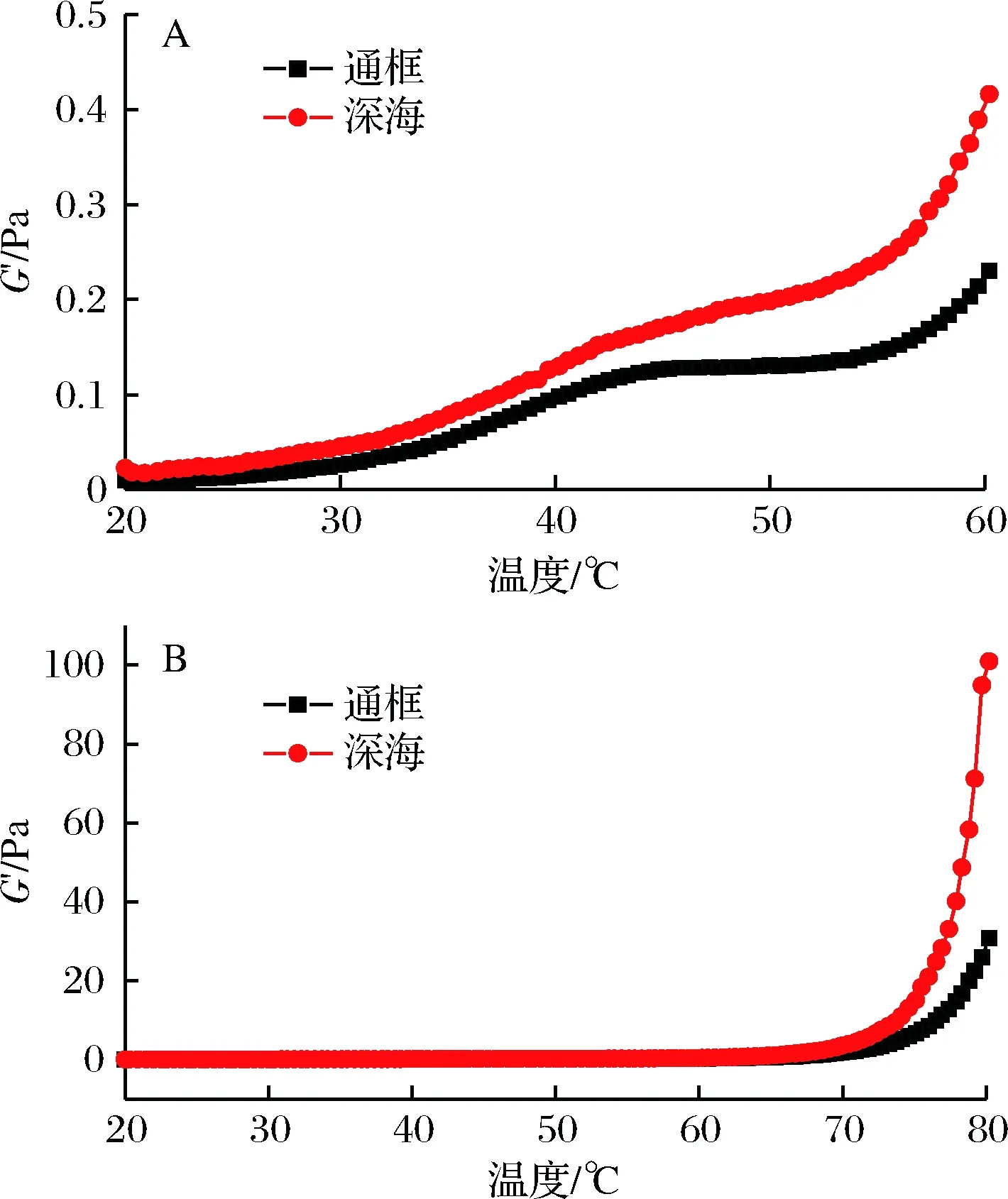
A-表示温度20~60℃;B-表示温度20~80℃
如图1所示,常规的曲线趋势并未在通框养殖和围网养殖的大黄鱼样品曲线图中显现,2种养殖模式下的大黄鱼肌原纤维蛋白G′没有下降,只是增大的速率减缓。而其中深海围网养殖的大黄鱼样品G′上升速率较大,并且G′比通框养殖的样品G′偏高,到了后期的凝胶强化阶段,该样品的G′比通框养殖的大黄鱼肌原纤维蛋白G′显著增加。由此可见,深海围网养殖的大黄鱼其肌原纤维蛋白组织结构更紧密,其凝胶强度更强。
2.2 动态应变扫描测试
动态应变实验能较好地显现肌原纤维蛋白结构上的变化。动态应变施加的应力保持足够小,产生的应变与应力呈线性比例,因此,对未知样品的任何动态测试必须以应力幅度扫描开始,确定了在线性黏弹区(英文全称LVER)内安全地保持特定样品测试的幅度后,可以使用频率扫描进行进一步的测试,以测量样品的黏弹性行为[14]。如图2所示,通框养殖大黄鱼样品G′值开始时几乎无变动,随着应变的继续增大,呈现下降的趋势。深海围网养殖的大黄鱼样品其G′值开始时没有显著增大,之后也呈现下降的趋势。可能是由于随着应变的加大,蛋白的紧密网状结构遭到了破坏及重排,导致了G′的下降。而当应变大于2%,深海围网养殖模式下的大黄鱼样品G′值高于通框养殖模式下的大黄鱼样品。
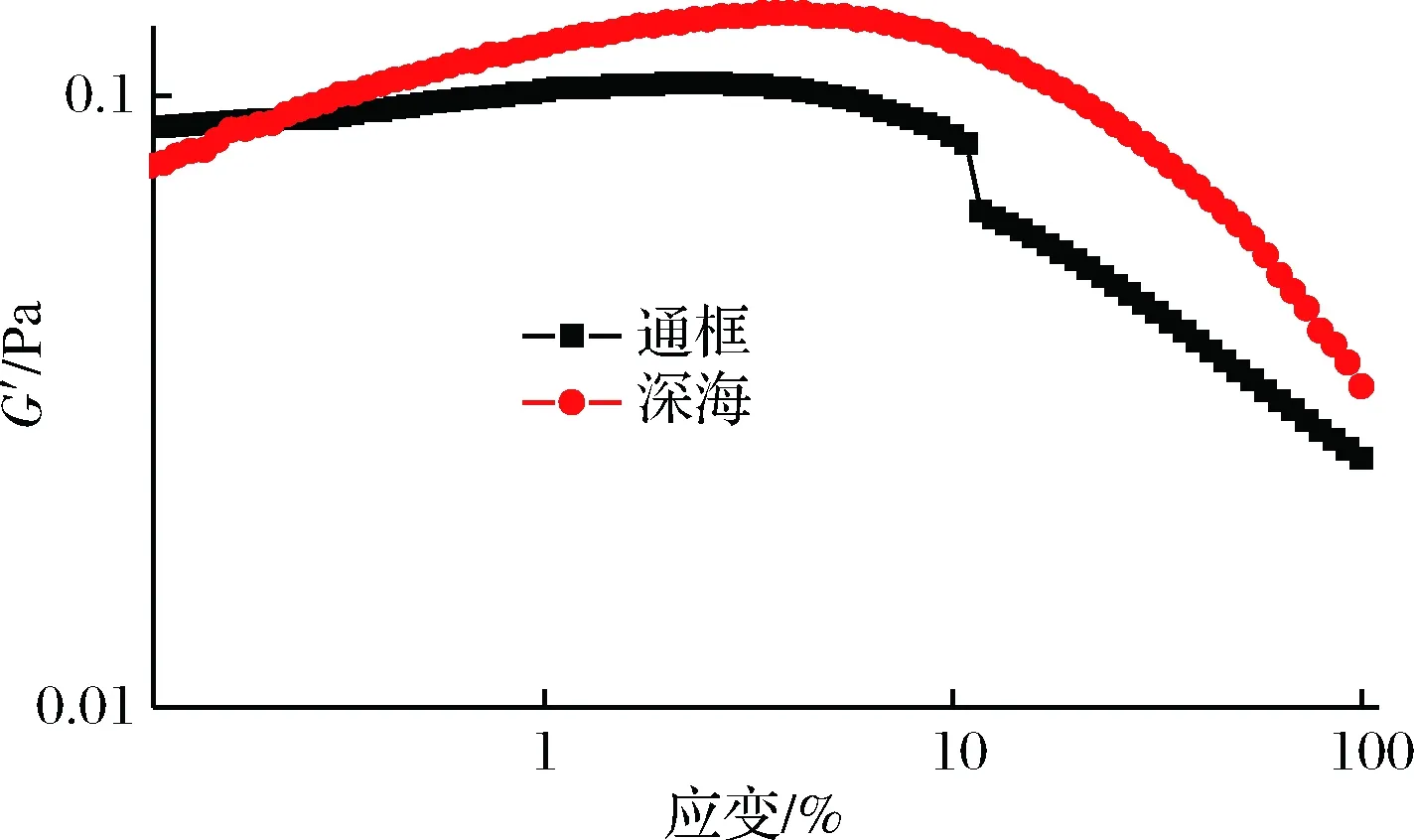
图2 两种养殖模式下大黄鱼肌原纤维蛋白动态应变扫描测试
2.3 频率扫描测试
如图3所示,2种养殖模式下大黄鱼肌原纤维蛋白的G′与频率的关系。由图3可见,2种样品的G′随着频率的升高而增大。研究显示G′在频率扫描过程中表现为恒定不变的为典型凝胶,反之,随着频率的变化而变化则是典型的溶胶[15]。2种养殖模式下的大黄鱼样品试样没有表现出纯凝胶的频率特性,说明显现出了溶胶的特性。频率在0.1~3 Hz,深海围网的大黄鱼样品其G′较通框模式下的样品G′数值偏高,而在3~10 Hz,两者的G′如表1可见总体上没有显著差异,数值接近。
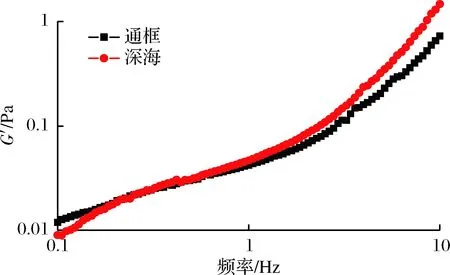
图3 两种养殖模式下大黄鱼肌原纤维蛋白频率扫描测试
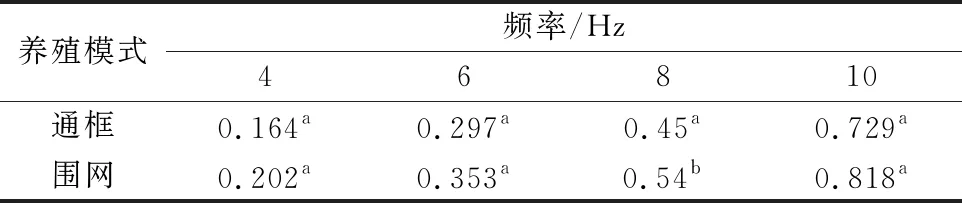
表1 两种养殖模式下大黄鱼肌原纤维蛋白在频率4、6、8、10Hz时的G′比较
注:不同小写字母表示差异显著。
2.4 表观黏度测试
样品在20 ℃条件下黏度值随剪切速率的变化如图4所示。随着剪切速率的增加,2种养殖模式下大黄鱼样品的黏度值都是降低的,并且当剪切速率大于20 s-1时,曲线近似为直线。这一事实揭示了样品溶液为非牛顿假塑性流体。剪切速率增强,溶液变稀是由于蛋白大分子链局部取向,此外触变效应及分子链出现断裂也会引起假塑性现象[16]。2种养殖模式下大黄鱼样品显现出了相同的现象,而围网养殖的大黄鱼样品黏度值比通框模式下的大黄鱼样品黏度值偏高,表明其肌原纤维蛋白黏度更大,蛋白网络结构更致密。
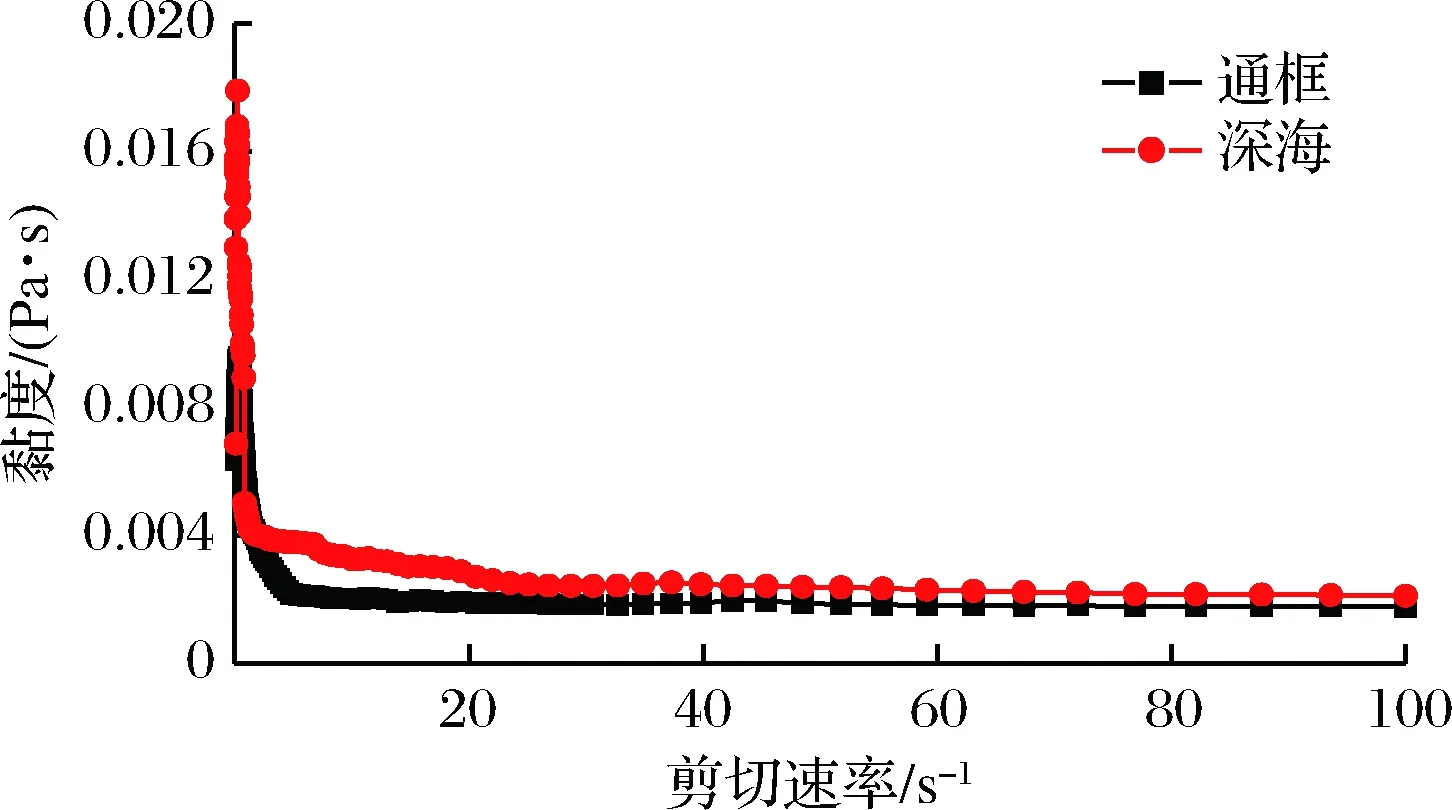
图4 两种养殖模式下大黄鱼肌原纤维蛋白黏度测试
2.5 大振幅振荡剪切
研究大黄鱼肌原纤维蛋白的流变特性还可以使用大幅振荡剪切(LAOS)。为了更充分地表达非线性黏弹区的流变学信息,通过应力对应变分析获得Lissajous曲线描述非线性黏弹性并进行定量分析。当应变位于线性黏弹区间内,振荡剪切应变数值较小时,聚合物常表现出线性黏弹特性,随着应变振幅的增加,在临界应变振幅下其应变数值保持不变,一旦振荡剪切应变超出线性黏弹区域后,聚合物表现出非线性流变行为,呈现出多重谐波。低于临界应变振幅的区域被定义为线性区域,高于临界应变振幅以上的区域被定义为非线性区域[17]。在复杂流体的微观结构研究中,非线性流变学能够提供丰富的附加信息,LAOS可用于定量描述这种复杂流体。EWOLDT等[18]提出了一个新的框架来描述大幅度振荡剪切试验中的复杂非线性反应。在此框架中,区域剪应力与应变在Lissajous曲线中的围成的区域表示耗散的能量,而在剪应力与应变率的关系曲线中则与储能有关,可以通过Lissajous曲线所示的图形来描述样品在线性和非线性黏弹区域内的流变学信息,并且进行定量分析。若曲线呈现椭圆形则表明在线性黏弹区,若偏离椭圆的形状则是在非线性黏弹区[19]。在此实验中,曲线所围的面积则表示在该应力点剪切一周所消耗的能量[20]。刘琴等[7]在研究NaCl浓度对金枪鱼肌原纤维蛋白影响时做出的Lissajous曲线符合这一规律。而在实际生产中,LAOS所对应的是操作流程中对产品所施加的大幅度的挤压碰撞,借此来研究对产品造成的影响。
图5是2种养殖模式下大黄鱼肌原纤维蛋白试样在大幅振荡剪切下的流变图及其Lissajous图。在应变从0%增加到1 000%过程中,2种样品皆表现出先保持不变后下降的趋势,在应变小于25%时,深海围网养殖下的大黄鱼样品G′高于通框养殖下的大黄鱼样品,从Lissajous图中同样能看出在应变为4%时,深海围网养殖模式下的大黄鱼样品的Lissajous曲线呈现椭圆形,说明在线性黏弹区,并且曲线所包围的面积更大,所消耗的能量更多,说明具备更紧密的网络结构。而应变达到300 %时,曲线均偏离了椭圆形,说明蛋白体系表现为非线性黏弹性。以上分析得出深海围网养殖模式下的大黄鱼肌原纤维蛋白其网络结构更加紧密,在大应变下不易被破坏。

A-大振幅震荡剪切图;B-Lissajous曲线(4%应变);C-Lissajous曲线(300%应变)
3 结论
本研究主要通过动态剪切的方法,探讨了2种养殖模式下大黄鱼肌原纤维蛋白的流变学特性的差异。结果表明,深海围网养殖模式下的大黄鱼由于养殖空间大,水体交换充足等优势,其肌原纤维蛋白网络结构更致密,从温度扫描中可明显看出,深海围网养殖模式下的大黄鱼肌原纤维蛋白样品试样G′值高于通框养殖模式下的大黄鱼试样,尤其在凝胶增强阶段尤为明显。在动态应变扫描、频率扫描和黏度测试中,深海围网养殖模式下的大黄鱼肌原纤维蛋白的G′仍然比通框养殖模式下大黄鱼肌原纤维蛋白的G′。在LAOS测试中,深海围网养殖模式下的大黄鱼肌原纤维蛋白试样完成正弦应变一周期所消耗的能量更大,其网络结构更紧密。

