罗丹明类荧光探针的合成及其对Hg2+和Fe3+的识别
韦小明,管渺琛,吴晓芳,黄桂玲,肖 潜
(韩山师范学院 化学与环境工程学院,广东 潮州 521041)
由于重金属在生物及环境中的重要影响,近年来,针对重金属离子而设计开发的荧光小分子探针已成为化学和生物领域的研究热点.在诸多金属中,汞元素因其强生物毒性、易迁移性等特点,而成为最具威胁性的环境污染物之一.一旦摄入过量,即便是很低的浓度,汞也能对大脑、肾脏、内分泌系统及神经系统造成严重的损伤,临床上可表现为头痛、肾衰竭、认知障碍及运动障碍[1-3].而排放到环境中的汞可以再次被细菌和微生物转为毒性更强的有机汞化合物,该类化合物极易通过食物链富集起来而对人体造成更加严重的危害[4-7].而铁元素作为人体中最主要的微量元素,广泛参与众多关键的代谢过程,包括电子传递、氧的运输、酶促反应以及DNA的合成[8-10].然而,细胞内存在过量的铁元素能够导致活性氧的产生,进而引发如帕金森或阿尔茨海默之类的神经退行性疾病[11-12].由此可见,发展高灵敏度及高选择性的汞离子及铁离子荧光探针具有十分重要的意义.
罗丹明及其衍生物具有高摩尔吸收系数、较宽的吸收和发射波长、优秀的荧光量子产率以及制备简便等优点,由其开发的荧光探针因而备受关注.当与特定金属离子络合后,该类探针的螺环内酰胺结构会被破坏而开环,体系的光学性质随之由无色无荧光转变为粉色强荧光,由此实现了金属离子的定性及定量分析[13-14].目前,已有众多汞离子和铁离子荧光探针被合成出来,但是仅有若干探针能够同时识别这两种金属[15-16].鉴于此,本文通过缩合反应将乙二醛以及乙醇胺连接至罗丹明酰肼中,合成了一例可同时识别汞离子和铁离子的荧光探针L.合成路线如图1.
1 实验部分
1.1 仪器和试剂
核磁数据使用Bruker-600 核磁共振谱仪测得、质谱数据使用Bruker maXis UHR-TOF 质谱仪测得、荧光光谱使用RF-6000荧光分光光度计测得、紫外可见光谱使用752 sp紫外可见分光光度计测得.所用试剂均为分析纯且不经纯化直接使用.
1.2 罗丹明衍生物2的合成
前体化合物1 的合成参照文献[17].取2.48 g(5 mmol)化合物1 溶于50 mL 乙醇中,再缓慢加入6 mL过量的乙二醛,室温下反应过夜.之后过滤,用50%乙醇洗涤固体数次,烘干后得化合物2,淡黄色固体粉末,产率85.5%.
1.3 荧光探针L的合成
将1.27 g(2.5 mmol)化合物2以及0.31 g(5 mmol)乙醇胺溶于25 mL乙醇中,室温下搅拌过夜.反应完毕后,过滤,用无水甲醇洗涤固体数次.所得粗产品再用N,N-二甲基甲酰胺及乙醇重结晶,真空烘干后得荧光探针L,淡黄色固体粉末,产率45%.1H NMR(400 MHz,C5D5N),δ︰0.98(t,J=7.5 Hz,12 H),3.21-3.24(m,8 H),3.58(t,J=7.1 Hz,2 H),3.90-3.92(m,2 H),6.23-6.37(m,2 H),6.54-6.81 (m,4 H),7.35 (d,J=7.8Hz,1 H),7.57 (s,1 H),7.98 (s,1 H),8.19-8.22 (m,1 H),8.72-8.75 (m,2 H);13C NMR (100 MHz,C5D5N),δ︰12.37,44.19,58.12,66.61,68.95,98.32,106.42,108.23,123.78,124.23,128.29,128.70,129.62,133.76,139.78,146.85,149.03,152.44,153.63,165.16;HRMS(ESI)calcd for C32H37N5O3:540.2969(M+H+),found:540.2961.
1.4 光谱测试条件
探针L 标准溶液的配制:准确称取5×10-5mol 探针L,DMF 溶解后转入50 mL容量瓶中,定容,即得1×10-3mol/L的荧光探针L标准溶液.
金属离子标准溶液的配制:准确称取各金属盐5×10-4mol,蒸馏水溶解后转入50 mL 容量瓶中,定容,即得1×10-2mol/L的金属离子标准溶液.
光谱测试:准确移取100 μL 探针L 标准溶液和适量的金属离子标准溶液于10 mL容量瓶中,用乙腈-邻苯二甲酸氢钾(V︰V=4︰1,pH=4.0)水溶液定容.测试所得混合液的荧光光谱以及吸收光谱.

图1 荧光探针L合成路线
2 结果与讨论
2.1 体系pH的影响
由于体系的质子浓度会影响探针的螺环内酰胺结构,从而干扰探针L的选择性和灵敏度.因此我们测定了在不同pH值的乙腈-水混合溶液(V︰V=4︰1)下10 μmol/L探针L的荧光强度的变化(激发波长为561 nm;激发夹缝宽度为5 nm;最大发射波长为581 nm;激发夹缝宽度为5 nm),结果如图2所示.
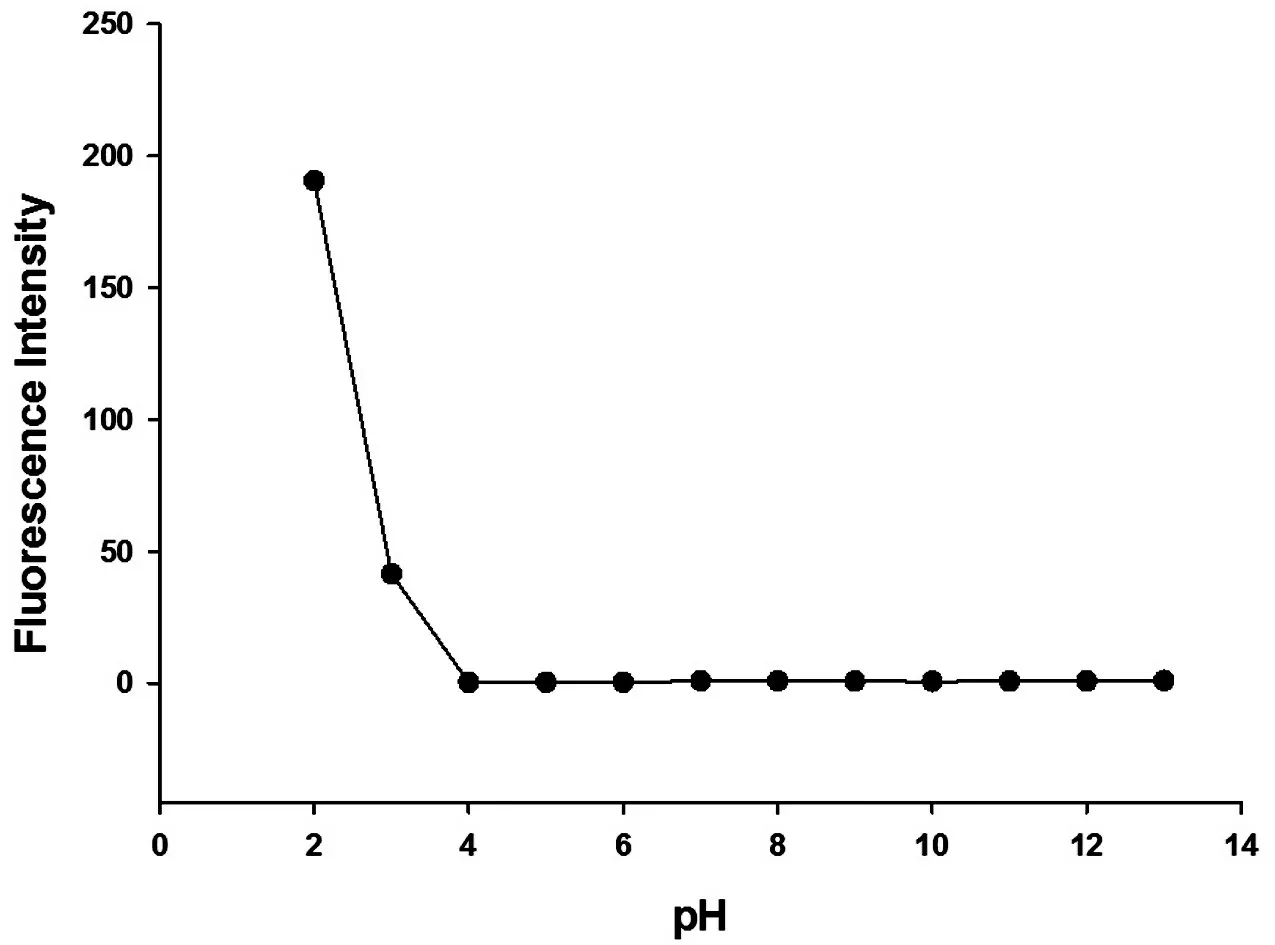
图2 pH对探针L的影响
当探针L在pH值为2~4的溶液时,会产生明显的荧光响应,并且随着pH值的增加,其荧光强度呈现降低趋势.此时探针L被质子化,分子的螺环内酰胺结构被破坏开环.而在pH值为4~13 的溶液时,探针L 结构稳定,未被质子化,溶液未检测到荧光响应.由于金属离子在过高的碱性条件下无法稳定存在,因此,选用乙腈-邻苯二甲酸氢钾水溶液(V︰V=4︰1,pH=4.0)作为体系的缓冲液.
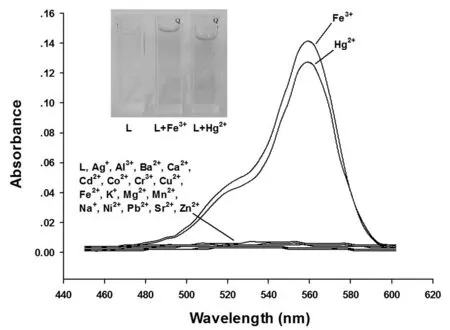
图3 探针L与金属离子反应的紫外-可见吸收光谱
2.2 选择性识别研究
按照上述比例,在浓度为10 μmol/L的探针L溶液中加入20 μmol/L的各种金属离子,并检测溶液的吸收光谱.从图3中可以看出,除Hg2+和Fe3+外,其它常见的金属离子对探针L几乎没有响应.而探针L与Hg2+或Fe3+反应后,裸眼可明显观察到溶液颜色由无色转变为淡红色,其最大吸收波长为558 nm.
之后,在相同条件下测定了探针L与金属离子的荧光光谱(激发波长为561 nm;激发夹缝宽度为5 nm;最大发射波长为581 nm;激发夹缝宽度为5 nm).同样,从图4 可明显看出,与其它金属离子不同,在加入Hg2+或Fe3+后,溶液呈现橘色荧光,其最大发射波长为581 nm.由此可见,探针L可作为一种具有良好选择性的Hg2+或Fe3+荧光探针.
2.3 共存离子的影响
由于不同的金属离子对探针L的识别有可能会存在干扰,因此,我们测试了离子共存条件下探针L对Hg2+或Fe3+识别的影响,结果如图5所示.在加入等量浓度(20 μmol/L)的共存离子后,溶液的荧光强度基本没有发生明显的变化.这一结果很好地表明了探针L对这两种离子的识别不受外来金属离子的干扰.
2.4 线性范围的研究
在浓度为10 μmol/L的探针L溶液中,逐渐增加Hg2+或Fe3+的浓度,并测试溶液的荧光强度.由图6及图7可知,两种体系的荧光强度均保持递增趋势.当Hg2+浓度为3~8 μmol/L时,溶液的荧光强度F(L)与Hg2+浓度c 具有很好的线性正比例关系,其标准曲线方程为F(L)=30.344 c-87.256,相关系数为R2=0.996.根据检出限公式LOD=3σ/s,可得检出限为2.47 μmol/L.另一方面,溶液的荧光强度F(L)与Fe3+浓度在此条件下并无较好的线性关系.
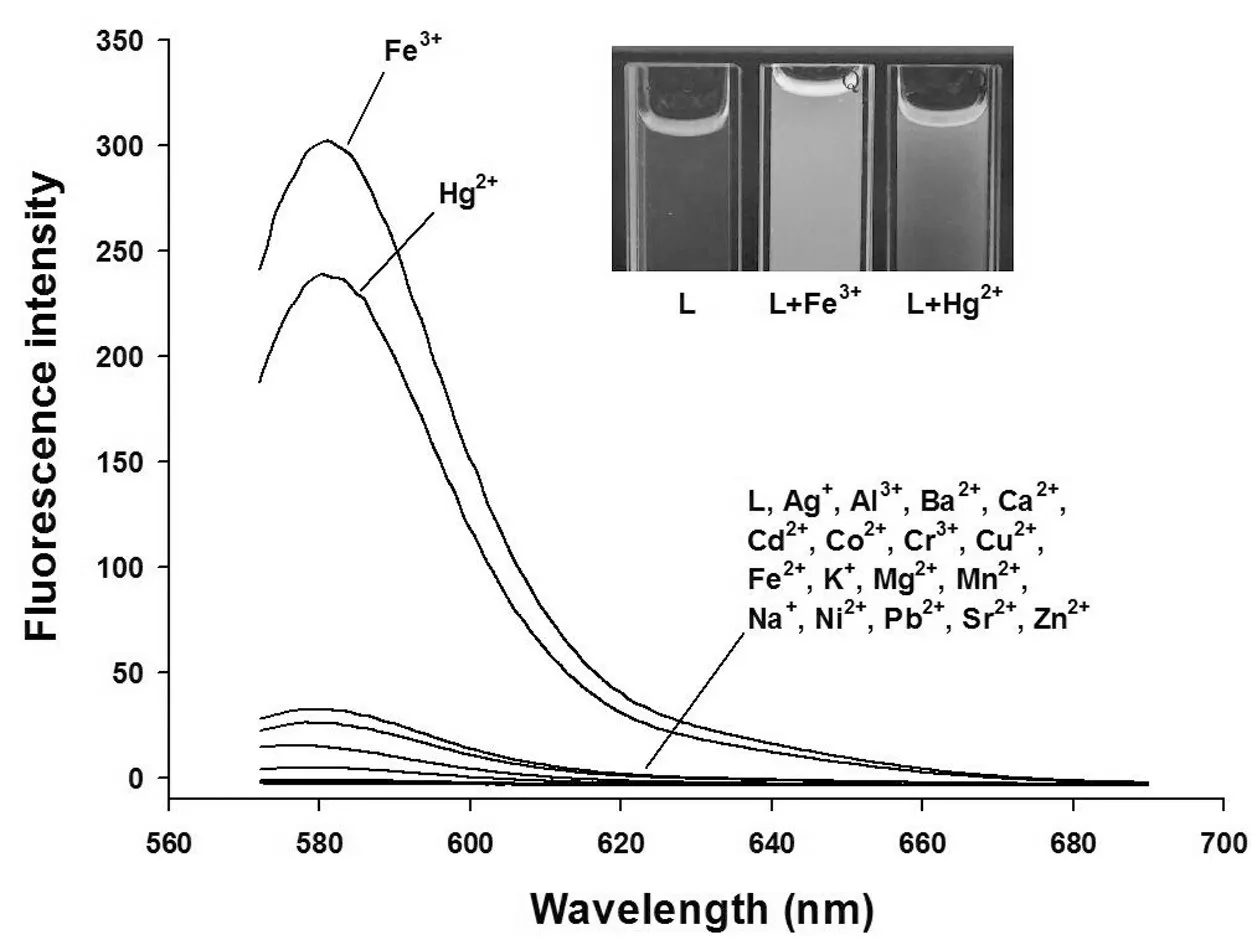
图4 探针L与金属离子反应的荧光光谱
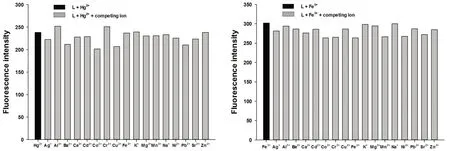
图5 共存离子对探针L识别的影响
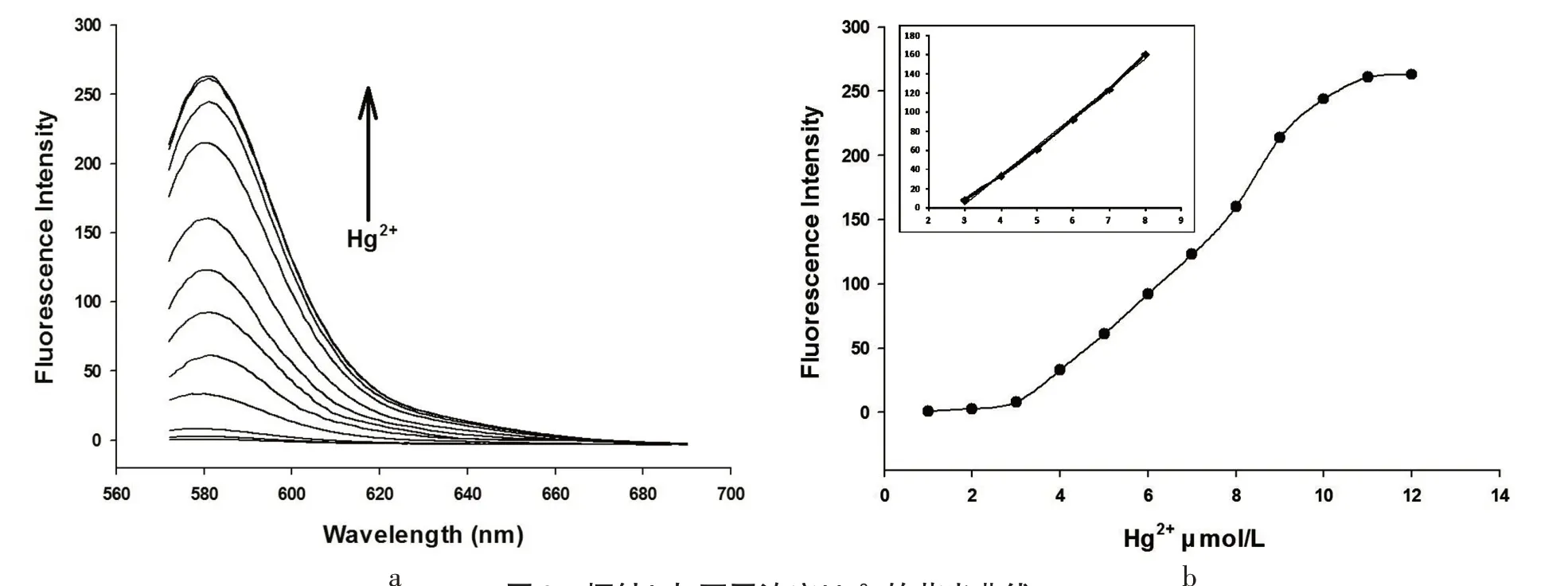
图6 探针L与不同浓度Hg2+的荧光曲线
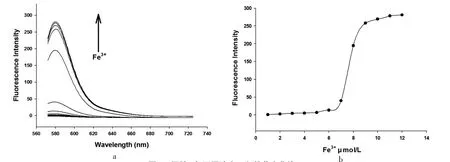
图7 探针L与不同浓度Fe3+的荧光曲线
2.5 络合比的研究
通过等摩尔连续变化法(Job-Plot)实验可测得探针L与两种金属离子在浓度比约为1︰1时溶液的荧光强度最高,结果如图8及图9所示.由此表明,探针L与Hg2+或Fe3+的络合比均为1︰1.
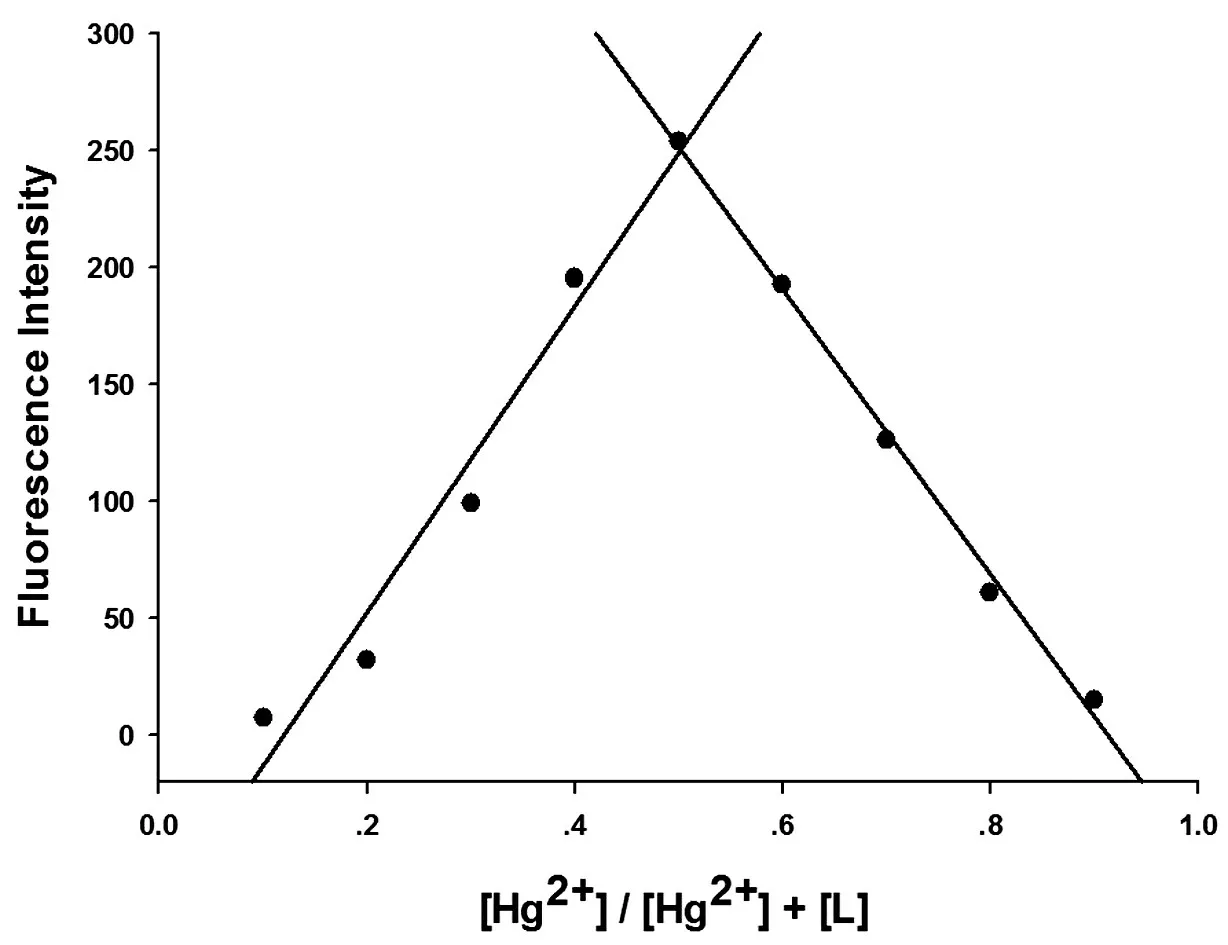
图8 探针L与Hg2+的Job-Plot图
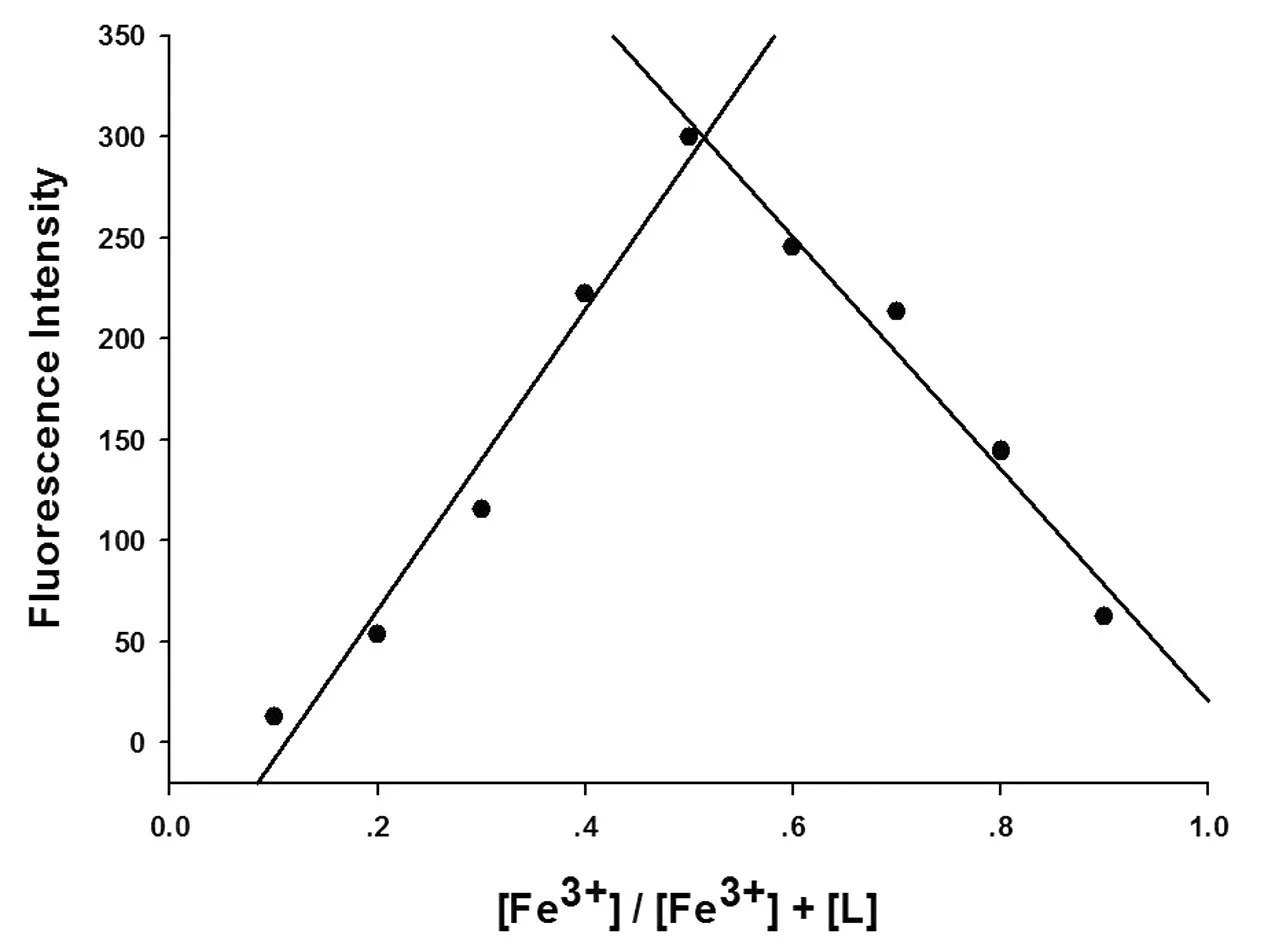
图9 探针L与Fe3+的Job-Plot图
2.6 可逆性及识别机理的研究
向探针L溶液中加入适量的金属离子,反应完毕后,再加入过量的硫离子,并分别测试其荧光强度,结果如图10所示.
在加入硫离子后,探针L与Hg2+络合的体系由粉色强荧光性又转变为无色弱荧光性.这是基于Hg2+的亲硫性,两者的反应导致探针L与Hg2+无法继续络合.以上研究表明探针L对Hg2+的识别是可逆过程.
而探针L 与Fe3+的可逆性实验结果如图11 所示,在加入过量的PO43-后,溶液并无明显的荧光变化,说明探针L的螺环内酰胺结构并无转变为闭环结构,很有可能是在Fe3+的作用下水解脱去胺基部分的基团,生成同样具有强荧光性的罗丹明B.
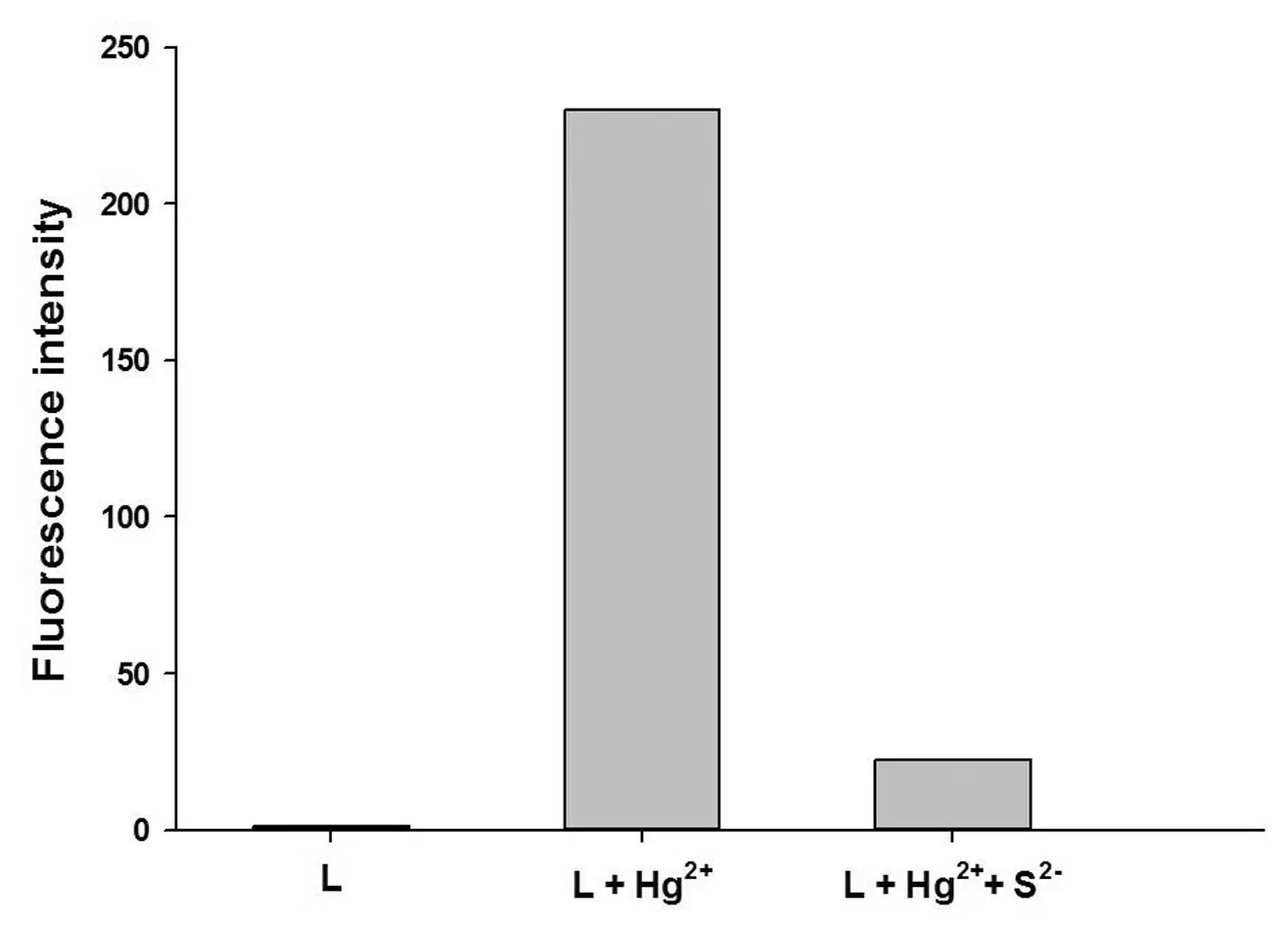
图10 探针L与Hg2+的可逆性研究
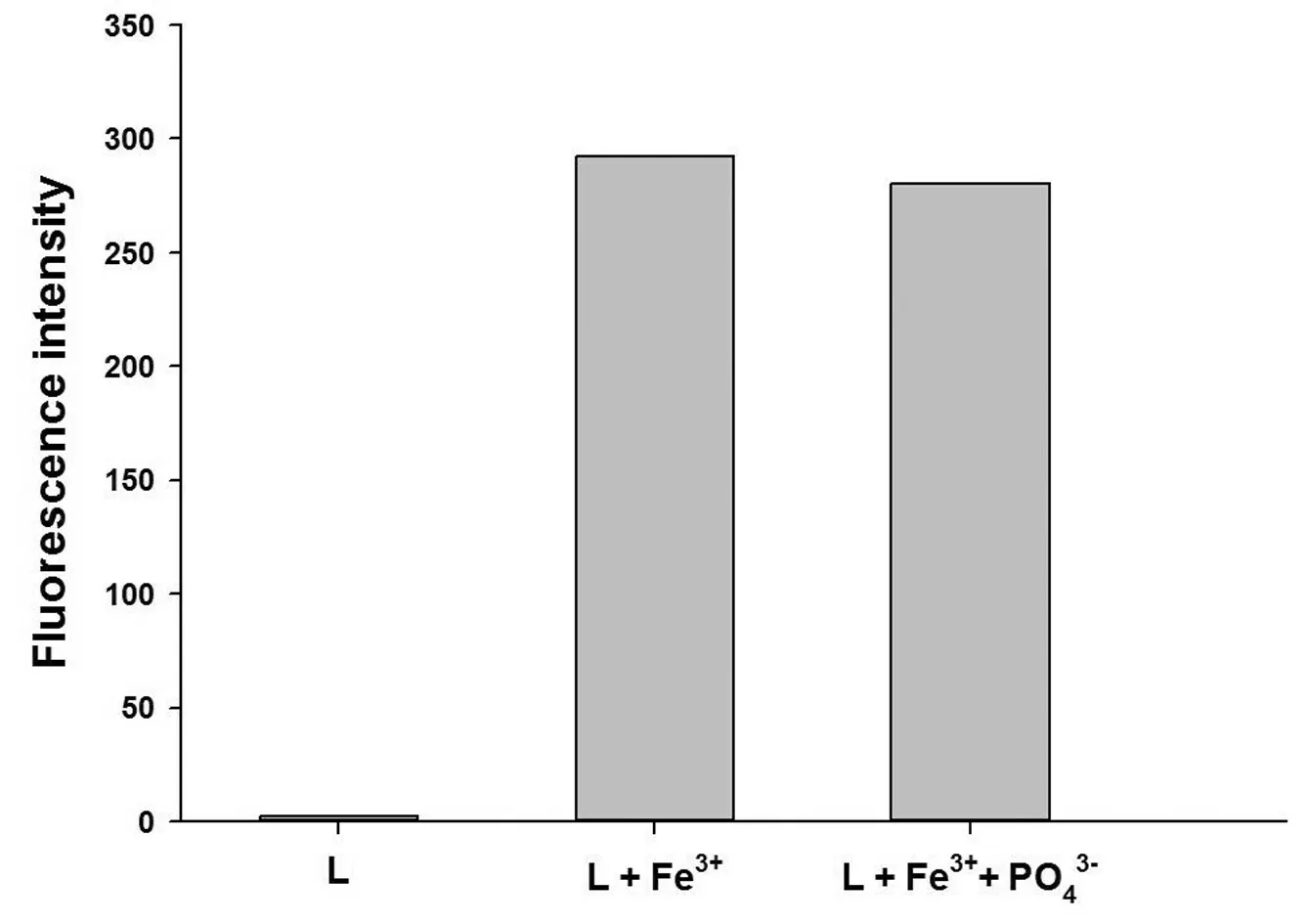
图11 探针L与Fe3+的可逆性研究
基于上述的结果,初步推测探针L与两种离子的可能的识别机理,见图12.
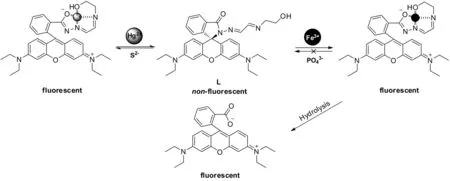
图12 探针L可能的识别机理
3 结论
综上所述,本文基于罗丹明衍生物的光学优点,设计并合成了荧光探针L并探究其对重金属离子的识别情况.光谱实验研究表明,该探针能够选择性地识别Hg2+和Fe3+,且具有优秀的抗干扰性.探针与两者的络合比均为1︰1,其中,Hg2+在一定的浓度范围内与探针的荧光强度有良好的线性正比例关系.

