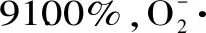pH示差法测定黑小麦全麦粉花色苷及其体外抗氧化性
,*
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056021;2.河北省农林科学院谷子研究所,河北石家庄 050031;3.河北北方学院,河北张家口 075000;4.河北工程大学土木工程学院,河北邯郸 056038)
粮食作物是人类赖以生存的宝贵资源,其中小麦是我国主要的粮食作物之一。随着人们生活水平的不断提高,人们对饮食方面的观念发生了从量变到质变的重大变化,逐渐开始注重食品的营养和保健功能[1]。2014年,“全谷物食品与健康国际研讨会”的召开明确指出要重点“研发全麦粉及制品相关技术”[1-2]。黑小麦作为特殊粒色的小麦,其全麦粉中含有丰富的花色苷。花色苷是一种水溶性天然食用色素,属黄酮多酚类化合物,是一种天然良好的抗氧化物质。在预防神经细胞衰老、心脑血管疾病、癌症、糖尿病和其他疾病中起重要作用[3-5]。
目前,总花色苷定量分析法是依据其光学特性进行分析,常用的方法有分光光度法中的单一pH法、pH示差法、差减法等。而花色苷单体的定量分析一般应用于高效液相色谱法(HPLC法)[4]。张玥等[5]研究表明,单一pH示差法只适用于测定多个提取条件下的花色苷,可用于提取工艺化的研究,而差减法操作过程繁琐,且其线性关系与精确性均较差。虽然HPLC法精确率高,但该法使用的设备和样品昂贵,并且花色苷标准品不稳定;而pH示差法操作简单,并且该方法与HPLC法有很好的相关性[6-7]。正是由于pH示差法测定成本低、精确度高的优点,近年来越来越多的研究者采用该方法进行花色苷含量的定量分析[8]。该法依据的原理为:花色苷发色团结构的转换是pH的函数,而干扰物质的特征吸收光谱不随pH的改变而变化,又因为pH示差法主要用于含有较多干扰物质的花色苷总含量的测定,而黑小麦全麦粉花色苷溶液含有较多的干扰物质[6-8],所以pH示差法很适合用于测定黑小麦全麦粉花色苷的含量。

本实验主要以黑小麦全麦粉为原材料,探究pH示差法测定黑小麦全麦粉花色苷含量的最优实验参数,分析黑小麦全麦粉花色苷的体外抗氧化性能,为黑小麦全麦粉的加工提供理论依据和实践指导。
1 材料与方法
1.1 材料与仪器
黑小麦LZ-1 遗传稳定的品种(系),于2016年10月种植于河北工程大学洺关校区实验基地;盐酸、甲醇、氯化钾、醋酸钠、DPPH、无水乙醇、H2O2、水杨酸、三羟甲基氨基甲烷、邻苯三酚 以上均为分析纯,天津欧博凯化工有限公司。
DZF-6050型真空干燥箱 上海精宏实验设备有限公司;ZK-FDV-98超微超微粉碎机 北京中科浩宇科技发展有限公司;TU-1810紫外可见分光光度计 上海元析仪器有限公司;MULTIFUGE-X1R冷冻离心机 赛默飞世尔科技中国有限公司;BHS-6恒温水浴锅 上海鹏鸣生物科技发展有限公司;R-215旋转蒸发仪 郑州长征仪器有限公司。
1.2 实验方法
1.2.1 试剂的配制 根据文献[12-14],配制以下试剂,稍有改动;
pH1.0缓冲液的配制:精准量取0.2 mol/L的HCL的溶液335 mL,然后向其中加入125 mL,0.2 mol/L的KCl溶液,充分混匀。
pH4.5缓冲液的配制:称取27.215 g CH3CO2Na·3H2O于烧杯中,称取12 mol/L的浓盐酸(约10 mL),调整pH至4.5再用蒸馏水定容至500 mL容量瓶中。
pH0.5、0.75、1.5、2.0、3.0、3.5、4.0和5.0的配制方法:将0.1 mol/L的柠檬酸溶液缓慢加到1 mol/L的盐酸溶液中,调整至实验所需的pH。
酸化乙醇:乙醇浓度60%,pH为3的酸化乙醇溶液。
1.2.2 实验样品制备 参照文献[15-16],稍有改动。
1.2.2.1 黑小麦全麦粉花色苷提取液 称取黑小麦全麦粉50 g,60%的酸化乙醇溶液在60 ℃下浸提2 h,浸提3次至为无色,得黑小麦全麦粉浸提液,将该浸提液以转速5000 r/min,离心10 min,取上清液为黑小麦全麦粉花色苷提取液。
1.2.2.2 黑小麦全麦粉花色苷浓缩液 使用0.05%的α-中温淀粉酶、0.05%的果胶酶以及0.02%的乙酰甲壳素,温度60 ℃澄清上清液1 h,去除可溶性固形物;55 ℃,100 r/min下旋转蒸发真空浓缩,得到粗花色苷色素浓缩液。
1.2.2.3 黑小麦全麦粉花色苷纯化干燥 向该花色苷色素浓缩液中加入5倍体积乙醇,采用AB-8大孔树脂吸附解析,90%乙醇为洗脱剂,上样流速为1.0 BV/h,解吸流速为 2.0 BV/h[16],低温真空浓缩得花色苷浓缩液,再经过大孔吸附树脂纯化的黑小麦全麦粉花色苷冷冻干燥48 h,得花色苷粗品。
1.2.2.4 样品的制备 称取1 mg黑小麦全麦粉花色苷粗品,用pH3.0的柠檬酸缓冲液定容至100 mL容量瓶内,用于后续实验。
1.2.3 pH示差法测定黑小麦全麦粉中花色苷含量的条件
1.2.3.1 最大吸收波长的确定 吸取一定量的样品,用紫外-可见光谱仪在250~650 nm波长范围内对该样品进行扫描,测定黑小麦全麦粉花色苷粗品的最大吸收波长。
1.2.3.2 pH确定 根据文献[12,17-18],稍有改动,分别吸取2 mL(注:取样量为所测总体积的20%,不影响缓冲溶液缓冲能力的取样量最大限)样品于10个试管中,在最大吸收波长下,分别测定黑小麦全麦粉花色苷提取液,使其处于pH=0.5、0.75、1.0、1.5、2.0、3.0、3.5、4.0、4.5、5.0缓冲液中时的吸光度,以去离子水为空白对照,以排除待测液的干扰。
1.2.3.3 平衡时间和平衡温度的确定 将样品于吸光度最大与最小的两组缓冲溶液环境中进行平衡,分别在平衡温度为20、40和60 ℃下每平衡5 min测一次其吸光度,当吸光度最终趋于稳定时,实验结束,并记录其结果。得到最短平衡时间以及最适宜平衡温度[12-14]。
1.2.3.4 pH示差法的精密度考察 取2 mL样品,分别加入pH为1.0和4.5的缓冲液8 mL,结合比尔定律,平行测定6次,计算得出黑小麦全麦粉花色苷的含量[19-20]。
式(1)
式中,A0-pH1.0时花色苷的吸光度;A1-pH4.5时花色苷的吸光度;V-提取液总体积(mL);n-稀释倍数;M-矢车菊-3-葡萄糖苷(Cy-3-Glu)相对分子质量(449);ε-Cy-3-Glu的消光系数(29600);m-样品质量(mg)。
1.2.4 黑小麦全麦粉花色苷DPPH·清除率测定 参照雷月等[21]的稍有改动,将2mL 10×10-4mol/L DPPH无水乙醇溶液加入具塞试管中,再加入2 mL不同质量浓度的黑小麦全麦粉花色苷粗品溶液,摇匀,反应在室温下进行30 min,在517 nm下测量吸光度,并通过下式计算分析物对DPPH自由基的抑制率。
式(2)
式中,A0-2 mL DPPH溶液与2 mL乙醇溶液的混合液的吸光度;A-2 mL样品溶液和2 mL DPPH溶液的混合液吸光度;Ai-2 mL样品溶液和2 mL乙醇溶液的混合液的吸光度。
1.2.5 黑小麦全麦粉花色苷羟自由基(·OH)清除率测定 按照[21-22],稍有改动。在具塞管中加入1 mL 10 mmol/L的FeSO4溶液,2 mL 10 mmol/L水杨酸溶液(水杨酸溶液的溶剂为乙醇),然后加入不同浓度的黑小麦全麦粉花色苷粗品溶液2 mL,最后加入2 mL 8.8 mol/L H2O2溶液,将具塞管放入37 ℃恒温水浴锅中反应30 min,在510 nm处检测各个样品的吸光度,以蒸馏水作参比,计算其清除率。
式(3)
式中:A1-对照液的吸光度;A2-加入花色苷溶液后的吸光度;A3-不加显色剂H2O2其溶液的吸光度。
式(4)
式中:B0-为空白对照液吸光度;B1-为样品的吸光度;B2-为样品本身的吸光度。
1.3 统计分析
3次平行实验后,采用SPSS 19.0和Excel 2010多重比较pH示差法测定黑小麦全麦粉花色苷含量与其测定条件之间的关系及其抗氧化性能的变化。
2 结果与分析
2.1 黑小麦全麦粉花色苷吸收光谱测定
通常情况下,酰基化的花色苷衍生物在紫外区域主要有两个吸收带,一个是在240~280 nm,是由A环上的苯甲酰基团引发的,另一个是在300~400 nm处,主要是由B环上的酰基化基团引发的。在可见光区500~550 nm区会有一个花色苷的特征峰,峰位置会受糖基数目和位置、花色苷母核、溶剂等因素影响[24]。由图1可知,在pH为3.0的条件下,黑小麦全麦粉花色苷在紫外光区的吸收峰分别为280和320 nm,可见光区的最大吸收波长为531 nm,说明黑小麦全麦粉有花色苷特征吸收峰,且其花色苷色素中有酰基化基团,而被酰基化的花色苷的稳定性远高于未被酰基化的花色苷[25-26]。由此得出,黑小麦全麦粉花色苷较稳定,适用于pH示差法测定黑小麦全麦粉花色苷的含量。

图1 黑小麦全麦粉花色苷紫外可见吸收光谱图Fig.1 UV-Vis absorption spectrum wavelength of anthocyanins in whole wheat flour of black wheat
2.2 两个最适pH的确定
根据pH示差法原理,所选的两个特定pH,必须符合其吸光度在这两个特定pH下的吸光度差值最大,同时又对花色苷有极高相对稳定性的缓冲溶液pH[17]。
由图2可知,在最大吸收波长531 nm处,分别测定样品处于pH=0.5、0.75、1.0、1.5、2.0、3.0、3.5、4.0、4.5、5.0 缓冲液中的吸光度,得出两个吸光度差值最大且相对稳定的pH分别是pH1.0和pH4.5,这与王少波等[27]测定黑豆皮花色苷含量和杨萍等[12]测定黑枸杞花色苷含量分析出的两个最适pH一样。
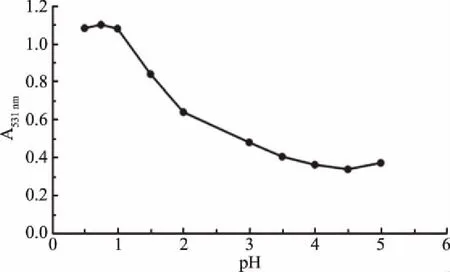
图2 不同pH对花色苷吸光度的影响Fig.2 Effect of different pH on the absorption of anthocyanins
综上所述,利用pH示差法测定黑小麦全麦粉花色苷含量时,选择pH1.0和pH4.5来测定黑小麦全麦粉花色苷的吸光度是可行的。
2.3 平衡时间和平衡温度的确定
将处于pH1.0与pH4.5的两组缓冲溶液环境下的样品进行平衡,结果如图3和图4。
由图3可知,黑小麦全麦粉花色苷样品在pH=1.0时,当其分别处于20和40 ℃时,其吸光度会随着时间的逐渐延长而逐渐趋于稳定,且均呈逐渐增长的趋势。其中,当平衡温度为到40 ℃时,平衡时间只需25 min,且此情况下,体系达到最稳定状态;当温度为20 ℃时,样品需要平衡的时间较长,且其峰值较低于40 ℃,这也许是受热时间过长,使花色苷发生水解或者去糖基开环反应,导致花色苷降解率大,从而使其峰值较低于40 ℃时的峰值[28-29]。但当平衡温度为60 ℃,虽然样品的吸光度迅速达至峰值,但是吸光度极其不稳定,达到峰值后,瞬间出现下降的趋势,这是因为温度越高,花色苷降解越快,且保持的平衡时间越短[29]。因此,在pH1.0的缓冲液中时,最适宜的平衡温度为40 ℃,最适宜的平衡时间为25 min。
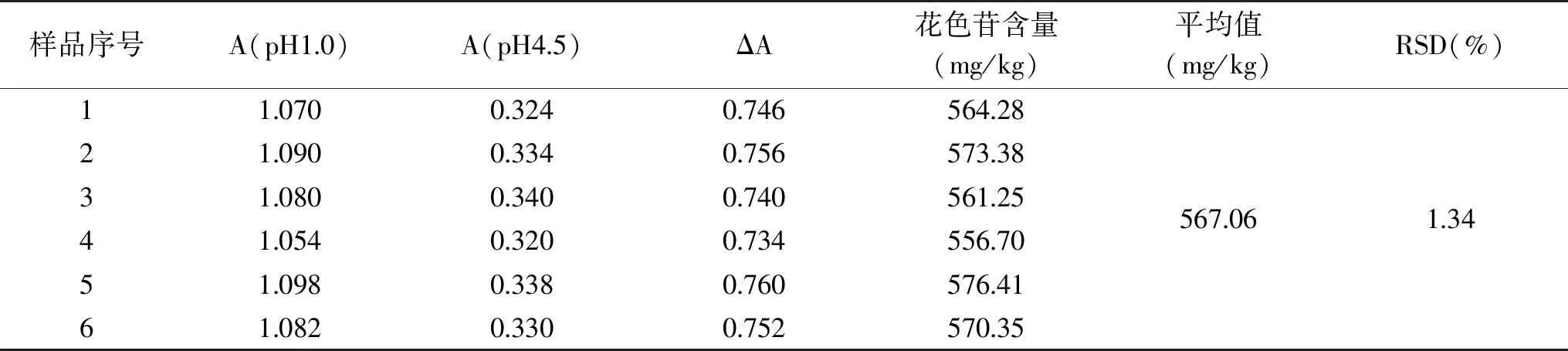
表1 黑小麦全麦粉花色苷精密度实验Table 1 Precision experiment of anthocyanin in black wheat whole wheat flour
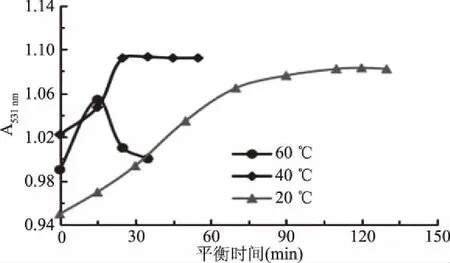
图3 样品在pH1.0的缓冲液中平衡情况Fig.3 The sample equilibrium in a pH1.0 buffer solution
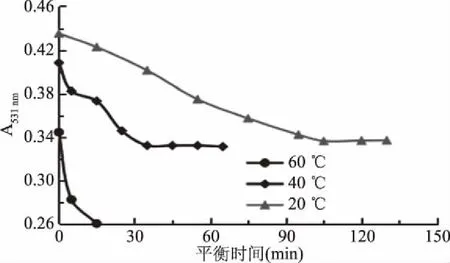
图4 样品在pH4.5的缓冲液中平衡情况Fig.4 The sample equilibrium in a pH4.5 buffer solution
如图4所示,当样品在pH=4.5时,其吸光度会随着时间的推移而逐渐趋于平缓,且均呈逐渐降低的趋势。当温度为 40 ℃时,其吸光度在很短的时间内达到平衡,平衡在35 min时已经完成;当温度为 20 ℃时,需要较长的平衡时间。在60 ℃时,吸光度迅速下降,且一直处于变化的状态,极其不稳定。这是因为温度越高,花色苷越不稳定,且其降解速率越快。在相同温度下,与图3有不一样的变化趋势,因为不同pH会对花色苷的热降解途径产生不同的影响[30-31]。所以,样品在pH4.5的缓冲液中时,最适宜的平衡温度为40 ℃,最适宜的平衡时间为35 min。
综上,pH1.0缓冲液最适平衡时间为25 min,pH4.5缓冲液最适平衡时间为35 min,其最适温度均为40 ℃。
2.4 黑小麦全麦粉花色苷含量测定的精密度
结合上述实验分析得出最佳优化条件,最大吸收波长531 nm,最适两个pH分别是pH1.0和pH4.5,最佳平衡温度40 ℃,最佳平衡时间分别为25和35 min,进行黑小麦全麦粉花色苷精密度实验。
由表1可知,在所选定的pH1.0和pH4.5的缓冲液中,通过对黑小麦全麦粉花色苷吸光度的6次平行测定,计算得出,黑小麦全麦粉花色苷的含量为567.06 mg/kg,计算得到6次平行测定的花色苷含量的相对偏差(RSD)为1.34%。所以,pH示差法能很好的消除样品溶液中其杂质对测定结果的影响,从而使其重复性更强。
2.5 黑小麦全麦粉花色苷DPPH·清除率测定
由图5可知,黑小麦全麦粉花色苷对DPPH·具有很强的清除能力。在一定的浓度范围内,花色苷的DPPH·清除率随着其质量浓度的增加而逐渐增大,且增长速度逐渐趋于平缓。当浓度为0.25 mg/mL时,其花色苷DPPH·的清除率为91.00%,而抗坏血酸的DPPH·的清除率为80.34%,因此,该花色苷体外清除DPPH·的能力较高于抗坏血酸。本实验结果与张镜等[10]研究结果较一致,即阴香果实花色苷体外清除DPPH·的能力同样高于抗坏血酸,刘国凌等[32]同样发现岗稔花色苷对DPPH·的清除能力明显高于抗坏血酸。但黑小麦全麦粉花色苷体外清除DPPH·的能力低于阴香果实花色苷和岗稔花色苷。而冷梅等[11]研究表明,紫叶稠李果实花色苷体外清除DPPH·的能力低于抗坏血酸。吕春茂等[33]指出,北春越橘花色苷清除DPPH·的能力与抗坏血酸无明显差异。这也许是不同来源的植物花色苷,其体外清除DPPH·的能力也有所不同,或者花色苷浓度不同导致其体外清除DPPH·的能力也不同[34-35]。

图5 黑小麦全麦粉花色苷DPPH·清除率Fig.5 DPPH· clearance rate of anthocyanins from black wheat whole wheat
2.6 黑小麦全麦粉花色苷·OH清除率测定
由图6分析可知,黑小麦全麦粉花色苷具有很强的体外清除·OH的能力,并且随着花色苷质量浓度的不断增加,清除能力逐渐增强。在0.1~0.3 mg/mL浓度范围内,花色苷的浓度与其·OH清除率呈一定的线性函数关系。当浓度为0.5 mg/mL时,花色苷的·OH的清除率为90.54%,而抗坏血酸·OH的清除率仅为52.30%,两者差异明显,且花色苷清除·OH的能力是抗坏血酸的1.73倍。因此,黑小麦全麦粉花色苷的体外清除·OH的活性远高于抗坏血酸。
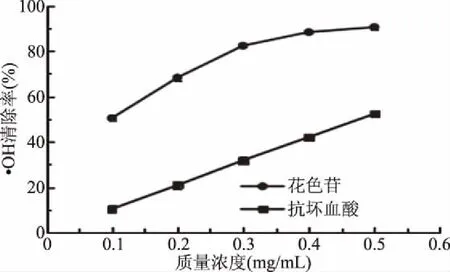
图6 黑小麦全麦粉花色苷·OH清除率Fig.6 ·OH clearance rate of anthocyanins from blackwheat whole wheat
张镜等[10]表明,阴香果实清除·OH的能力是抗坏血酸的16倍。李伟[36]研究指出,黑小麦麸皮花色苷体外清除·OH能力是抗坏血酸的1.5倍。本实验结果与大多数实验结果较一致,即一般情况下,花色苷清除·OH的能力高于抗坏血酸。这可能由于花色苷分子结构中羟基的个数不同,或者其分子结构中有无3位羟基,致使其对·OH的清除能力存在一定差异,但聂芊等[37]研究显示,不同植物来源的花色苷对·OH的清除能力也存在一定差异。
2.7 黑小麦全麦粉花色苷清除率测定
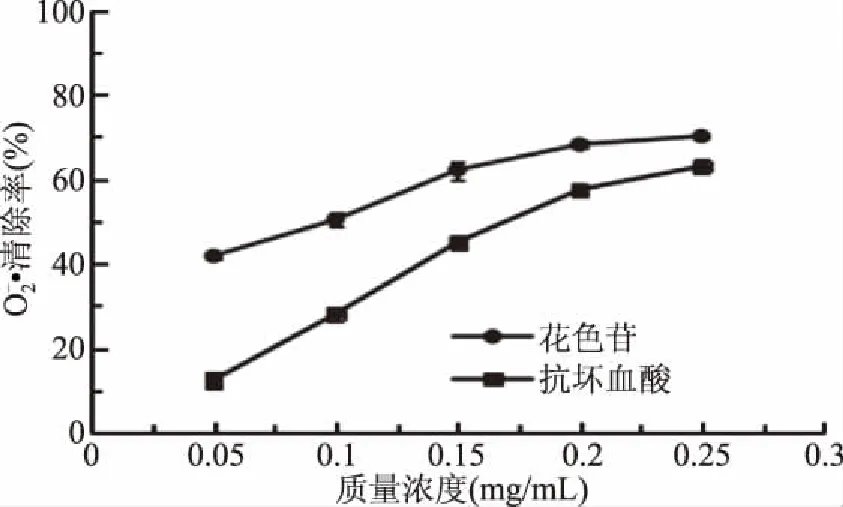
图7 黑小麦全麦粉花色苷的清除率 clearance rate of anthocyanins from black wheat whole wheat flour
综上分析可知,黑小麦全麦粉花色苷具有很强的体外抗氧化能力,且高于抗坏血酸。
3 结论