孔石莼多糖锌对Ⅰ型糖尿病小鼠糖脂代谢及体内抗氧化的干预作用
(福建农林大学食品科学学院,福建福州 350002)
糖尿病(Diabetes mellitus)是一种以高血糖为主要特征的代谢疾病,长期的高血糖可对人体的多个脏器造成损伤,进而引起一系列并发症,目前糖尿病已成为除癌症与心脑血管疾病外对人类生命的又一大威胁[1]。孔石莼多糖(Ulvapertusapolysaccharides,UP)是大型绿藻孔石莼的主要生理活性物质[2],研究表明,UP具有降血糖[3]、抗肿瘤[4]、降血脂[5]、抗氧化[6]、调节免疫功能[7]等多种生理活性。锌作为人体必需的微量元素,同时也是胰岛素的重要组成部分[8],补锌对糖尿病及其并发症的治疗有着良好的促进作用[9]。将天然多糖与锌进行络合改性,在保留各自独特生理活性的基础上,还可使其共同的活性协同增效,在保健品、药品等领域有着广阔的应用前景[10-11]。然而目前,尚未有研究人员对孔石莼多糖锌络合物(Ulvapertusapolysaccharides-zinc complex,UPZ)的相关生理活性进行探索。
基于此,本研究采用链脲霉素(STZ)诱导建立Ⅰ型糖尿病小鼠模型,以UP为参照物,以UPZ为试材,通过灌胃给药试验,从脏器指数、血糖、血脂代谢,体内抗氧化等方面综合评价UP及UPZ对糖尿病小鼠糖脂代谢及抗氧化能力的干预作用,为UP及UPZ的开发应用提供理论参考依据。
1 材料与方法
1.1 材料与仪器
UP(多糖含量53.35%)、UPZ(锌含量约为10%) 均为实验室自制,制备方法见参考文献[12];STZ 上海源叶生物科技有限公司;盐酸二甲双胍缓释片 天方药业有限公司;硫酸锌 恒鑫食品配料有限公司;甘油三酯(TG)试剂盒、总胆固醇(TC)试剂盒、低密度脂蛋白胆固醇(LDL-C)试剂盒、高密度脂蛋白胆固醇(HDL-C)试剂盒、总超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、过氧化氢酶(CAT)试剂盒 南京建成生物工程研究所;清洁级ICR雄性小鼠,体重(25±2) g 南京军区福州总医院,SYXK(闽)2018-0006。
HGM-114血糖仪、血糖试纸 欧姆龙有限公司;CF15RN高速冷冻离心机 日本日立公司;SYNERGY酶标仪 美国伯腾仪器有限公司;UV-1800PC紫外可见光分光光度计 上海美谱达仪器有限公司;BSA223S分析天平 北京赛多利斯科学仪器有限公司;HH-4数显恒温水浴锅 常州国华电器有限公司。
1.2 试验方法
1.2.1 Ⅰ型糖尿病鼠的建模 参考相关文献,并稍作修改[13-14]。健康ICR小鼠适应饲养7 d后,禁食16 h,随机选取10只作为正常组,其余小鼠以200 mg/kg·BW的剂量腹腔注射10 mg/mL的STZ溶液(0.1 mol/L pH=4.3柠檬酸缓冲液配制),正常组小鼠注射同体积柠檬酸缓冲液;注射72 h后,断尾采血,测定小鼠空腹血糖(取血前,小鼠禁食12 h),血糖≥11.1 mmol/L的小鼠视为造模成功,确定为Ⅰ型糖尿病鼠,未成模小鼠剔除。
1.2.2 分组与给药 取造模成功的糖尿病小鼠81只,随机分为9组,每组9只,分别是模型对照组,UP与UPZ低、中、高剂量组(剂量均依次为:75、150、300 mg/kg BW/d),无机锌(硫酸锌)对照组(按锌含量计15 mg/kg BW/d),阳性对照组(盐酸二甲双胍300 mg/kg BW/d);其中硫酸锌剂量的设置以成人硫酸锌片每天治疗摄入量(300 mg,其中锌含量68 mg)为依据,并参考前人研究[15],按照人与试验动物等效剂量系数换算得到;UPZ低、中、高剂量的锌含量分别设为硫酸锌含量的0.5、1、2倍。所有小鼠每天固定时间灌胃给药1次,各组均按0.15 mL/10 g BW持续灌胃4周;模型组与正常组每日灌胃蒸馏水,给药组分别对应灌胃上述的试样溶液。
1.2.3 小鼠体重测定 从灌胃给药开始后,每周对各组小鼠的体重进行测定。
1.2.4 小鼠空腹血糖测定 灌胃给药0、2、4周后,各组动物均禁食12 h,剪尾采血,测定空腹血糖值。
1.2.5 小鼠糖耐量测定 灌胃给药4周后,各组小鼠禁食12 h,分别按2 g/kg BW的剂量灌胃葡萄糖(配制成浓度为133 mg/mL的溶液),剪尾采血,分别测定0、30、60、120 min 时的血糖值,观察各组小鼠在喂食葡萄糖后各时间点的血糖水平变化,并按照下列公式计算血糖曲线下面积(Area under the curve,AUC)[16]。
式中,A、B、C、D分别为灌胃葡萄糖溶液0、30、60、120 min时小鼠的血糖值。
1.2.6 小鼠脏器指数测定 小鼠灌胃给药4周后,禁食12 h,称重。引颈法处死小鼠,迅速摘除其脾脏、肝脏、肾脏,使用生理盐水漂洗后滤纸吸干、称重,按照以下公式计算其脏器指数。
脏器指数(mg/g)=脏器质量(mg)/体质量(g)
1.2.7 小鼠血清血脂指标测定 灌胃给药4周后,各组小鼠禁食12 h,采用眼球摘除法取各试验组小鼠的血液,静置,待其分层后,以3000 r/min离心10 min,取上清液得血清。按照试剂盒说明测定其血清中的TC、TG、LDL-C和HDL-C浓度。
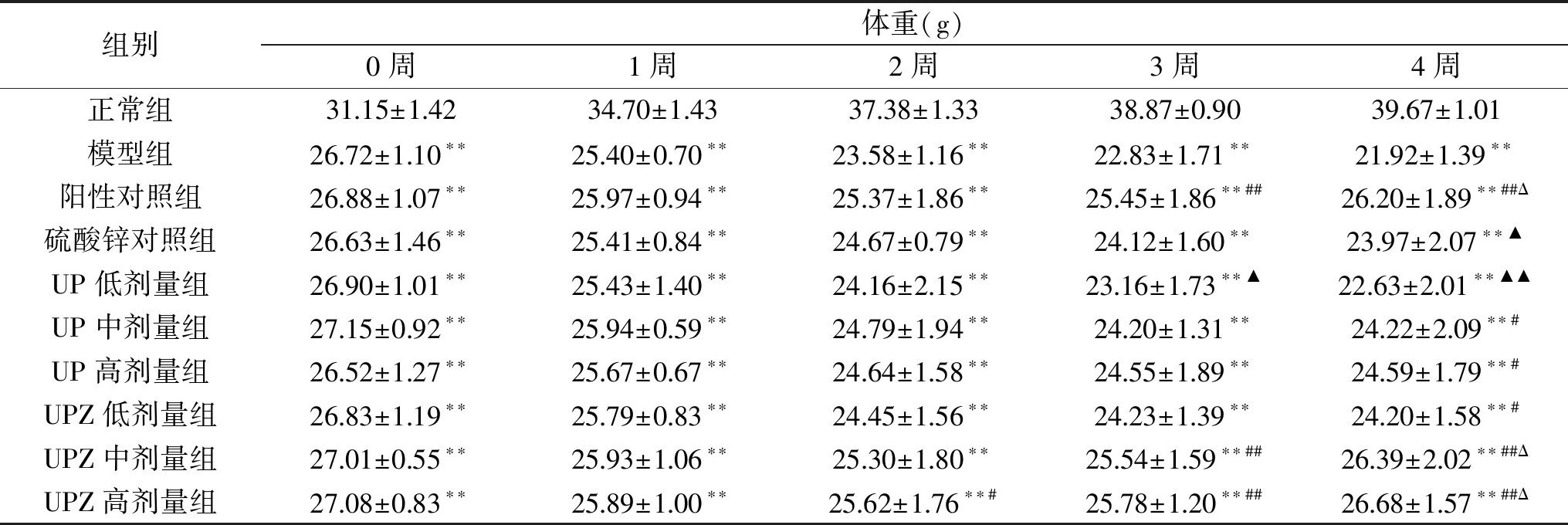
表1 孔石莼多糖及其锌络合物对糖尿病小鼠体重的影响Table 1 Effects of UP and UPZ on weight of diabete mice
注:与正常组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与模型组相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);与阳性对照组相比,▲表示差异显著(P<0.05),▲▲表示差异极显著(P<0.01);与硫酸锌对照组相比,Δ表示差异显著(P<0.05),ΔΔ表示差异极显著(P<0.01)。表2~表6同。
1.2.8 小鼠肝脏抗氧化指标测定 准确剪切一定质量的肝脏组织,按质量体积比(g∶mL)1∶9加入冰生理盐水,研磨成浓度10%的肝脏匀浆,于冷冻离心机4 ℃、3000 r/min下离心10 min,收集上清液,按试剂盒说明对小鼠肝脏组织中MDA含量、CAT、SOD、GSH-Px活性进行测定。
1.3 数据处理
使用软件DPS v7.05对试验数据进行统计学分析,各组数据之间的多重比较使用LSD法,其中,以P>0.05为差异不显著,P<0.05为显著,P<0.01为极显著。试验数据均用平均值±标准差表示。因在试验过程中有个别小鼠死亡,各组试验数据以n=8进行分析处理。
2 结果与分析
2.1 糖尿病小鼠造模情况
与正常组小鼠相比,各组经过STZ造模的小鼠精神萎靡、行动迟缓,其进食、饮水、排尿量明显增多,垫料容易潮湿,符合糖尿病患者“三多”的典型症状;经测定,各组小鼠空腹血糖均高于11.1 mmol/L,说明糖尿病小鼠造模成功。
2.2 UP与UPZ对糖尿病小鼠体重的影响
多饮、多食、多尿、身体消瘦是糖尿病人常见的症状,即俗称的“三多一少”[17-18]。从表1中可以看出,在试验开始时,与正常组小鼠相比,其余各组病鼠体重均极显著(P<0.01)下降。灌胃4周后,正常组小鼠的体重逐渐上升,模型组病鼠体重则呈下降趋势,推测该现象为糖尿病引发病鼠机体代谢紊乱所致。灌胃4周后,除UP低剂量组外,UP中、高剂量组、UPZ低剂量组病鼠的体重显著(P<0.05)高于模型组,UPZ中、高剂量组病鼠的体重则极显著(P<0.01)高于模型组,且UPZ中、高剂量组病鼠的体重与阳性对照组无显著差异(P>0.05),甚至略高,说明UP、UPZ对糖尿病小鼠的体重减轻均有一定减缓作用;且同剂量下,UPZ的效果显著(P<0.05)优于UP,中剂量UPZ的效果显著(P<0.05)优于锌含量相同的硫酸锌。
2.3 UP与UPZ对糖尿病小鼠空腹血糖的影响
表2可以看出,灌胃前,STZ造模的各组病鼠的空腹血糖浓度均极显著(P<0.01)高于正常组小鼠,且各造模组之间无显著差异(P>0.05)。在试验周期内,正常组小鼠的血糖无显著(P>0.05)变化,而模型组病鼠的血糖则一直处于较高水平。第4周,除UP低剂量组病鼠的空腹血糖显著(P<0.05)低于模型组外,其余各给药组病鼠的空腹血糖均极显著(P<0.01)低于模型组,并呈明显的量效关系;其中UP高剂量组、UPZ中、高剂量组病鼠的空腹血糖与阳性对照组无显著差异(P>0.05),且UPZ高剂量组病鼠的空腹血糖显著(P<0.05)低于同剂量的UP组,说明UPZ比UP具有更好干预病鼠血糖上升的效果。
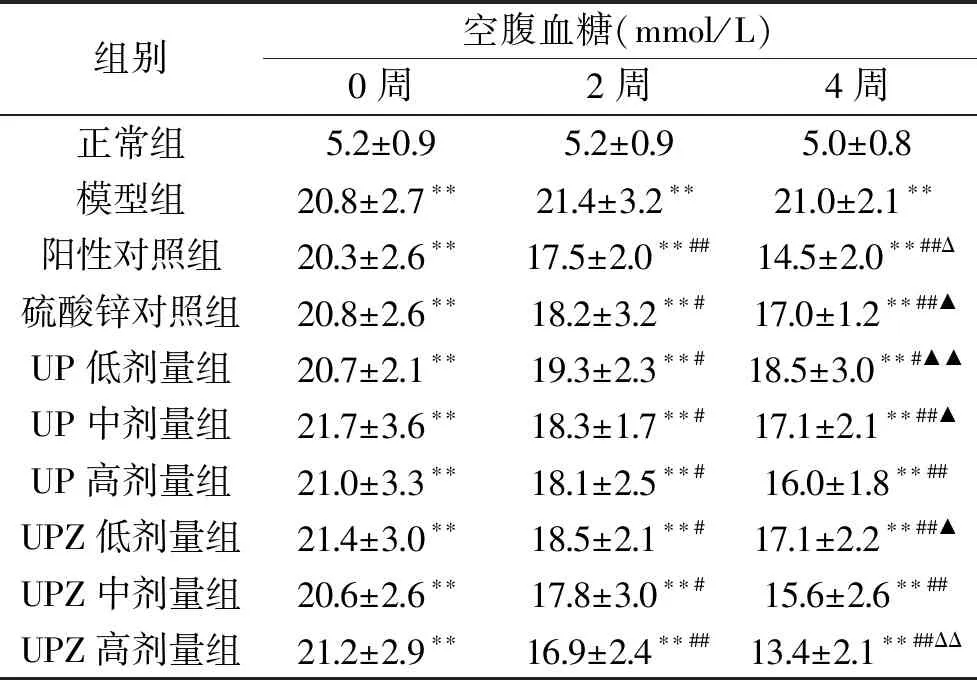
表2 孔石莼多糖及其锌络合物 对糖尿病小鼠空腹血糖的影响Table 2 Effects of UP and UPZ on blood glucose of diabetes mice
2.4 UP与UPZ对糖尿病小鼠糖耐量的影响
糖耐量即是指动物体对血糖浓度的调节能力[19]。从表3可看出,灌胃葡萄糖溶液后,各组小鼠的血糖均上升,并在60 min左右均达到峰值,在60~120 min内,各组小鼠血糖呈下降趋势;至120 min,正常组小鼠的血糖与0 min时已无显著差异(P>0.05),而其余各组病鼠的血糖仍显著(P<0.05)高于0 min,其中,UP低剂量组病鼠的血糖显著(P<0.05)低于模型组,其余各给药组病鼠的血糖则极显著(P<0.01)低于模型组。AUC是一种反映血糖水平的指标,相较于单点的血糖值,通过计算AUC可更为全面地分析血糖变化的时间和程度,其值越小,说明糖耐量越强。结合AUC值可发现,模型组病鼠的AUC极显著(P<0.01)大于正常组小鼠,说明STZ诱导的糖尿病明显损伤了小鼠的糖代谢机能;而各给药组病鼠的AUC除UP低剂量组显著(P<0.05)小于模型组外,均极显著(P<0.01)小于模型组;其中UPZ中、高剂量组小鼠的AUC与阳性对照组无显著差异(P>0.05);但各给药组与正常组间仍存在极显著差异(P<0.01)。结果表明,UPZ改善糖尿病小鼠血糖代谢,提高其糖耐量的效果优于UP。

表3 孔石莼多糖及其锌络合物对糖尿病小鼠糖耐量的影响Table 3 Effects of UP and UPZ on glucose tolerance of diabetes mice
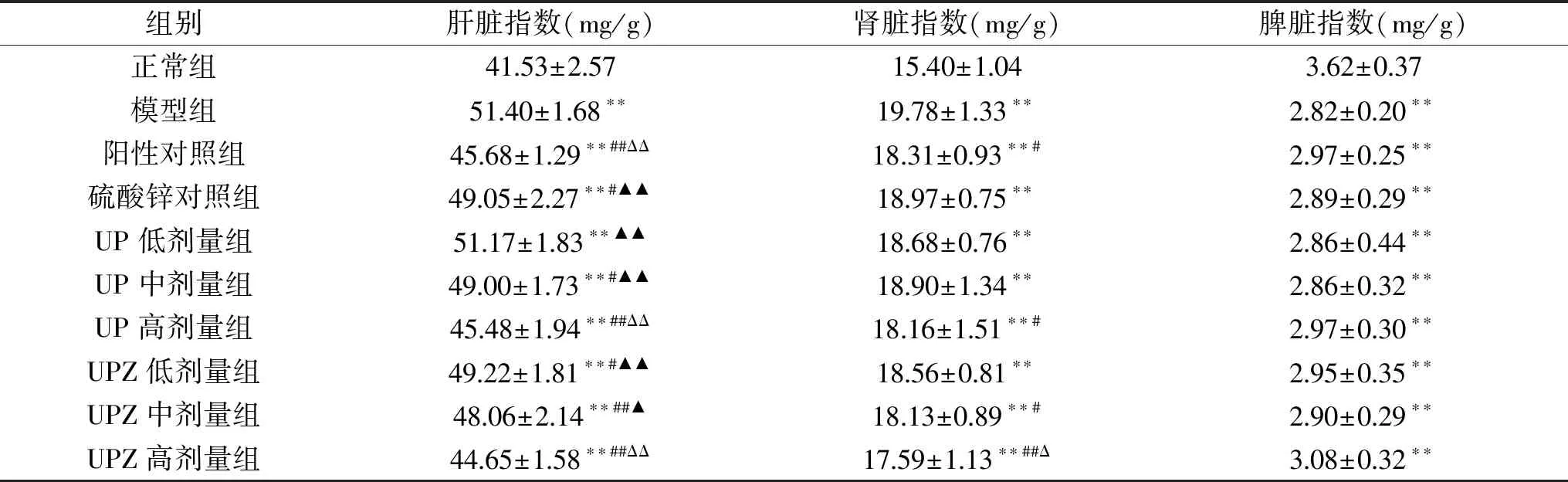
表4 孔石莼多糖及其锌络合物对糖尿病小鼠脏器指数的影响Table 4 Effects of UP and UPZ on organ index of diabetes mice
2.5 UP与UPZ对糖尿病小鼠脏器指数的影响
在糖尿病患者过于亢进的糖代谢下,作为糖代谢的最重要器官,肝脏、肾脏往往会发生肿大[20];而当糖尿病导致生物体免疫功能损伤时,机体最大的免疫器官脾脏则会发生器官萎缩[21];因此通过对脏器指数的测定,可以较为直观地体现机体器官受糖尿病损伤的程度。从表4可以看出,与正常组相比,模型组病鼠的肝脏、肾脏指数极显著(P<0.01)升高,脾脏指数极显著(P<0.01)降低。UP中剂量组、UPZ低剂量组病鼠的肝脏指数显著(P<0.05)低于模型组,而UP高剂量组、UPZ中、高剂量组病鼠的肝脏指数则极显著(P<0.01)低于模型组。且UP与UPZ高剂量组病鼠的肝脏指数与阳性对照组无显著差异(P>0.05)。UP高剂量、UPZ中剂量组病鼠的肾脏指数显著(P<0.05)低于模型组,而UPZ高剂量组小鼠的肾脏指数极显著(P<0.01)低于模型组,且三者与阳性对照组均无显著差异(P>0.05)。各给药组病鼠的脾脏指数较模型组均有不同程度地上升,但并未产生显著差异(P>0.05)。综上,UPZ对受试糖尿病小鼠脏器损伤的修复作用优于同剂量的UP。
2.6 UP与UPZ对糖尿病小鼠血清血脂指标的影响
胰岛素不仅对糖代谢至关重要,同时也是脂代谢不可或缺的调节激素。大量研究表明,糖尿病的发生常常导致血脂代谢紊乱[22]。从表5可知,除阳性对照组病鼠血清的HDL-C与正常组无显著差异(P>0.05)外,其他各组病鼠血清的TC、TG、LDL-C均较正常组极显著(P<0.01)上升,而HDL-C则均极显著(P<0.01)降低。相较模型组,UP高剂量组、UPZ中、高剂量组病鼠血清的TC、TG、LDL-C均极显著(P<0.01)降低,HDL-C均极显著(P<0.01)上升;UP中剂量组病鼠血清的TG显著(P<0.05)降低,HDL-C极显著(P<0.01)上升;而UPZ低剂量组病鼠血清的LDL-C极显著(P<0.01)降低,HDL-C极显著(P<0.01)上升。
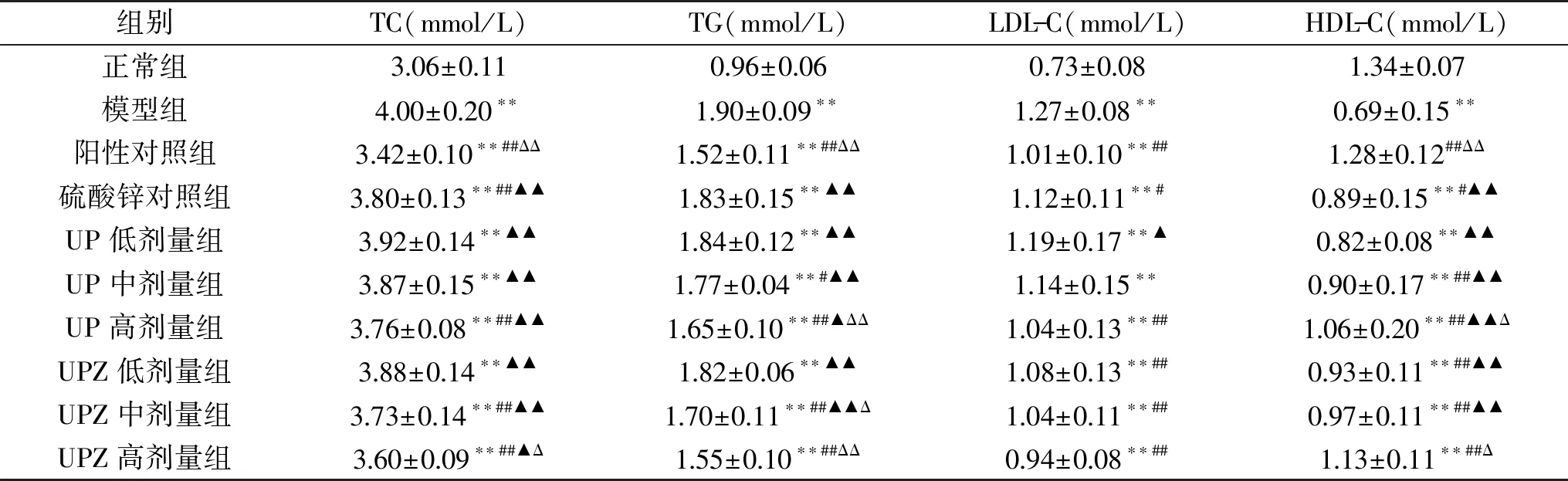
表5 孔石莼多糖及其锌络合物对糖尿病小鼠血脂的影响Table 5 Effects of UP and UPZ on blood lipids of diabetes mice
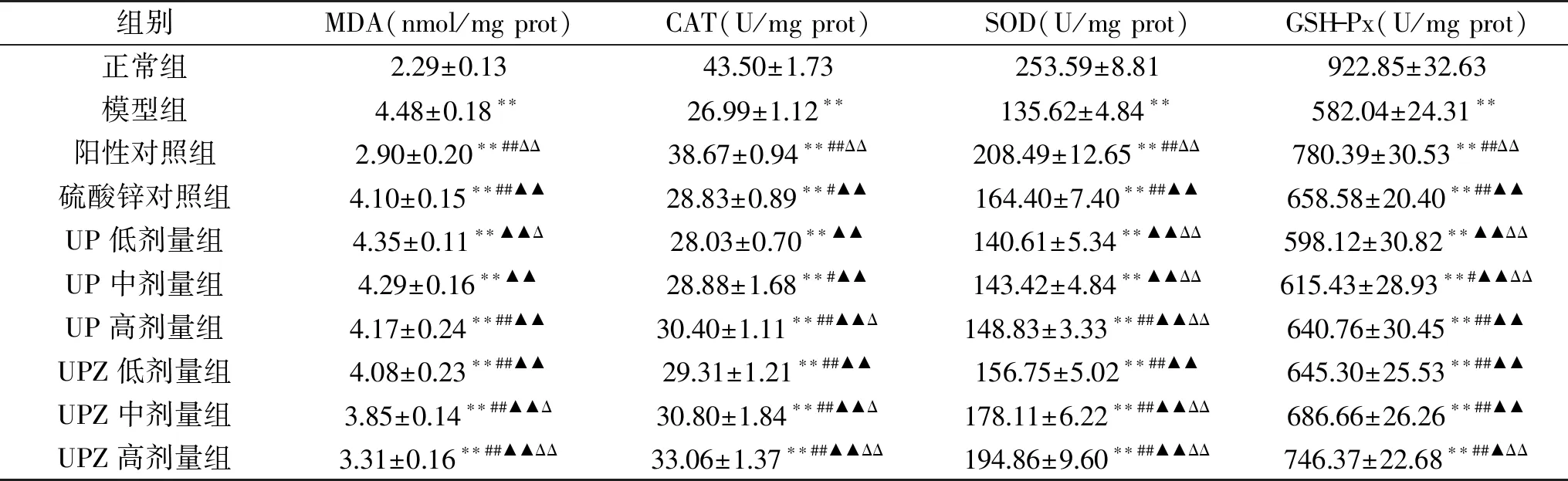
表6 孔石莼多糖及其锌络合物对糖尿病小鼠抗氧化能力的影响Table 6 Effect of UP and UPZ on antioxidant function of diabetes mice
提示两试样对病鼠血脂代谢的紊乱均有一定的校正作用,且校正程度与剂量呈正相关关系,其中UPZ高剂量组病鼠血清的TG、LDL-C、HDL-C与阳性对照组无显著差异(P>0.05)。从表5中还可获悉,UPZ中剂量组病鼠的各项血脂指标值优于锌含量相同的硫酸锌组,特别是TG较硫酸锌组显著(P<0.05)降低;且UPZ各剂量组病鼠血清的TC、LDL-C显著(P<0.05)低于相应剂量UP组,说明UPZ对糖尿病小鼠的血脂代谢的校正作用较UP显著(P<0.05)增强。
2.7 UP与UPZ对糖尿病小鼠肝脏抗氧化指标的影响
机体内过量自由基的氧化作用与其衰老、疾病等有着直接的联系。CAT、SOD、GSH-Px为生物体内十分重要的抗氧化酶,具有抑制自由基产生、减少氧化损伤的作用[23-24]。MDA则是机体自由基作用于脂质的过氧化产物。通过对这些指标进行测定,可以直观地反映机体的抗氧化能力,其中抗氧化酶活性越强,MDA含量越低,说明机体对氧化作用的抑制能力越强,即抗氧化能力越强。表6数据显示,与正常组相比,模型组病鼠肝脏CAT、SOD、GSH-Px的活性均极显著(P<0.01)降低,而MDA含量极显著(P<0.01)增加,说明STZ诱导的糖尿病使小鼠肝脏的抗氧化能力受到明显损伤。经过4周的灌胃,除UP低、中剂量组外,其余各给药组小鼠肝脏的CAT、SOD、GSH-Px活性均极显著(P<0.01)高于模型组,MDA含量均极显著(P<0.01)低于模型组;而UP中剂量组小鼠肝脏的CAT、GSH-Px活性亦显著(P<0.05)高于模型组;说明两试样对糖尿病小鼠的肝脏抗氧化能力均有一定的改善作用,且存在明显的量效关系。另外,UPZ的改善效果极显著(P<0.01)强于同剂量的UP。中剂量UPZ对病鼠肝脏MDA含量、CAT活性的改善效果显著(P<0.05)强于锌含量相同的硫酸锌,对SOD活性的改善效果极显著(P<0.01)强于锌含量相同的硫酸锌。
3 讨论与结论
糖尿病主要分为Ⅰ型糖尿病、Ⅱ型糖尿病、妊娠期糖尿病等。Ⅰ型糖尿病尽管发病率较低,但起病急骤、症状严重,患者生活质量差,且其病理机制尚存在许多不明确之处,故进行Ⅰ型糖尿病的研究对糖尿病防治领域具有重要的意义[25]。胰岛素的绝对缺乏是Ⅰ型糖尿病最主要的生理特征,缺乏胰岛素的调节,动物体利用和转化葡萄糖的过程将受到抑制,从而导致血糖升高和一系列并发症。
长期的高血糖会导致机体产生过高的糖化反应和氧化应激反应,促进炎症的产生与发展,从而对各个脏器造成慢性损伤,并导致机体的抗氧化能力下降[26-27]。同时,胰岛素对脂质代谢亦有重要的调节作用,当机体缺乏胰岛素时,脂肪合成减少,分解加强,从而引起血脂升高,故糖尿病患者在血糖升高的同时往往会出现血脂代谢紊乱。迄今为止,有关天然多糖对糖尿病的治疗效果表明,多糖对糖尿病的干预作用机制主要包括:促进机体胰岛β细胞再生,改善胰岛素分泌;恢复胰岛素抵抗,提高其作用效率;改善免疫系统和抗氧化能力;调节糖脂代谢,促进机体对葡萄糖的吸收利用等[28-30]。本研究结果显示,UPZ与UP均可有效缓解糖尿病小鼠的“三多一少”症状,降低其空腹血糖,提高糖耐量;同时降低病鼠血清中的TC、TG、LDL-C浓度,提高HDL-C浓度,改善其血脂指标,推测两试样可能可以促进病鼠胰岛β细胞的修复和再生,改善胰岛素的分泌,在一定程度上缓解糖尿病小鼠的糖脂代谢紊乱[31];UPZ与UP还可降低糖尿病小鼠的肝脏、肾脏指数,说明两者对病鼠的肝脏、肾脏具有保护和修复作用,可拮抗高血糖对脏器造成的慢性损伤,抑制代谢器官的肿大[32];此外二者还可显著(P<0.05)提升糖尿病小鼠肝脏中CAT、SOD、GSH-Px等抗氧化酶的活性,降低MDA含量,通过增强病鼠体内抗氧化酶的活性,恢复其清除自由基的能力,减轻氧化应激对小鼠机体的损害,也是两者改善糖尿病小鼠各项症状的途径之一[33]。
本研究结果表明,UPZ对Ⅰ型糖尿病小鼠糖脂代谢与体内抗氧化的干预效果均明显强于同剂量的UP;而且中剂量UPZ的干预效果亦明显强于锌含量相同的硫酸锌(无机锌),推测可能是UP与锌络合后,不仅提高了原多糖降血糖、调节血脂、抗氧化等活性,同时亦增强了锌的生理活性。UPZ作为一种新型的生物补锌剂,具备良好的生理活性,在食品、保健品等领域有着广阔的开发前景。

