匙羹藤酸调节仓鼠血脂机理的研究
,2,3,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.天津科技大学食品工程与生物技术学院,食品营养与安全教育部重点实验室,天津 300457;3.天津食品安全低碳制造协同创新中心,天津 300457)
随着我国居民生活水平的不断提升,传统的饮食结构发生改变,高脂、高糖和缺乏运动等不健康的生活模式导致高脂血症及其并发症的发病率越来越高且日益低龄化。就高胆固醇血症而言,从2002~2012年间,我国居民的患病率就增加了4倍[1-2]。目前市场上主要用于降脂的药物为他汀类药物,部分高脂血症的患者由于其副作用而无法使用他汀类药物进行治疗[3-4],另外随着我国居民对健康意识的提高,效果好、使用更安全的可用于预防降血脂的药食同源的天然产物更受大家的关注和青睐[5-6]。
匙羹藤(Gymnemasylvestre),萝藦科匙羹藤属,是一种传统民间草药,在印度以‘gurmar’(糖分杀手)而闻名,原产于印度中西部,也分布于非洲、澳大利亚和中国的热带森林中,具有降糖降脂[7-9]、控制体重[10]、抗龋齿[11]、抑菌[12-13]、免疫调节[14]等作用,被广泛应用于食品、保健品、化妆品等行业[15-16]。匙羹藤酸是从匙羹藤中分离出来的三萜皂苷类物质混合物[17-18],具有抑制小肠对油酸的吸收[19]、抑制三磷酸甘油醛脱氢酶活性[20]、抑制蛋白质合成[21]、抑制α葡萄糖苷酶[22]、抑制钠依赖性葡萄糖转运蛋白1活性[23]等多种生物活性,被广泛用于治疗由代谢紊乱引起的疾病,是匙羹藤降糖降脂的主要活性成分[24]。目前已经有很多的研究证明匙羹藤酸具有调节血脂功效,Renga等[17]通过体外实验,发现匙羹藤酸I可以抑制高脂细胞内脂类的积累,但是对匙羹藤酸调节血脂活性及机理的研究鲜有报导。因此本实验就匙羹藤酸调节高脂仓鼠血脂水平及其机制进行了研究,为匙羹藤酸调节血脂的保健品的开发提供提供理论参考。
1 材料与方法
1.1 材料与仪器
匙羹藤酸(纯度75%)、仓鼠(Hamster)羟甲基戊二酸单酰辅酶A还原酶(HMGCR)ELISA检测试剂盒、胆固醇7α羟化酶(CYP7A1)ELISA检测试剂盒、酰基辅酶A:胆固醇酰基转移酶(ACAT)ELISA检测试剂盒 上海源叶生物科技有限公司;总胆固醇(T-CHO)测试盒、甘油三酯(TG)测试盒、高密度脂蛋白胆固醇(HDL-C)测试盒谷草转氨酶(AST)测试盒、谷丙转氨酶(ALT)测试盒 南京建成生物工程研究所;SPF级雄性仓鼠 40只,体重(100±10) g,购自斯贝福(北京)生物技术有限公司,实验动物质量合格证明编号:11401500033320,许可证号为SCXK(京)2014-0006;玉米淀粉 北京科澳协力饲料有限公司;基础饲料和高脂饲料 均由本实验室自制,基础饲料配方配方为玉米淀粉(50.80%)、酪蛋白(24.20%)、白砂糖(11.90%)、猪油(5.00%)、矿物质混合物(4.00%)、维生素混合物(2.00%)、明胶(2.00%)、DL-蛋氨酸(0.10%);高脂饲料配方为玉米淀粉(40.70%)、酪蛋白(24.20%)、白砂糖(11.90%)、猪油(15.00%)、胆固醇(0.10%)、矿物质混合物(4.00%)、维生素混合物(2.00%)、明胶(2.00%)、DL-蛋氨酸(0.10%)[25]。
Multiskan FC酶标仪 美国Thermo Fisher公司;MICRO 17R台式冷冻离心机 美国Thermo Fisher公司;ML204电子天平 梅特勒托利多仪器(上海)有限公司;CKX41倒置相差荧光显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 饲养条件及实验仓鼠分组 实验仓鼠饲养于天津科技大学清洁级动物饲养房中,室内温度为(22±2) ℃,湿度为50%~60%,12 h光照、明暗交替,并让其自由饮食和饮水。
选用健康雄性仓鼠40只,适应性喂养一周之后根据体重进行随机分组,分为5组,每组8只,分别为正常对照组(NC)、模型对照组(MC)、匙羹藤酸低剂量组(L)、匙羹藤酸中剂量组(M)、匙羹藤酸高剂量组(H)。
1.2.2 各个组别的灌胃方式 匙羹藤酸的灌胃方式如表1所示。

表1 各组仓鼠的灌胃方式Table 1 Gastric administration of hamsters in each group
1.2.3 样品采集 在0、4、8周周末对各组仓鼠进行眼眶静脉丛取血,采血前禁食不禁水12 h,在实验周的第8周周末禁食不禁水12 h后处死,处死前称其体重,股动脉取血,颈椎脱臼致死,快速分离肝脏、肾周脂肪、睾丸脂肪,后用生理盐水清洗,滤纸吸干,并称其质量。
1.2.4 指标的测定
1.2.4.1 仓鼠体重的测定 实验周期内每天观察仓鼠生长状况(仓鼠的毛色、进食、排便及活动等情况),每两周称量1次体重。
1.2.4.2 仓鼠肝脏脏器指数和脂肪系数的测定 分离出仓鼠的肝脏、双肾周脂肪组织和睾丸周脂肪组织,用生理盐水清洗,滤纸吸干后,称重量,肝脏脏器指数按式(1)计算,脂肪系数按式(2)计算。
式(1)

式(2)
1.2.4.3 仓鼠血清中血脂水平的测定 将第0、4、8周周末采集的血液样本,25 ℃放置2 h后,3000 r/min,4 ℃离心10 min,分离血清,测定各组仓鼠血清中TG、TC和HDL-C水平,并计算出non-HDL-C水平。具体检测方法按照南京建成生物研究所的总胆固醇(T-CHO)测试盒、甘油三酯(TG)测试盒、高密度脂蛋白胆固醇(HDL-C)测试盒说明书进行。non-HDL-C按式(3)计算。
Cnon-HDL-C=CTC-CHDL-C
式(3)
式中,CTC、CHDL-C、Cnon-HDL-C分别表示TC、HDL-C、non-HDL-C的含量,mmol/L。
1.2.4.4 仓鼠血清中肝损伤指标的测定及肝脏切片染色观察 将第8周周末采集的血液样本,25 ℃放置2 h后,3000 r/min,4 ℃离心10 min,分离血清,按南京建成生物研究所的谷草转氨酶(AST)检测试剂盒、谷丙转氨酶(ALT)检测试剂盒测定各组仓鼠血清中AST、ALT水平;采用HE染色法,取1 mm3肝小叶立方块[25],用4%的甲醛固定液固定、脱水、石蜡包埋、切片脱蜡、苏木精染色、伊红染色、切片脱水,染色切片在光学显微镜下进行观察和图像分析,观察肝脏的病理组织学变化。
1.2.4.5 仓鼠血清中胆固醇调控相关酶活的测定 将第8周股动脉采取的血样样本,25 ℃放置2 h后,3000 r/min离心10 min,离心后迅速分离血清,测定各组仓鼠血清中胆固醇调控相关酶HMGCR、CYP7A1、ACAT水平。具体检测方法按照上海源叶生物科技有限公司仓鼠(Hamster)羟甲基式二酸单酰辅酶A还原酶(HMGCR)ELISA检测试剂盒、仓鼠(Hamster)胆固醇7α羟化酶(CYP7A1)ELISA检测试剂盒、仓鼠(Hamster)酰基辅酶A:胆固醇酰基转移酶(ACAT)ELISA检测试剂盒进行检测。
1.2.4.6 仓鼠肝脏HMGCR酶活的测定 实验仓鼠处死后迅速分离肝脏、小肠,取0.1 g肝脏组织(小肠),用冰冷的生理盐水漂洗,除去血液,滤纸擦拭后称取0.1 g加入匀浆器中,再加入0.9 mL冷的无菌生理盐水于冰水浴条件下充分研磨,使组织匀浆化,随后转移匀浆液至1.5 mL离心管中,2000 r/min、4 ℃离心10~15 min,取适量上清液,按上海源叶生物科技有限公司的酶联免疫试剂盒测定各组仓鼠肝脏中胆固醇调控相关酶HMGCR酶活。
1.3 数据处理
采用Origin 2017作图,SPSS 17.0软件进行数据统计分析,实验数据以Mean±SD表示,多组间采用单因素方差分析,若方差齐时采用LSD检验,方差不齐性时采用Tamhane’s T2检验,P<0.05表示两组之间具有显著性差异,P<0.01表示两组之间具有极显著性差异。
2 结果与分析
2.1 匙羹藤酸对仓鼠体重的影响
在实验周期,每两周对实验仓鼠的体重进行称量一次,其体重变化见图1。如图1所示,灌胃前,各组仓鼠之间的体重无显著性差异(P>0.05),随着仓鼠鼠龄的增长,各组仓鼠体重都有所增长,但是在整个实验期间,模型对照组与正常对照组仓鼠体重无显著性差异(P>0.05),说明高脂饮食对仓鼠的体重均无显著性影响(P>0.05),这与王轶菲的玉米油甾醇对高脂高胆固醇膳食仓鼠胆固醇代谢调控及肠道菌群的影响中的结果一致[26],匙羹藤酸剂量组与模型对照组仓鼠体重无显著性差异(P>0.05),说明匙羹藤酸对仓鼠体重无显著性影响(P>0.05)。

图1 匙羹藤酸对仓鼠体重的影响Fig.1 Effect of gymnemic acid on the body weight of hamster
2.2 匙羹藤酸对仓鼠脏器指数和脂肪系数的影响
如表2所示,与正常对照组相比,模型对照组仓鼠的肝脏的脏器指数有极显著差异(P<0.01),说明高脂膳食会导致仓鼠肝脏肿大;正常组、模型组和剂量组的附睾脂肪系数无明显差异,说明匙羹藤酸以及高脂饮食对附睾脂肪系数无显著性影响,与模型对照组相比,匙羹藤酸剂量组仓鼠的肝脏的脏器指数有显著的下降(P<0.05),下降率分别为6.12%、12.24%、17.69%,表明匙羹藤酸对高脂膳食仓鼠引起的肝脏肿大有一定的缓解作用。
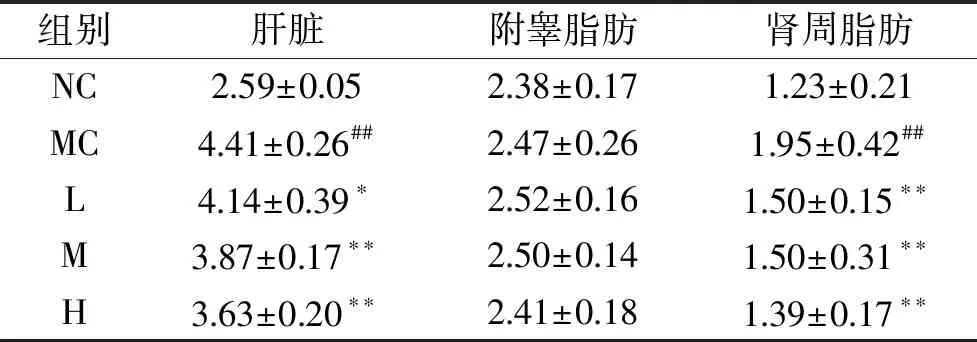
表2 匙羹藤酸对仓鼠脏器指数和脂肪系数的影响Table 2 Effects of gymnemic acid on the organ index and fat index of hamster
注:#模型对照组与正常对照组比较有显著差异,P<0.05;##模型对照组与正常对照组比较有极显著差异,P<0.01;*匙羹藤酸剂量组与模型对照组比较有显著差异,P<0.05;**匙羹藤酸剂量组与模型对照组比较有极显著差异,P<0.01;图2~图6、图8~图11同。
与正常对照组相比,模型对照组仓鼠的肾周脂肪系数极显著上升(P<0.01),表明高脂饮食易引起仓鼠肾周脂肪的积累;与模型对照组相比,匙羹藤酸剂量组仓鼠的肾周脂肪系数均极显著下降(P<0.01),且匙羹藤酸低、中、高剂量组下降率分别为23.08%、23.08%和28.72%,说明匙羹藤酸可以抑制高脂膳食仓鼠体内脂肪的积累。
2.3 匙羹藤酸对仓鼠血清中血脂水平的影响
2.3.1 匙羹藤酸对仓鼠血清中TG水平的影响 由图2可知,灌胃前,各组仓鼠之间的血清中的TG水平无显著性差异(P>0.05),从第4周开始,与正常对照组相比,模型对照组仓鼠血清中的TG水平极显著上升(P<0.01),表明高脂饲料喂养能够极显著性提高仓鼠血清中TG的水平(P<0.01);与模型对照组相比,匙羹藤酸各剂量组仓鼠血清中的TG极显著下降(P<0.01),下降率分别为39.67%、45.99%、53.15%,说明匙羹藤酸可以有效抑制高脂膳食仓鼠血清中TG水平升高。

图2 匙羹藤酸对仓鼠血清中TG水平的影响Fig.2 Effects of gymnemic acid on the levels of TG in serum of hamster
2.3.2 匙羹藤酸对仓鼠血清中TC水平的影响 如图3所示,灌胃前,各组仓鼠血清中TC水平无显著性差异(P>0.05);从第4周开始,与正常对照组相比,模型对照组仓鼠血清中的TC水平呈极显著上升(P<0.01);与模型对照组相比,匙羹藤酸各剂量组仓鼠血清中的TC开始下降,下降程度不同,第4周下降率分别为11.28%、23.44%、30.27%,说明匙羹藤酸可以抑制高脂膳食仓鼠血清中TC的升高。
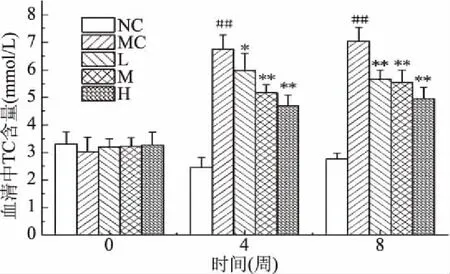
图3 匙羹藤酸对仓鼠血清中TC水平的影响Fig.3 Effects of gymnemic acid on the levels of TC in serum of hamster
2.3.3 匙羹藤酸对仓鼠血清中HDL-C水平的影响 如图4所示,灌胃前,各组仓鼠之间的血清中的HDL-C水平无显著性差异(P>0.05),从第4周开始,与正常对照组相比,模型对照组仓鼠血清中的HDL-C水平极显著性提高(P<0.01),这可能是由于高血脂仓鼠体内血脂水平过高而引起自身体内出现了一定程度上的调节作用。与模型对照组相比,匙羹藤酸各剂量组仓鼠血清中的HDL-C均无显著性差异(P>0.05),表明匙羹藤酸并不能提高仓鼠体内HDL-C水平。
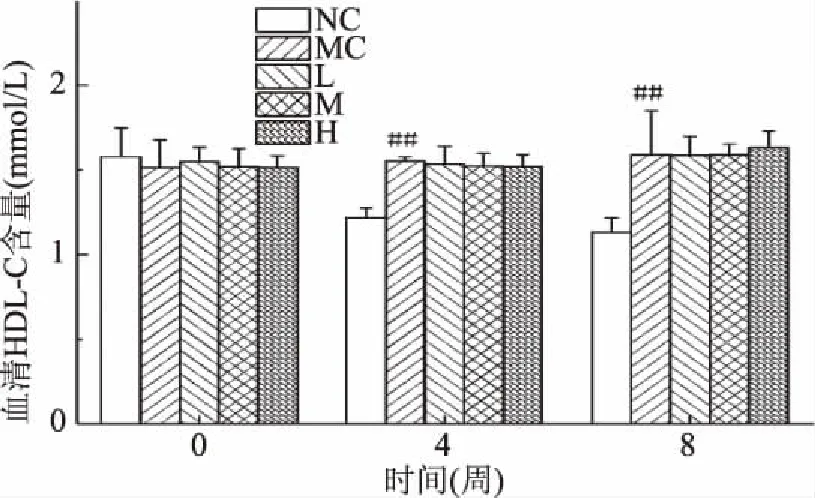
图4 匙羹藤酸对仓鼠血清中HDL-C水平的影响Fig.4 Effects of gymnemic acid on the levels of HDL-C in serum of hamster
2.3.4 匙羹藤酸对仓鼠血清中non-HDL-C水平的影响 由图5可知,灌胃前,各组仓鼠之间的血清中的non-HDL-C水平无显著性差异(P>0.05),从第4周开始,与正常对照组相比,模型对照组仓鼠血清中的non-HDL-C水平极显著性升高(P<0.01)。表明高脂饲料喂养能够明显提高仓鼠血清中non-HDL-C的水平;与模型对照组比,匙羹藤酸中、高剂量组仓鼠血清中的non-HDL-C水平极显著性下降(P<0.01)。表明匙羹藤酸可以抑制non-HDL-C水平的升高,对高脂血症有缓解作用。
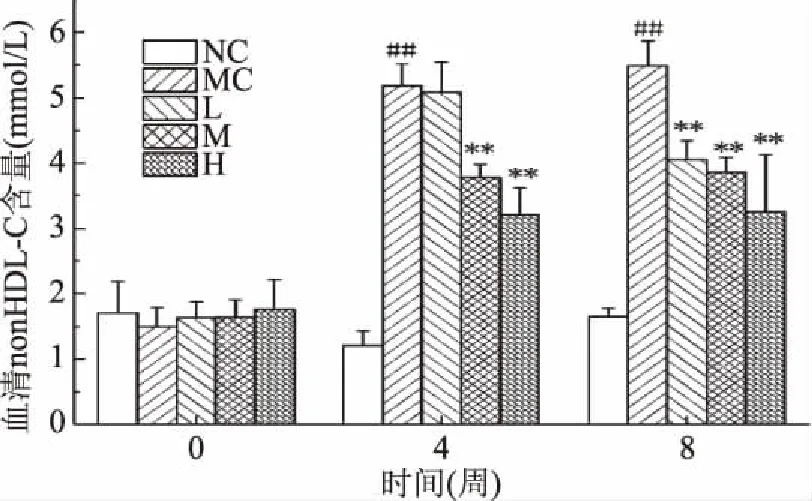
图5 匙羹藤酸对仓鼠血清中non-HDL-C Fig.5 Effects of gymnemic acid on the levels of non-HDL-C in serum of hamster
2.4 匙羹藤酸对仓鼠肝脏的保护作用
脂肪肝是最常见的肝功能异常的一种疾病,高血脂会导致肝脂肪性病变,检测血清中ALT、AST的含量是检验肝损伤程度的一种常用方法,并且在反映其损伤程度时AST 最为敏感[27]。
2.4.1 匙羹藤酸对仓鼠血清中ALT、AST的影响 由图6可知,与正常对照组相比,模型对照组仓鼠血清中ALT和AST活力均极显著性升高(P<0.01),说明高脂饮食会导致仓鼠肝脏细胞损伤;与模型对照组相比,匙羹藤酸剂量组仓鼠血清中ALT、AST活力极显著降低(P<0.01),说明匙羹藤酸可以减缓高脂膳食造成的仓鼠肝损伤。
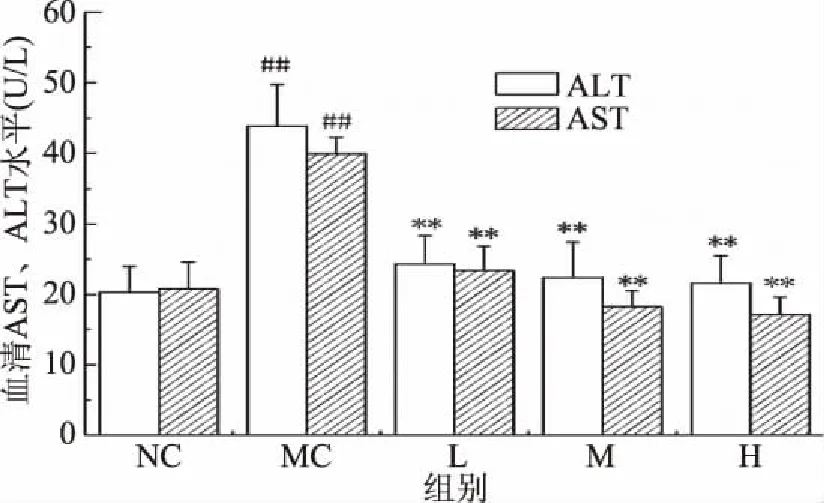
图6 匙羹藤酸对仓鼠血清中的ALT和 AST水平的影响Fig.6 Effect of gymnemic acid on serum ALT and AST levels in serum of hamster
2.4.2 肝组织形态学分析 如图7所示,正常对照组仓鼠的肝小叶结构完整,肝窦清晰可见,细胞排列紧密,整齐有序,边缘界限明显,核仁明显,细胞质均匀且丰富;模型对照组仓鼠肝细胞排列松散无序,细胞质中出现了大量的脂肪滴空泡,大小不一,将细胞核挤压至细胞边缘,肝细胞损伤严重,出现了严重的脂肪肝;与模型对照组相比,匙羹藤酸低、中、高剂量组的仓鼠肝脏中肝小叶结构相对完整,细胞排列相对紧密整齐,细胞质中的脂肪滴空泡明显减少,细胞质相对丰富,仓鼠的脂肪肝变性程度有所缓解,并且呈剂量依赖关系。这一结果与肝脏的脏器指数和血清中的ALT、AST水平的结果一致,表明匙羹藤酸可以在一定程度上减缓肝脏细胞脂肪变性,具有预防脂肪肝形成作用。
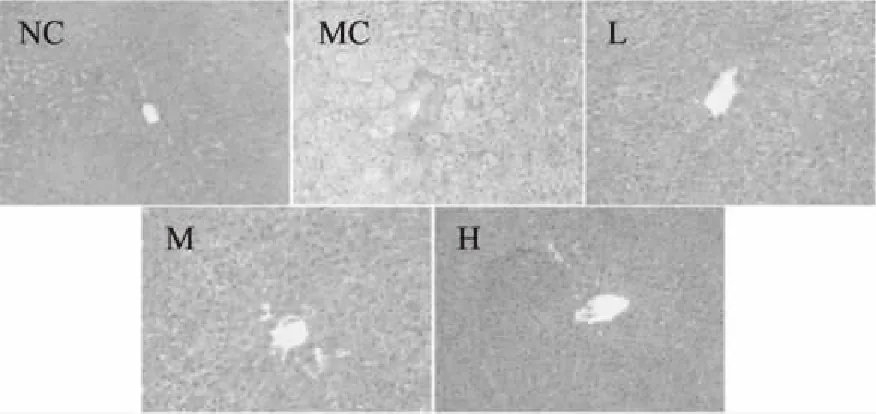
图7 匙羹藤酸对仓鼠肝脏组织切片的影响(100×)Fig.7 Effects of gymnemic acid on liver slices in hamsters(100×)
2.5 匙羹藤酸对仓鼠血清中胆固醇调控关键酶活的影响
肝脏是调节体内胆固醇代谢的重要器官。胆固醇在肝脏中的三条主要的代谢途径为内源性胆固醇合成、胆固醇向胆汁酸的转化以及LDL-R对LDL的接受途径[28]。因此机体可以通过调节与胆固醇代谢相关酶3-羧基-3甲基-戊二酰CoA还原酶(HMGCR)、胆固醇-7α-羟化酶(CYP7A1)、胆固醇酰基转移酶(ACAT)等的水平来调节胆固醇在体内的代谢。
2.5.1 匙羹藤酸对仓鼠血清中HMGCR酶活的影响 HMGCR是机体中胆固醇合成的主要限速酶[27]。由图8可知,与正常对照组相比,模型对照组仓鼠血清中HMGCR水平显著升高(P<0.05),表明高脂饮食会促进机体内HMGCR活力的升高,促进胆固醇的合成。与模型对照组相比,中、高剂量组仓鼠血清中HMGCR水平极显著下降(P<0.01),说明匙羹藤酸可以降低HMGCR水平,通过抑制HMGCR的合成来降低胆固醇的合成。
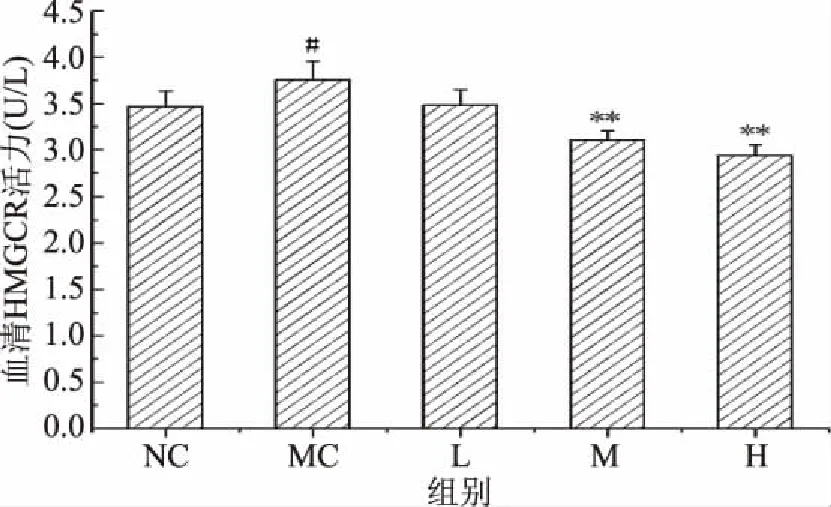
图8 匙羹藤酸对仓鼠血清中的HMGCR活力的影响Fig.8 Effect of gymnemic acid on serum HMGCR activity on serum of hamster
2.5.2 匙羹藤酸对仓鼠血清中CYP7A1酶活的影响 胆固醇7-羟化酶(CYP7A1)是胆汁酸合成代谢经典途径中肝脏合成并促使胆固醇转化成胆汁限速酶,是机体把胆固醇排除体外的重要途径,对机体维持胆固醇代谢平衡起着重要的作用[27]。由图9可知,与正常对照组相比,模型对照组仓鼠血清中的CYP7A1水平极显著下降(P<0.01),与模型对照组相比,中、高剂量组仓鼠血清中的CYP7A1水平极显著升高(P<0.01)。说明匙羹藤酸可以提高仓鼠血清中CYP7A1水平,增加胆汁的合成,从而将胆固醇的排出体外,降低血液中胆固醇。
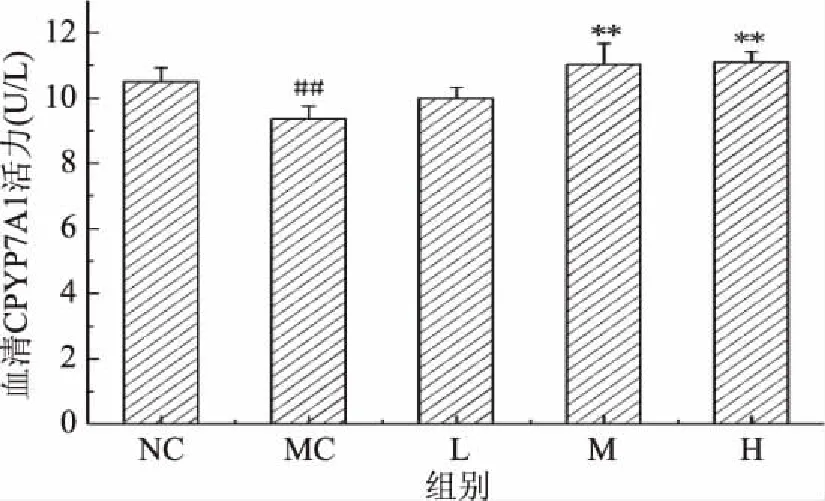
图9 匙羹藤酸对仓鼠血清中的CYP7A1活力的影响Fig.9 Effect of gymnemic acid on serum CYP7A1 activity in serum of hamster
2.5.3 匙羹藤酸对仓鼠血清中ACAT酶活的影响 ACAT是细胞内唯一催化游离胆固醇和长链脂肪酸合成胆固醇酯的酶,抑制体内的ACAT活性可减少食物中的胆固醇及随胆汁排泄的胆固醇在小肠的吸收,减少肝脏中胆固醇酯的生成及极低密度脂蛋白(Very Low Density Lipoprotein,VLDL)的分泌。由图10可知,正常对照组、模型对照组及匙羹藤酸各剂量组的仓鼠血清中ACAT水平没有显著性差异(P>0.05)。因此匙羹藤酸和高脂膳食对ACAT的活力没有影响。
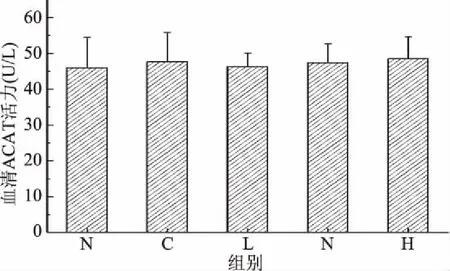
图10 匙羹藤酸对仓鼠血清中的ACAT活力的影响Fig.10 Effect of gymnemic acid on serum ACAT activity in serum of hamster
2.6 匙羹藤酸对仓鼠肝脏中HMGCR酶活的影响
HMGCR主要存在于肝脏中。由图11可知,与正常对照组相比,模型对照组仓鼠血清中HMGCR水平极显著升高(P<0.01),表明高脂饮食会促进肝脏内HMGCR活力的升高,促进胆固醇的合成。与模型对照组相比,匙羹藤酸中、高剂量组仓鼠血清中HMGCR水平极显著下降(P<0.01),低剂量组HMGCR水平显著下降(P<0.05),说明匙羹藤酸可以降低HMGCR水平,通过抑制HMGCR的合成来降低胆固醇的合成,这一结果与血清中的一致。

图11 匙羹藤酸对仓鼠肝脏中的HMGCR活力的影响Fig.11 Effect of gymnemic acid on serum HMGCR activity in liver of hamster
3 结论
本实验结果表明低、中、高剂量的匙羹藤酸均能不同程度地抑制高脂饮食仓鼠的血脂水平,减少肾周脂肪的积累,抑制肝脏发生脂肪性病变。匙羹藤酸可以抑制HMGCR、提高CYP7A1的水平,对ACAT没有影响,表明匙羹藤酸可以通过抑制HMGCR的水平来抑制体内胆固醇的合成,通过提高CYP7A1的水平来促进胆固醇向胆汁酸的转化,从而促进胆固醇的排泄,来控制机体内血脂水平的升高。本文研究结果为匙羹藤酸降血脂提供了科学依据,将来可以通过Western Blot和qPCR的方法对胆固醇调节相关酶的基因和蛋白表达水平进行研究。

