手性介孔二氧化硅载体对地西泮溶出行为的改善
王健鑫,柯 佳,王玉美,吴学倩,李鹤然,徐 璐
0 引言

随着药学和材料学的发展,以介孔二氧化硅纳米粒为药物载体的给药系统已有大量文献报道[4-6]。基于载体和药物的结构,药学研究者们已经利用介孔硅材料成功合成出了多种类型的药物释放系统,包括:药物缓释释放系统、药物速释释放系统、药物控释释放系统、刺激响应型药物释放系统等,成功地解决了阿司匹林、吲哚美辛、布洛芬、硝苯地平等难溶性药物的低溶解度问题[6-10]。
本文采用共缩聚发制备了接枝L-酒石酸的手性介孔二氧化硅,以手性介孔二氧化硅为药物载体,将疏水性药物地西泮载入载体孔道构建药物释放系统,以改善其体外释放行为,并详细考察了不同载药比例的载体对地西泮体外释放的调控能力。
1 仪器与试药
DF-101S恒温磁力搅拌器(河南予华仪器有限责任公司),CAP225D天平(德国Sartorius公司),V-Sorb 2800P型孔径及比表面积测试仪(北京金爱普有限公司),ZRD6-B型药物溶出仪(上海黄海药检仪器厂),UV-1750型紫外分光光度计ultraviolet spectroscopy(日本Shimadzu公司)。
十六烷基三甲基溴化铵(CTAB,天津博迪化工股份有限公司),L-酒石酸(天津博迪化工股份有限公司),正硅酸乙酯(TEOS,天津博迪化工股份有限公司),地西泮(郑州贺天生物科技有限公司,中国),丙酮(山东禹王实业有限公司化工分公司,中国),去离子水(自制)。
2 方法
2.1 介孔二氧化硅的制备 本文中介孔二氧化硅的制备参照文献[10-11]。首先用3-氨丙基三乙氧基硅烷(APTES)和L-酒石酸制备偶联剂TA-APTES,再以TA-APTES通过共缩聚法制备手性介孔二氧化硅(CMSN)。制备工艺:称取0.3 g/L酒石酸于反应瓶中,加入20 ml乙醇溶解。搅拌下加入0.5 ml APTES,得到白色沉淀,沉淀经过滤,洗涤,离心,干燥,即得TA-APTES。另取0.8 g CTAB于反应瓶中,加入100 ml水和30 ml乙醇,温和搅拌至溶解。随后依次加入0.8 ml 氨水、0.5 g TA-APTES 和 5 ml TEOS,剧烈搅拌4 h。室温下静置24 h,离心分离产物,乙醇、水交替洗涤,60 ℃烘箱中过夜干燥。用0.01 mol/L HCl的甲醇溶液回流干燥产物24 h以除去CTAB模板,即得CMSN。
2.2 DZP-CMSN载药样品的制备 利用溶剂挥干法制备载药样品,将20 mg地西泮(DZP)原料药粉末在超声下溶解于2 ml丙酮中制备DZP丙酮溶液。分别称量20 mg和60 mg CMSN与DZP丙酮溶液混合后制备药物/载体比为1∶1和1∶3(w/w)的混合液。常温下搅拌48 h后,置于真空干燥器中挥干溶剂。将载药粗品小心移出,采用2 ml甲醇小心润洗载药粗品以除去吸附在载体表面上的药物,真空干燥去除润湿液,载药样品分别命名为DZP-1CMSN和DZP-3CMSN。
2.3 载药体系性质表征 利用红外光谱对载药体系的性质进行表征:将空白载体、载药样品和空白药物与KBr共研磨后压片,在400~4 000 cm-1波长范围扫描红外图谱,分析样品的结构。
为研究DZP载入载体前后的药物存在状态的变化,将待测样品(DZP、CMSN、DZP-3CMSN)进行X射线衍射(XRD)和差示扫描量热(DSC)表征,XRD测试条件:以Ka为辐射源,Cu靶,管电压和管电流分别为40 kV和 30 mA,扫描量程5~45°(2θ),扫描速度为2°/min,步长为0.01°。DSC测试条件:样品重量5 mg,起始温度25 ℃,终止温度200 ℃,升温速度3 ℃/min。
2.4 载药量测定 精密称量适量DZP-CMSN载药样品于容量瓶中,加入乙醇超声溶解并定容至刻度线。完全提取后,滤膜过滤,利用紫外-可见分光光度计在239 nm波长下进行吸光度考察,利用标准曲线计算载药量。
2.5 载药体系的体外释放考察 体外释放考察按照2010年版《中国药典》二部体外溶出测试(附录XC小杯法)方法进行。释放介质为250 ml去离子水,温度设定至37 ℃,转速设定为50 r/min。精密称量4 mg DZP原料药,并按载药量测试结果计算装载4 mg DZP的载药体系总重量后,称量适量DZP-CMSN。将测试样品投入释放介质中,于预设时间点抽取4 ml溶出液,并补加4 ml空白介质。滤膜过滤后,将稀释至适当倍数的样品利用紫外-可见分光光度法在239 nm下测定溶液吸光度,计算样品释放度,绘制释放曲线。
3 结果与讨论
3.1 DZP-CMSN载药体系的性质 本文采用共缩聚法制备了酒石酸接枝的手性介孔二氧化硅。利用红外光谱表征载药体系的性质(图1),测试结果说明CMSN具有SiO2特征结构,在3 427 cm-1处左右可观察到Si-OH中羟基基团的伸缩振动峰,在1 698.4 cm-1处可观察到羧基中羰基基团的伸缩振动峰,提示载体成功合成[11]。而DZP具有典型的药物红外光谱,其芳环特征吸收峰出现在3 054.27、1 339.56、1 322.76 cm-1处,可观测到苯环C-H面内弯曲振动,而C=O的吸收峰呈现在1 684.71 cm-1处。DZP载入CMSN后,未能观测到DZP的药物特征吸收峰,证实药物成功装载进入载体孔道内部,载药样品成功制备。
利用XRD和DSC表征药物装载入载体前后的存在状态。XRD测试结果见图2。测试结果显示DZP原料药的XRD图谱中具有高度结晶的药物衍射峰,说明药物中具有大量晶体结构。CMSN的XRD图谱中显示典型的馒头峰,未观察到结晶峰,说明载体以无定形形式存在。DZP载入CMSN后,载药体系的XRD图谱中未能观测到DZP的药物特征峰,提示DZP成功载入载体孔道内部,并由于CMSN的介观孔道有效抑制了药物的结晶,致使药物以无定形形式存在[9]。
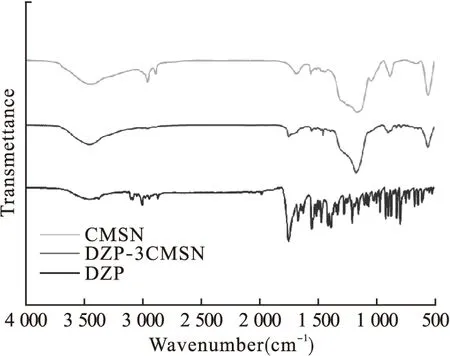
图1 CMSN、DZP-3CMSN、DZP的红外图谱

图2 CMSN、DZP-3CMSN、DZP的X射线衍射图谱
DSC测试结果(图3)与XRD高度一致,显示DZP原料药的DSC图谱中在135.1 ℃处观察到药物熔点的吸热峰,提示此时药物以结晶形式,药物中具有大量晶体结构。CMSN的DSC曲线上未出现吸热峰,说明载体内部无晶体结构,载体以无定形形式存在。同时,DZP-3CMSN的DSC图谱也没有出现吸热峰,说明DZP载入CMSN后,药物发生晶型变化,此时药物以无定形存在。

图3 CMSN、DZP-3CMSN、DZP的DSC热图谱
3.2 DZP-CMSN载药体系的载药量 由表1可知,CMSN对于DZP具有极强的结合能力,药品几乎全部载入孔道内部。载药比例为1∶1和1∶3时,载药量分别为50.26%和22.46%,载体的载药量均随载体比例的增加而降低。

表1 DZP-CMSN载药样品的载药量测定
3.3 DZP-MSN和DZP-CMSN载药体系的体外释放考察 DZP、DZP-1CMSN、DZP-3CMSN在水中的释放曲线见图4。由图可知,DZP原料药粉末经30 min仅溶出2.85%,24 h的溶出度为60.68%。载入CMSN后,药物溶出的速度和程度较原料药均显著提升,DZP-1CMSN和DZP-3CMSN在30 min的溶出率分别为13.39%和15.14%,而所有载药样品在24 h内的溶出量均达到80%以上,30 min内释放量提升了4.6~5.3倍,24 h内释放量分别提升了1.39、1.42倍。

图4 DZP、DZP-1CMSN、DZP-3CMSN在水中的体外释放考察
此外,DZP、DZP-1CMSN、DZP-3CMSN在pH 6.8 PBS和pH 1盐酸中的释放曲线分别见图5和图6。由图可知,DZP在pH 1盐酸中的释放速度最快,在水中的释放速度最慢。在2种释放介质中,载入CMSN后,药物溶出的速度和程度较原料药均显著提升。在pH 6.8 PBS中,DZP-1CMSN和DZP-3CMSN在30 min的溶出率分别为原料药的5.4、6.4倍,24 h内释放量提升了1.73、1.78倍。在pH 1盐酸中,3种DZP制剂均显示较快的释放速度,2 min 内药物即可从CMSN中分别释放79.6%和88.0%,此时原料药仅释放25.2%。而在15 min内3种制剂均可释放75%以上。
由于CMSN孔道直径的限制有效抑制了药物的结晶,致使药物以无定形形式存在,无定形没有形成晶格,药物溶解度较晶体显著提高,将进一步提高药物的生物利用度,有利于其临床应用。
在3种释放介质中,药物从载体中的释放速度随着载体比例的增加而变快。载药比例不同时,两种载体的样品药物/载体比1∶3比例下的释放速度较1∶1比例下的释放更快,随着载体比例的增加,药物具有更多可以选择的装载位点,无定形化更充分,促进了药物从载体中的释放。
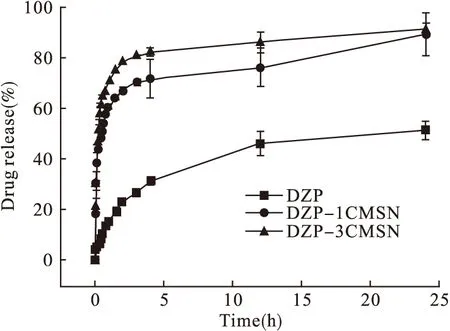
图5 DZP、DZP-1CMSN、DZP-3CMSN在pH 6.8 PBS中的体外释放考察
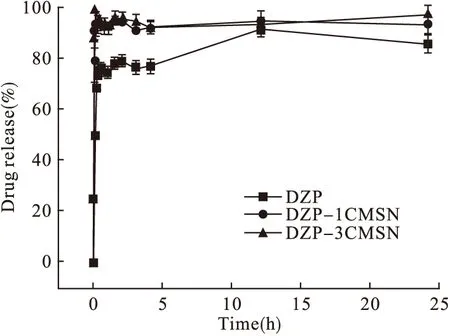
图6 DZP、DZP-1CMSN和DZP-3CMSN在pH 1 盐酸中的体外释放考察
4 结论
在临床广泛使用的药物中,大量药物因溶解限制无法选择生物利用度较高的静注途径给药,部分药物口服给药后因其低水溶性导致释药不完全、体内吸收差、血药浓度不稳定、个体差异明显等问题。低溶解度更给药物的贮藏和成药带来大量问题,功能性纳米载体的开发和应用为应对药物的低溶解度开辟了新策略。近年来,介孔材料成为一种较为理想的化学和生物学稳定的药物载体,为解决药物的溶解度问题带来了转机。
本文采用共缩聚法成功制备了接枝L-酒石酸的手性介孔硅CMSN,利用挥干溶剂法将疏水性药物DZP装载入CMSN孔道内部。CMSN与药物具有极强的装载结合能力,载药后,载体内部的介观孔道均促使药物晶体发生无定形化转变,在3种释放介质中,药物体外释放的速度和程度较原料药均得到显著提升,且药物从载体中的释放速度随着载体比例的增加而变快。在水中,30 min内释放量提升了4.6~5.3倍,24 h内释放量提升了1.39、1.42倍,而在pH 6.8 PBS中,DZP-1CMSN和DZP-3CMSN在30 min的溶出率分别为原料药的5.4、6.4倍,24 h内释放量提升了1.73、1.78倍。介孔硅药物载体具有明确的载释药优势,提升地西泮的体外溶出效率,可提高药物的生物利用度,有利于其临床应用。

