姜黄素对小鼠胆汁淤积性肝纤维化的改善作用及其机制研究*
吴 晨, 邱玉保, 孙雪倩, 陈 丹, 吴亚先, 庞庆丰
(江南大学无锡医学院, 江苏 无锡 214122)
许多肝脏疾病,如胆结石,阻塞性黄疸,急性肝炎,原发性硬化性胆管炎和原发性胆汁性肝硬化等都会常导致肝脏胆汁淤积[1]。 胆汁从肝细胞到肠道的阻塞导致肝脏组织中的胆汁酸积累,导致氧化应激,炎症,细胞凋亡和纤维化,最终发展为肝硬化。然而,熊去氧胆酸(UDCA)与巴替酸(OCA)联合用药是迄今为止唯一批准的临床慢性胆汁淤积性肝病治疗方法[2]。但OCA的价格昂贵,费用-疗效比不尽乐观,因此,尽快开发出大部分患者都可以承担的胆汁淤积治疗药物极为重要。姜黄素是一种天然黄色多酚,价格适中,因其抗氧化,抗炎,抗突变和抗致癌性质而被认为是一种药用植物[3],一些研究报道姜黄素可以上调血红素加氧酶-1(heme oxygenase-1, HO-1)并抑制各种肝脏疾病,如急性肝损伤[4],酒精性肝病[5]和肝纤维化[6],但尚不清楚姜黄素是否对胆汁淤积性肝损伤有保护作用。本研究通过模拟小鼠胆汁淤积性肝纤维化模型,探讨姜黄素对小鼠胆管结扎所致的胆汁淤积性肝纤维化是否具有保护作用及其作用机制,为肝纤维化治疗提供新的治疗方法。
1 材料与方法
1.1 试剂及抗体
姜黄素(Cat#C1386),锌原卟啉IX(ZnPP,Cat#282820),P450还原酶(Cat#C8113),β-NADPH(Cat#N5130)均购自美国Sigma-Aldrich公司。 天冬氨酸氨基转移酶(aspartate aminotransferase, AST)和丙氨酸氨基转移酶(alanine aminotransferase, ALT)检测试剂盒购自中国南京建成生物工程研究所。HO-1(Cat#ab13248),髓过氧化物酶(myeloperoxidase, MPO)(Cat#ab9535)的一抗购自美国Abcam公司。小鼠含生长因子样模体粘液样激素样受体(EMR1, 又称F4 / 80)(Cat#MCA497GA)购自美国BIO-RAD公司。
1.2 实验动物分组及模型建立
所有动物实验均按照相关法律和机构指南进行,并经江南大学实验动物使用伦理委员会批准。BALB/c小鼠(6~8周,体重20~25 g)随机分为5组:假手术组(n=6),假手术组+姜黄素组(n=6),BDL(n=10),BDL +姜黄素(n=10)和BDL +姜黄素+ ZnPP(n=10)。使所有动物适应适当的环境7 d。BDL组、BDL+姜黄素组以及BDL+姜黄素+ZnPP组小鼠如文献所述进行了BDL手术[7]:对小鼠进行开腹后,轻轻剥开肝脏,找到与肝门静脉伴行的一条透明胆管,用4-0手术线进行两次结扎,将肝脏复位后,缝合小鼠。假手术组的小鼠如造模组一样接受剖腹手术并分离了胆管但不进行结扎。BDL手术7 d后,假手术+姜黄素组以及BDL+姜黄素组小鼠每日进行一次姜黄素(30 mg/kg)[8-9]腹腔注射;BDL+姜黄素+ZnPP组小鼠每日腹腔注射姜黄素(30 mg/kg)以及ZnPP(50 μmol/kg)[10]一次,;假手术组和BDL组,小鼠每日腹腔注射等体积的生理盐水一次,所有给药过程持续7 d。BDL手术14 d后,各组小鼠摘眼球取血,收集肝脏组织,取部分肝组织用4%多聚甲醛固定,进行组织学检查。另一部分立即储存在-80℃,用于qRT-PCR、WB、HO-1活性检测。
1.3 血清生化分析
BDL手术14 d后,各组小鼠摘眼球取血,在4℃冰箱中静置过夜后,得到血清。
1.3.1 血清谷草转氨酶 (aspartate aminotransferase, AST) 检测 采用南京建成生物研究所购买的AST试剂盒进行检测,简要操作步骤如下:在测定孔与对照孔中加入20 μl由-酮戊二酸及天门冬氨酸组成的基质液及5 μl待测血清样本,吹打混匀后,37℃水浴30 min。在测定孔与对照孔中加入20 μl 2,4二硝基苯肼液,在对照孔中加入5 μl待测血清样本,吹打混匀,37℃水浴30 min。从孵箱中拿出孔板,在测定孔和对照孔中加入200 μl 0.4 mol/L氢氧化钠溶液,混匀后室温放置15 min,酶标仪510 nm处测各孔OD值。绝对PD值=测定孔OD值-对照孔OD值, 查提前做好的标准曲线得各组相应AST活力单位。
1.3.2 血清谷丙转氨酶 (alanine aminotransferase, ALT) 检测 采用南京建成生物研究所购买的AST试剂盒进行检测,简要操作步骤如下:在测定孔与对照孔中加入20 μl由-酮戊二酸及丙氨酸组成的基质液及5 μl待测血清样本,吹打混匀后,37℃水浴30 min。在测定孔与对照孔中加入20 μl 2,4二硝基苯肼液,在对照孔中加入5 μl待测血清样本,吹打混匀,37℃水浴30 min。从孵箱中拿出孔板,在测定孔和对照孔中加入200 μl 0.4 mol/L氢氧化钠溶液,混匀后室温放置15 min,酶标仪510 nm处测各孔OD值。绝对PD值=测定孔OD值-对照孔OD值, 查提前做好的标准曲线得各组相应AST活力单位。
1.4 肝脏组织形态学观察肝纤维化
将剪成合适大小的肝组织在4%多聚甲醛中固定48 h,石蜡包埋后切成4 μm切片。根据标准程序进行HE染色和天狼星红染色。
1.5 免疫组化检测肝组织F4 / 80及MPO
取小鼠肝脏组织进行4%多聚甲醛固定,进行常规梯度酒精脱水及二甲苯透明处理后,石蜡包埋并用组织切片机进行组织切片。将肝组织切片与HO-1(1∶200稀释),F4 / 80(1∶100稀释),MPO(1∶50稀释)一抗和生物素化二抗(1∶200稀释)孵育适当时间,DAB显色,在德国卡尔蔡司LAM 510光学显微镜下观察所有切片,使用Image J软件对免疫组化染色阳性细胞进行统计。
1.6 Western blot检测肝组织HO-1蛋白表达
参照文献[11],称取各组样品30 mg,在含有蛋白酶抑制剂的RIPA裂解液中,在冰上匀浆30 min,12 000 r/min、4℃离心10 min,然后收集上清液,BCA法定量。取20 μg蛋白样品依次经过SDS-PAGE凝胶电泳分离、转膜、5%脱脂牛奶封闭、HO-1一抗(1∶1 000)4℃孵育过夜、二抗室温孵育1 h、ECL显色。GAPDH(1∶10 000)作为内参。
1.7 肝组织HO-1活性检测
参照文献[12],简要步骤如下:称取小鼠肝脏组织约30 mg,加入预冷的400 μl含有PMSF的RIPA裂解液,将EP管插放在冰上进行手动匀浆,匀浆完成后以200 s一次的频率于涡旋仪上涡旋10 s,20 min后,在提前4℃预冷好的离心机中,12 000 r/min离心10 min,收集含有蛋白的上清,并用BCA法测量蛋白浓度。HO-1活性检测的反应体系为200 μl:25 μmol/L hemin、1 mmol/L NADPH、5 mmol/L去铁胺、0.6 U细胞色素C、80 μl小鼠肝胆绿素还原酶提取液、200 μg细胞全蛋白、剩余用PBS补足。

1.8 RT-PCRt检测小鼠肝组织中HO-1 mRNA表达水平
取15 mg各组小鼠肝脏组织,使用RNA prep Pure Tissue Kit制备总RNA。通过260和280 nm处的吸光度比评估样品的RNA产率和纯度。使用PrimeScript TM RT Master Mix试剂盒将总RNA逆转录成cDNA。 根据系统方案SYBR Premix Ex Taq(Takara,Japan)进行qPCR。 本研究中的所有引物均由Sangon Biotech (中国上海)合成。定量使用GAPDH作为参照基因的2-ΔΔCt方法。
1.9 统计学处理
2 结果
2.1 姜黄素对BDL诱导的小鼠肝组织形态学的影响
假手术的小鼠肝脏在14 d时表面光滑,而BDL小鼠显示出结构改变,肝脏表面出现水肿和纤维化结节(图1A)。在组织学检测中也证实由BDL手术诱导的肝脏特征性形态学改变,如胆管增生,炎性细胞浸润,肝小叶被分割、肝细胞肿胀形成不规则形状且细胞核被挤压至边缘(图1C)。与假手术组小鼠相比,BDL处理的小鼠肝细胞损伤标记物ALT(P<0.01)和AST(P<0.01)显著升高(图1B);另外,BDL小鼠的肝脏重量与体重比与假手术组小鼠相比也出现升高(图1A)。 补充姜黄素后,这些情况均得到改善,表明姜黄素减弱了BDL诱导的肝损伤。
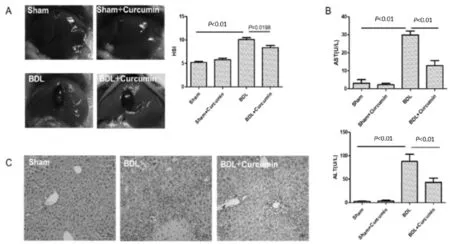
Fig.1Curcumin attenuated BDL-induced liver injury
(A) BALB/c mice were randomly divided into sham group (n=6), sham+ curcumin group (n=6),BDL group (n=10) and BDL+ curcumin group (n=10). After two weeks the visceral cavity was opened and the liver to body weight ratio was measured. (B) Serum levels of AST and ALT in sham (n=6), sham+ curcumin (n=6),BDL (n=10), BDL+ curcumin group (n=10).(C) The obtained liver sections were subjected to histological examination. Representative photomicrographs of H&E were shown. Original magnification: ×200.Values represent mean±SD.
2.2 姜黄素对BDL诱导的肝纤维化和炎症的影响
天狼星红染色结果(图2A)显示,姜黄素+BDL组与BDL组相比,肝组织中胶原蛋白沉积减少,促肝纤维化标志物的mRNA含量也明显下降(图2B,2C),表明连续7 d以30 mg/kg剂量用姜黄素治疗减少BDL导致的肝纤维化。同时,免疫组化染色结果(图2D,2E)显示,与BDL组相比,补充姜黄素可显著减少巨噬细胞标记物F4/80以及中性粒细胞标记物MPO的表达,减轻BDL诱导的炎症细胞浸润。这些结果表明,姜黄素对BDL诱导的肝纤维化和炎症具有减弱作用。
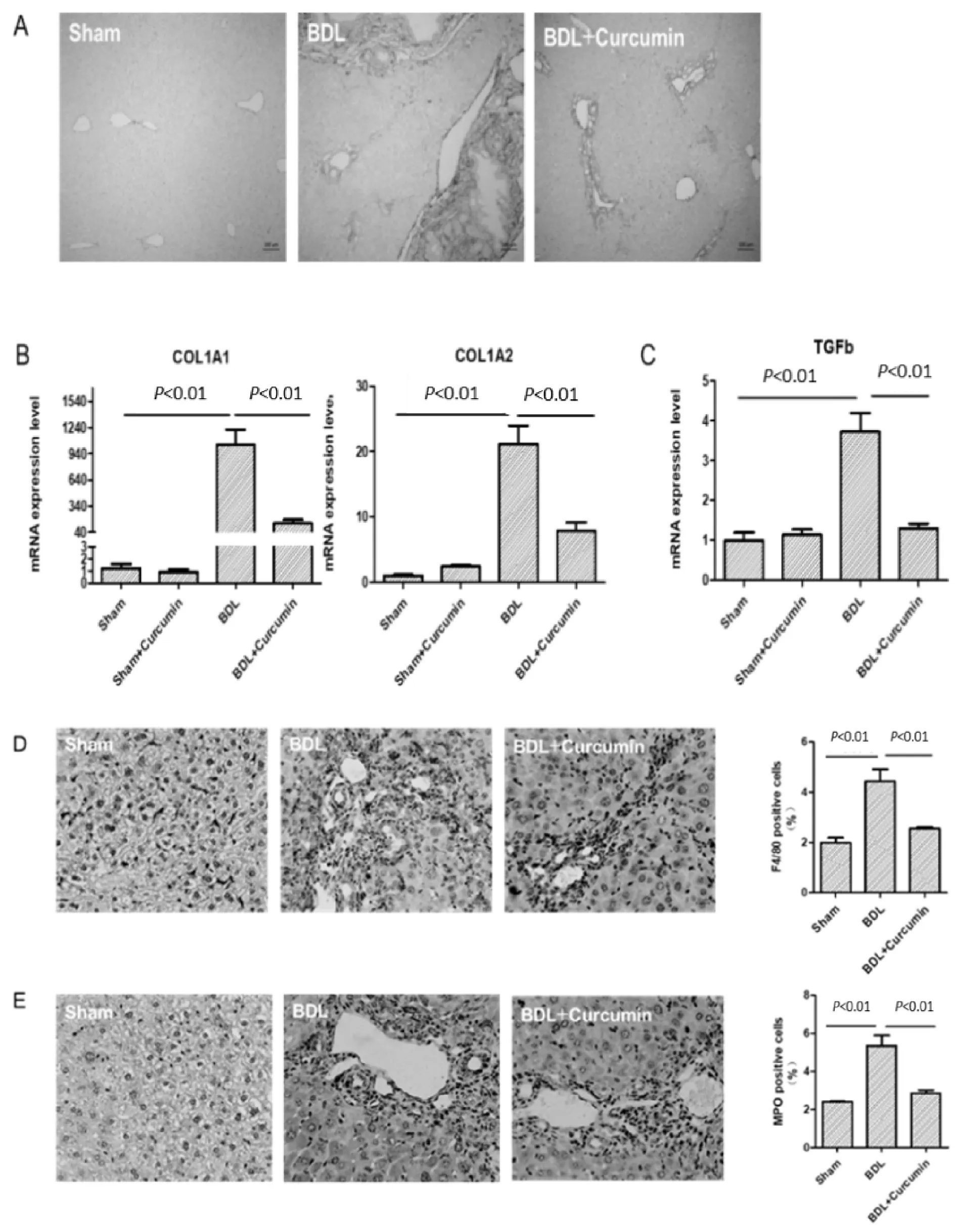
Fig.2Curcumin attenuated BDL-induced liver fibrosis and inflammation
(A) The obtained liver sections were subjected to histological examination. Representative photomicrographs of Sirius red staining were shown. Original magnification: ×100.mRNA expression levels of collagen type I (B) and TGF-β1 (C) in sham (n=6), sham+ curcumin (n=6),BDL (n=10), BDL+ curcumin (n=10) group. Values represent mean±SD. The obtained liver sections were subjected to immunohistochemical examination with antibody against F4/80 (D) and MPO (E), Representative photomicrographs are shown (left panel), original magnification: ×400.Percentage of F4/80-positive cells and MPO-positive cells (right panel) of each group was quantitative analysed.
2.3 姜黄素对肝组织中HO-1表达水平的影响
与假手术组相比,BDL造模14 d后,小鼠肝组织中的HO-1蛋白表达量(图3A,3C)及mRNA含量(图3B)均有所上升(P<0.01),在补充姜黄素后,小鼠肝脏HO-1表达量进一步显著上升。根据以上实验结果,我们猜测,姜黄素对小鼠BDL所致的肝纤维化的保护作用可能是通过诱导HO-1表达实现的。
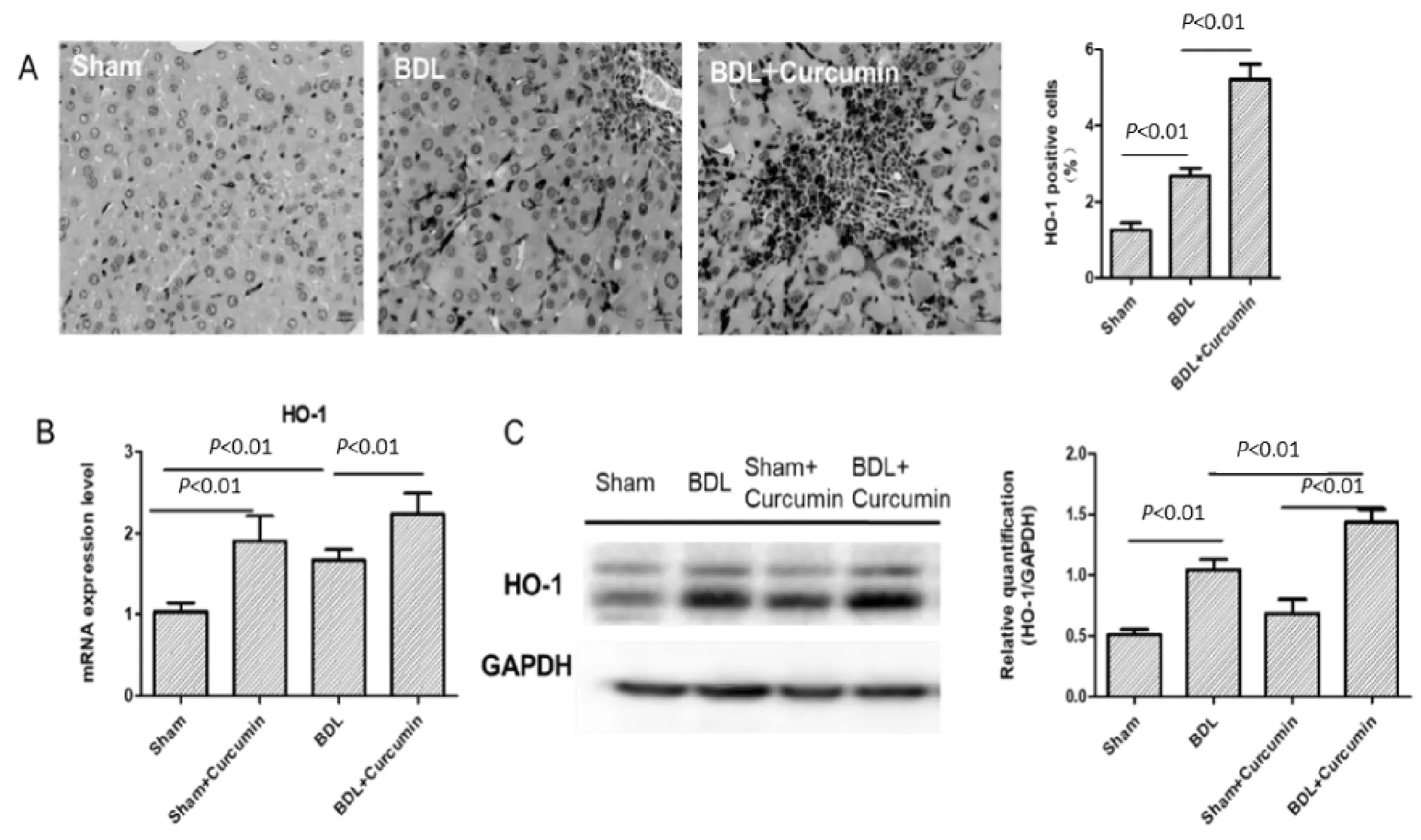
Fig.3Curcumin enhanced mRNA and proteins expression levels of HO-1
(A) The obtained liver sections were subjected toimmunohistochemical examination with antibody against HO-1. Representative photomicrographs are shown (left panel), original magnification: ×400.Percentage of ho-1-positive cells (right panel) of each group was quantitative analysed. (B) mRNA expression levels of HO-1 in sham (n=6), sham+ curcumin (n=6),BDL (n=10), BDL+ curcumin (n=10) group. (C) Proteins were isolated from liver tissues and subjected to Western bolt with antibody against HO-1. Representative bolts (left panel) and quantitative analysis (right panel) were shown. Values represent mean±SD.
2.4 HO-1抑制剂ZnPP加重BDL诱导的肝损伤
为了进一步验证我们的假设,我们在补充姜黄素的同时连续7 d对姜黄素给药小鼠进行50 μmol/ kg的锌原卟啉(ZnPP)腹腔注射。ZnPP是血红素降解途径中的限速酶,具有特异性抑制HO-1酶活性的能力(图4A),而对HO-1的mRNA水平(图4B)或蛋白质表达(图4C)没有影响。在ZnPP处理后的BDL小鼠中,仍然发现了实质坏死,以及大量新形成的胆管(图4D)和I型胶原沉积(图4E),提示姜黄素对BDL小鼠的保护作用被逆转。I型胶原蛋白的mRNA水平升高(图4F),提示ZnPP消除了姜黄素对BDL小鼠肝纤维化的保护作用。因此我们得出结论,姜黄素对小鼠BDL所致的肝纤维化的保护作用是通过诱导HO-1表达实现的。
3 讨论
胆汁淤积性肝损伤是慢性肝病患者肝纤维化和肝硬化发展的主要致病因素之一,同时临床上的治疗药物十分有限。为了评估姜黄素对胆汁淤积性肝损伤的影响,我们使用BDL作为实验模型,发现补充姜黄素可以改善BDL诱导的肝纤维化和炎症等肝损伤,其机制可能与HO-1调控有关。
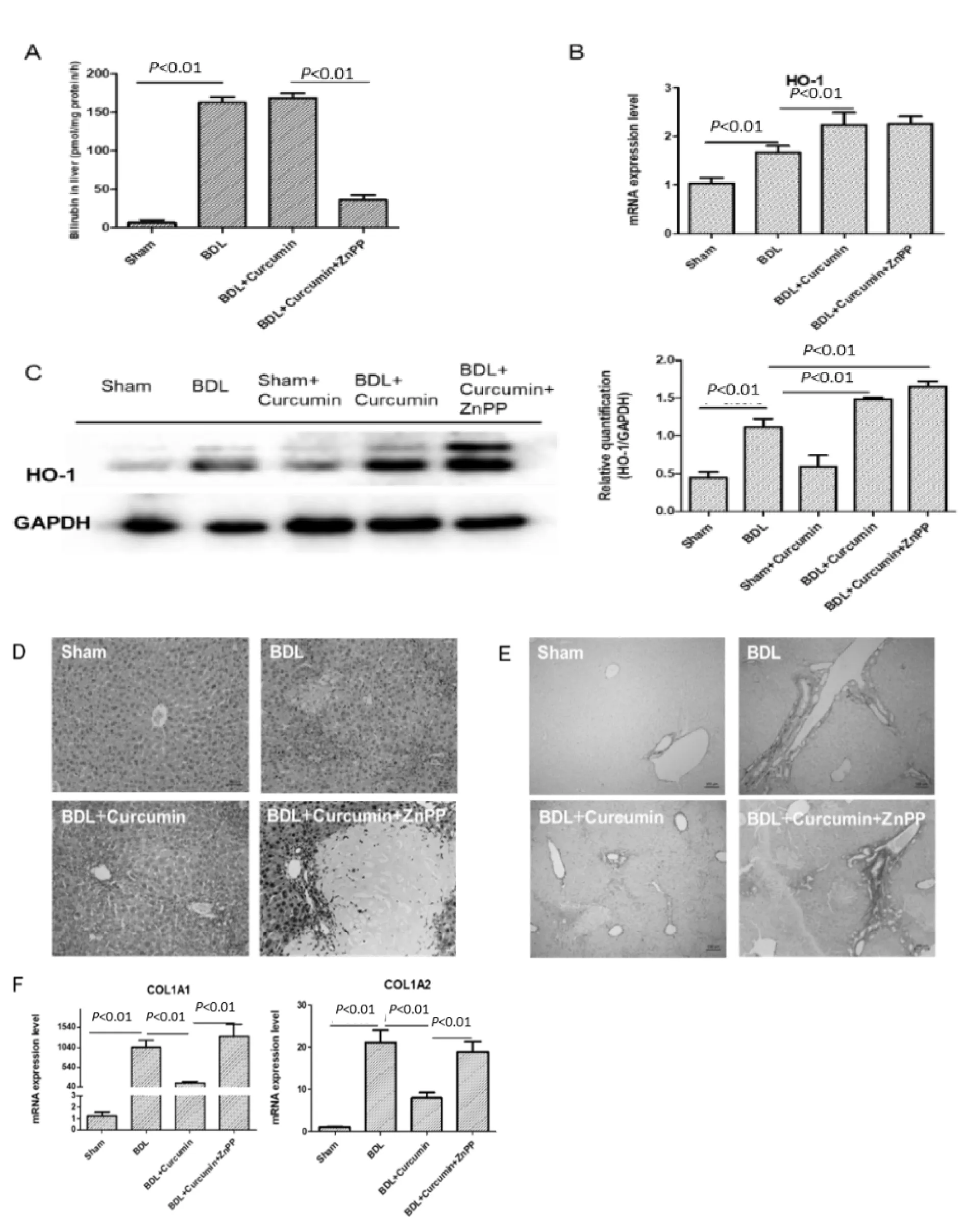
Fig.4HO-1 inhibitor, ZnPP, aggravated BDL-induced liver damage
(A) HO-1 activity was determined in liver. (B)mRNA expression levels of HO-1 in sham (n=6), BDL (n=6), BDL+curcumin (n=10), BDL+curcumin+ZnPP (n=10) group. (C) Proteins were isolated from liver tissues and subjected to Western bolt with antibody against HO-1. Representative bolts (left panel) and quantitative analysis (right panel) were shown. (D) The obtained liver sections were subjected to histological examination. Representative photomicrographs of H&E were shown. Original magnification: ×200.(E) The obtained liver sections were subjected to histological examination. Representative photomicrographs of Sirius red staining were shown. Original magnification: ×100.(F) mRNA expression levels of collagen type I in sham (n=6), BDL (n=6), BDL+ curcumin (n=10), BDL+curcumin+ZnPP (n=10) group. Values represent mean±SD.
姜黄素是一种黄色多酚类物质,存在于香料姜黄的根茎中,具有抗氧化,抗炎,抗突变和抗致癌作用。近年来,已报道了姜黄素的保肝作用。Anggakusuma[13]发现姜黄素通过影响膜流动性从而抑制病毒结合和融合,从而独立于基因型和原代人肝细胞抑制HCV进入,Eshaghian等[14]报道姜黄素可减轻BDL大鼠的肝纤维化和胰岛素抵抗。在我们的研究中,补充姜黄素可降低血清中ALT和AST的水平,抑制细胞外基质的沉积并减少炎症细胞浸润。这些结果与其他研究结果一致,表明姜黄素在肝脏保护中的广泛应用前景。
核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)通过与抗氧化反应元件结合在氧化应激中起关键作用[15],可稳定机体内氧化-抗氧化平衡。蔡月琴等[16]发现,在非酒精性脂肪肝炎中,Nrf2及其下游调控因子(HO-1及NQP1等)可对抗氧化应激导致的炎症反应,减缓疾病进程。HO-1是受Nrf2调节的主要应激反应因子。之前的研究表明,姜黄素可通过调节Nrf2 / HO-1途径直接激活Nrf2表达并减轻肝损伤[17-18]。HO-1是血红素分解代谢的限速酶,可催化游离血红素代谢产生胆绿素、游离铁离子和一氧化碳,具有突出的抗炎和抗氧化作用。在我们的研究中,我们发现姜黄素通过提高HO-1的表达来改善实验性肝脏胆汁淤积,当我们使用HO-1抑制剂ZnPP时,保护效果大大减弱。ZnPP是血红蛋白合成时形成的一种微量正常代谢产物,是临床上治疗高胆红素血症的潜在药物,药效温和,因此,我们有理由推测,ZnPP逆转姜黄素对于实验性肝脏胆汁淤积的保护作用是由于其特异性抑制了HO-1的活性,而非对机体造成了损害[19]。
综上所述,本研究建立了模拟临床状态下小鼠肝纤维化模型,采用HO-1活性抑制剂ZnPP进行干预,显示姜黄素可通过提高HO-1表达来减轻BDL所致的小鼠胆汁淤积性肝硬化,为临床上有效地治疗肝纤维化提供新的分子靶点和治疗策略。

