载脂蛋白E对低氧诱导小鼠肺动脉平滑肌细胞增殖的影响及其机制*
郝家乐, 徐立聪, 黄天鹏, 余 艳, 王瑶尧, 范小芳, 龚永生, 毛孙忠
(温州医科大学低氧医学研究所, 浙江 温州 325035)
低氧诱导的肺血管平滑肌细胞(pulmonary arterial smooth muscle cell,PASMCs)异常增殖是低氧性肺动脉高压重要的病理学特征[1]。本课题组最新的研究发现:低氧诱导肺组织载脂蛋白E(apolipoprotein E,apoE)蛋白表达下调参与小鼠低氧性肺动脉高压的形成[2],研究发现,外源性apoE能抑制血小板源性生长因子(platelet derived growth factor,PDGF)介导的平滑肌细胞增殖和迁移[3],尚不清楚apoE是否对低氧诱导的PASMCs增殖具有抑制作用。本实验在原代培养小鼠PASMCs上,探讨外源性apoE对低氧诱导的PASMCs增殖的影响及可能机制,旨在为低氧性肺动脉高压的发病及防治机制研究提供实验资料。
1 材料与方法
1.1 实验动物与试剂
SPF级野生型雄性C57BL/6小鼠,由上海斯莱克实验动物有限责任公司提供,动物许可证号SCXK(沪2017-0063),apoE(人血浆提取物,Sigma公司),apoE抗体、钙调节蛋白(Calponin)抗体、α肌动蛋白(α-SM actin)抗体、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(Abcam公司),蛋白激酶C(protein kinase C,PKC)抗体、磷酸化蛋白激酶C(phosphorylated protein kinase C,p-PKC)抗体(Santa Cruz公司),GADPH(CST公司),EdU掺入试剂盒(锐博生物有限公司)。
1.2 PASMCs原代培养
采用组织块贴壁法原代培养小鼠PASMCs[4]:颈椎脱臼法处死小鼠,75%酒精中浸泡5 min。无菌条件下分离肺动脉(含肺动脉主干和左、右肺动脉干),在外科手术显微镜下尽可能彻底剥除肺动脉外膜,然后纵向剪开,用手术刀片轻轻刮除肺动脉内皮,再将肺动脉中膜剪成0.5~1mm3组织块,以1块/cm2的密度接种于50 ml培养瓶中,置于37℃、5%CO2孵箱培养。
1.3 PASMCs鉴定
培养好的细胞用抗α-SM actin抗体和抗Calponin抗体行免疫荧光法显色,α-SM actin和Calponin双阳性细胞为PASMCs。
1.4 PASMCs分组与处理[4]
取3~5代生长状态良好的对数生长期PASMCs,按1×105cells/well接种于6孔板中,贴壁后长至50%融合,无血清处理24 h使细胞周期同步化并随机分为四组:常氧组,常氧+apoE组,低氧组和低氧+apoE组。常氧组培养条件为:1% FBS DMEM/F12,21% O2,5% CO2,37℃;低氧组培养条件为:1% FBS DMEM/F12,1% O2,5% CO2,37℃,外源性加apoE使终浓度为10 μg/ml[5],培养时间为48 h,重复三次;48 h后检测PASMCs增殖率,apoE、PCNA、PKC以及p-PKC等蛋白表达的变化。
1.5 PASMCs增殖检测
采用EdU掺入法测定细胞增殖(具体步骤参考锐博生物公司试剂盒说明书):取对数生长期细胞,以每孔 4×103~1×105细胞接种于6孔板中,培养至正常生长阶段。各组细胞加入50 μmol/L EdU培养基500 μl,孵育2 h,然后固定细胞,EdU进行染色(红色),再对DNA进行Hoechst33342染色处理,荧光显微镜下随机拍摄20个视野,分别计数总的细胞核数(蓝色)与增殖细胞数(紫色),细胞增殖率=增殖细胞数/总细胞数×100%。
1.6 PASMCs蛋白表达检测
PASMCs中加RIPA裂解液600 μl以制备匀浆。经SDS-PAGE Bio-Rad电泳分离(上样总蛋白量为20 μg),4℃电转膜过夜,封闭后依次加入apoE(1∶200)、PCNA(1∶500)、PKC(1∶400)、p-PKC(1∶400)和GADPH(1∶2 500)一抗,二抗,选用超敏型化学发光检测试剂盒,置于Bio-Rad凝胶成像分析系统进行曝光、成像。Image Lab 4.0图像分析软件分析处理,以GADPH为内参蛋白,计算目的蛋白与内参蛋白间的相对比值。
1.7 统计学处理
2 结果
2.1 原代培养小鼠PASMCs的鉴定
免疫荧光显示α-SM actin和Calponin阳性细胞,α-SM actin和Calponin双阳性的PASMCs高达97%(图1)。
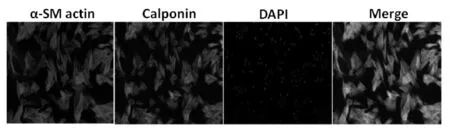
Fig.1The primary cultured PASMCs were identified by immunocytochemistry (×200)
2.2 ApoE对小鼠PASMCs增殖的影响
常氧组PASMCs增殖率与常氧+apoE组无显著性差异(46.67±3.88vs40.42±1.48,P>0.05);低氧组PASMCs增殖率较常氧组高64.7%(76.88± 2.09vs46.67±3.88,P<0.05);低氧+apoE组PASMCs增殖率较低氧组低19.6%(61.83±1.98vs76.88±2.09,P<0.05,图2A,2B)。
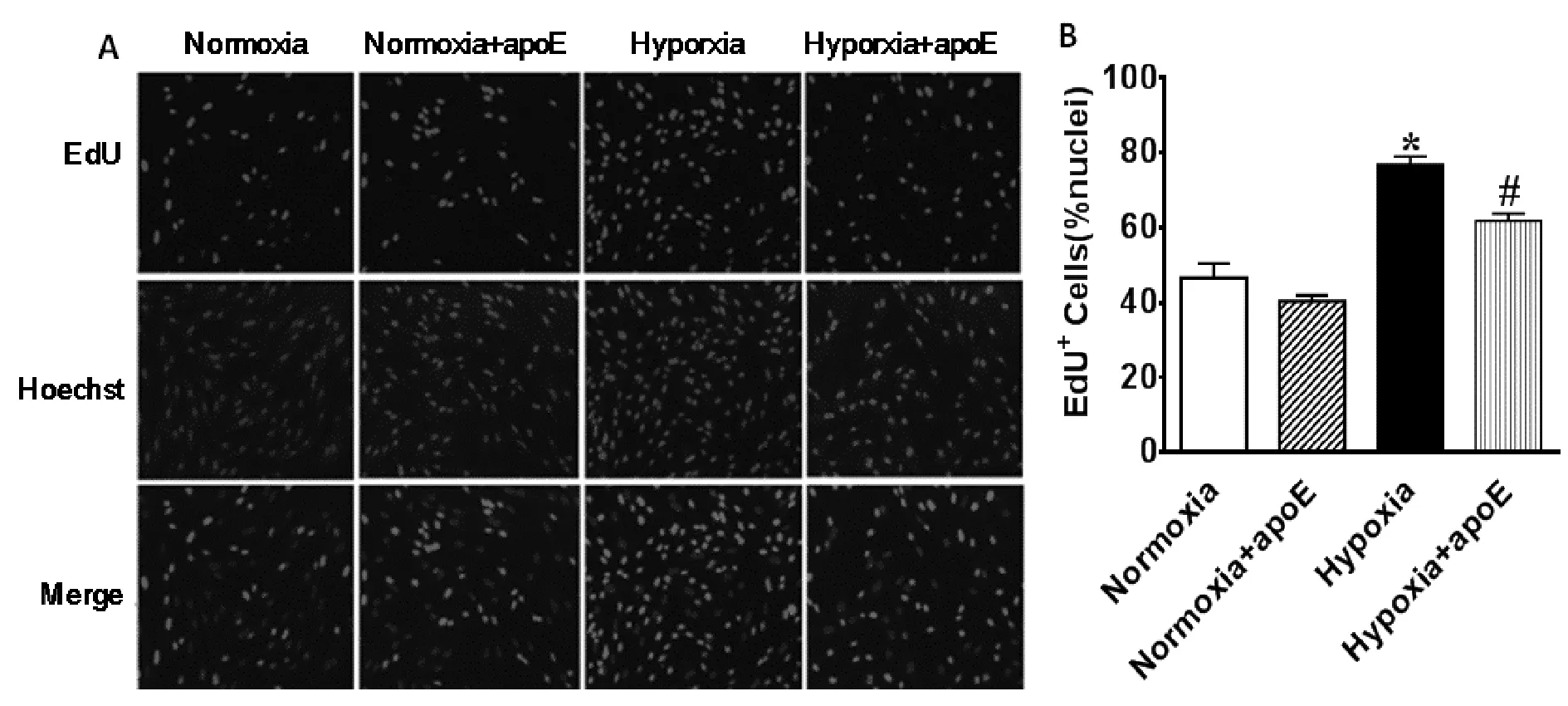
Fig.2Effects of apoE on the proliferation of PASMCs induced by hypoxia(×200,n=3)
*P<0.05vsnormoxia;#P<0.05vshypoxia
2.3 ApoE对小鼠PASMCs的PCNA、PKC和p-PKC蛋白表达的影响
低氧组apoE蛋白表达较常氧组下调51.0%(P<0.05,图3A,3B)。
常氧组PCNA蛋白表达与常氧+apoE组无显著性差异(P>0.05);低氧组PCNA蛋白表达较常氧组上调69.0%,低氧+apoE组PCNA蛋白表达较低氧组下调19.8%(P均<0.05,图3C,3D)。
各组间PKC蛋白表达无显著性差异,常氧组p-PKC蛋白表达与常氧+apoE组无显著性差异(P均>0.05);低氧组p-PKC蛋白表达较常氧组上调 120.0%,低氧+apoE组p-PKC蛋白表达较低氧组下调103.2%(图3C,3D,P均<0.05)。
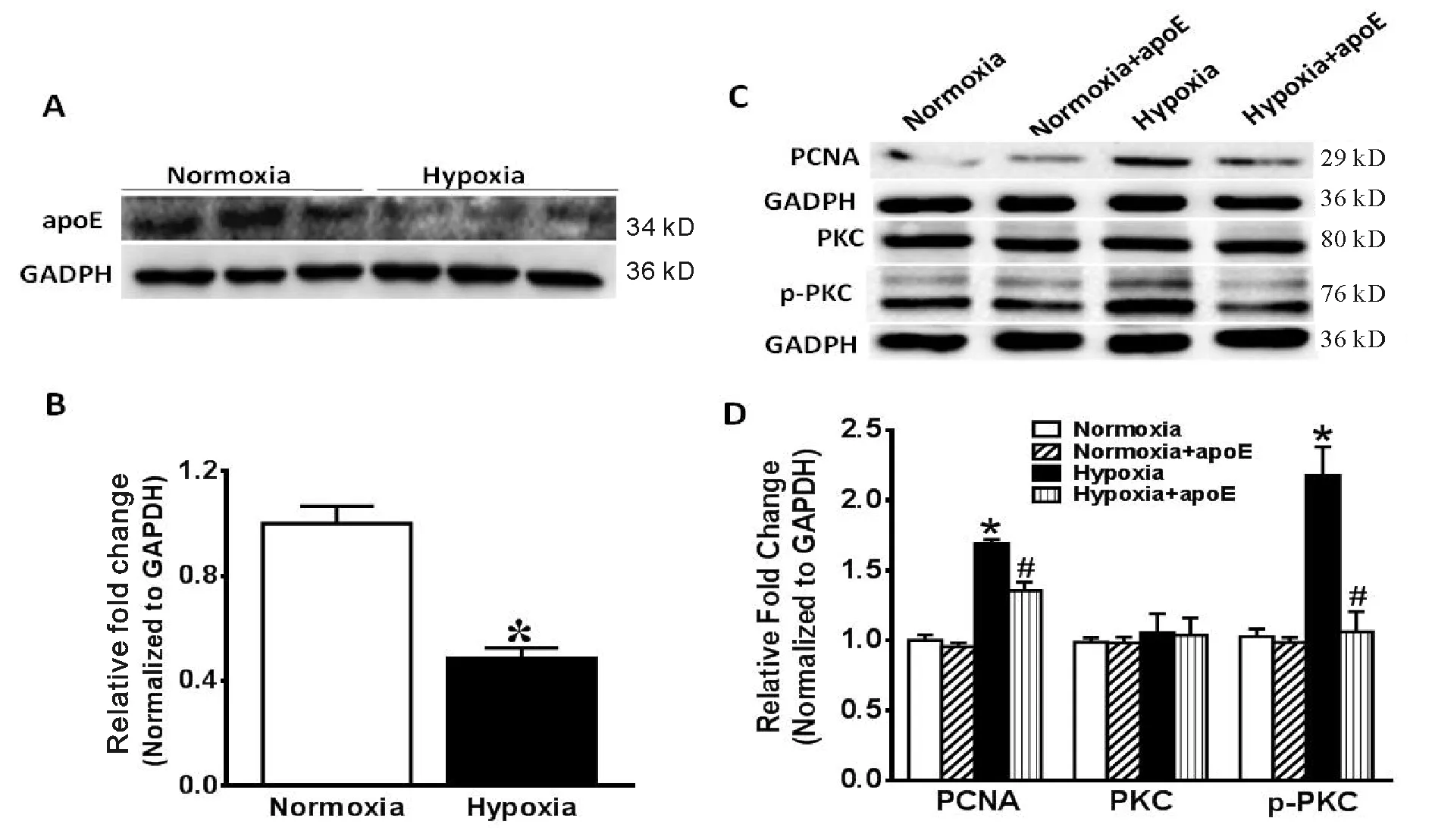
Fig.3Effects of apoE on relative protein expressions of PASMCs induced by hypoxia (n=3)
*P<0.05vsnormoxia;#P<0.05vshypoxia
3 讨论
ApoE是低密度脂蛋白(low density lipoprotein,LDL)受体的配体,通过LDL受体由肝摄取胆固醇酯残粒,对维持血浆胆固醇水平发挥重要作用,是降低血浆中ox-LDL含量和抑制血管壁动脉粥样硬化斑形成的保护因子,与高脂血症和冠心病密切相关,目前主要应用于抗动脉粥样硬化方面的研究。近年的研究表明:肺动脉高压的形成与机体脂质代谢异常关系密切[6-7]。本课题组先近的研究表明:脂质代谢异常参与单纯低氧诱导的小鼠肺动脉高压的形成[8],最新的研究结果显示:小鼠低氧性肺动脉高压形成与低氧诱导肺组织apoE蛋白表达下调有关[2]。已知PASMCs增殖堆积是低氧诱导的肺血管重塑和肺动脉高压形成的重要因素,抑制PASMCs增殖可改善低氧诱导的肺血管重塑和肺动脉高压[9]。研究发现,作为一种蛋白质因子,apoE还具有抗炎、抗脂质氧化以及抑制PDGF介导的平滑肌细胞增殖和迁移等作用[5,10],尚不清楚apoE是否对低氧诱导的PASMCs增殖具有抑制作用。
实验结果显示:低氧组PASMCs增殖率较常氧组显著升高,PCNA蛋白显著上调,同时apoE蛋白表达显著下调,提示低氧可诱导PASMCs增殖,低氧诱导PASMCs增殖与apoE蛋白表达下调有关,这与之前在整体动物模型上的研究结果相符[2]。PKC是一类丝氨酸/苏氨酸蛋白激酶家族,广泛存在于机体的组织细胞内中,是磷脂肌醇信号途径的中心环节,参与多种生理功能的调控,如调节基因表达、细胞增殖和分化、细胞凋亡、细胞迁移等,Dempsey等[11]报告低氧经活化PKC途径诱导PASMCs增殖,Jiang等[12]的研究发现PKCα通过激活ERK1/2途径进而促进低氧诱导PASMCs增殖,本实验结果显示:低氧组与常氧组间PKC蛋白表达无显著性差异,低氧组p-PKC蛋白表达较常氧组显著上调,这与上述的实验结果一致,说明低氧诱导PASMCs增殖与PKC途径活化有关。
值得注意的是,实验结果还显示:apoE组PASMCs增殖率较低氧组显著降低,PCNA蛋白显著下调,同时p-PKC蛋白表达亦显著下调,研究发现,抑制PKC途径可拮抗低氧诱导的PASMCs增殖[13],提示外源性apoE抑制低氧诱导PASMCs增殖作用可能通过抑制PKC途径活化来实现,其可能的机制与apoE抑制ERK1/2通路有关[14],具体机制有待进一步阐明。目前,至少发现有13种PKC亚型(不同物种、不同组织细胞中PKC亚型分布不同),根据激活物的差异分类,α、βI、βII和γ等经典PKC亚型的激活物为Ca2+和甘油二酯,而新颖PKC亚型如ε、θ、η、δ和μ等受甘油二酯激活,非经典PKC亚型如ζ、ι和λ受其它脂质衍生物激活[15]。研究发现,肺血管主要表达PKCα、PKCβI、PKCβII、PKCδ、PKCε和PKCη,低氧通过激活PKCα诱导PASMCs增殖[12],慢性低氧性肺动脉高压和右心室肥厚的发生与肺血管PKCα、PKCβI、PKCβII和PKCδ表达异常有关,而与PKCε和PKCη无关[16],apoE是经哪些PKC亚型抑制低氧诱导PASMCs增殖有待进一步的研究。同样的,外源性apoE是否具有改善低氧诱导的肺血管重塑作用,apoE防治低氧性肺动脉高压具体的分子机制有待进一步的探究。
综上所述,apoE能抑制低氧诱导小鼠PASMCs增殖,其可能机制与阻碍PKC途径有关。进一步研究apoE防治低氧性肺动脉高压的作用,不仅有助于扩展对低氧性肺动脉高压发病机制的认识,而且可为低氧性肺动脉高压的防治提供新的思路。

