2017年江苏省H3N2流感病毒血凝素与神经氨酸酶分子特征及耐药性分析
王慎骄,祁 贤,邓 斐,彭杰夫,余慧燕,秦圆方,戴启刚,鲍倡俊
0 引 言
流行性感冒(简称流感)一直是人类健康的重大威胁,据WHO估计,每年全球约有6亿人感染流感病毒,占总人口的10%。流感病毒是属于正粘病毒科,分为甲、乙、丙和丁4个属。其中除了丁型病毒,其它流感病毒都可感染人类,构成了人季节性流感主要病原。流感病毒基因组属于单股负链RNA病毒,其最主要的特点是变异频率极高,有助于病毒逃避宿主免疫系统的清除,反复的突破免疫屏障,在人群中广泛流行。1968年世界范围流感大流行之后,H3N2亚型流感病毒一直人群中流行的一个主要亚型[1-2],其血凝素(HA)和神经氨酸酶(NA)的氨基酸替换频频发生,导致H3N2流感病毒疫苗有效性普遍低于甲型H1N1和乙型流感病毒的疫苗[3]。2017-2018流感监测显示每年2个流行高峰:冬春季高峰和夏季高峰。夏季流感高峰的毒株为季H3,而冬季高峰通常由新甲H1、季H3和B型中的一种或多种亚型毒株共同构成。因此本研究旨在分析江苏H3N2亚型流感分离株的分子特征以及耐药性的改变,为预防和预警流感的流行提供理论基础。
1 材料与方法
1.1标本来源从江苏省13个流感监测点流感毒株中选取17株H3N2亚型毒株,其中12株为2017年夏季高峰期分离株,4株为非高峰期分离株,1株为2016年度分离株(作为1株参考株)。
1.2核酸提取采用商品化核酸提取试剂盒(ABI 5X MagMAX-96 Viral Isolation Kit)于 ABI自动核酸提取仪中提取17株H3N2亚型流感毒株核酸,每个样本量为50 μL,洗脱液为100 μL,-70 ℃保存备用。
1.3 H3N2亚型流感病毒全基因组测序采用季节性流感病毒H3N2亚型全基因扩增试剂盒(伯杰)。PCR反应体系按试剂盒说明书配制,反应条件为:50℃,30 min;94℃,3 min;35个循环(94℃,30 s,60℃,30 s,72℃ 1.5 min)然后72℃,7 min。取扩增产物5 μL,1%琼脂糖凝胶电泳。电压80 V,电泳时间为40 min,凝胶成像仪观察电泳结果。可疑阳性条带送公司测序。
1.4基因序列分析从全球共享流感序列网站GISAID下载构建甲型H3N2亚型流感毒株HA(血凝素)系统进化树的骨架参考序列,包括2014-2015年北半球H3N2流感疫苗株A/Texas/50/2012(vaccine 3c.1),2015至2016年北半球H3N2流感疫苗代表株 A/Switzerland/9715293/2013(vaccine 3c.3a),2017至2018年北半球H3N2流感疫苗株A/HongKong/4801/2014(vaccine 3c.2a),2016 至 2017流感年引起香港流行高峰的H3N2亚型代表株(A/HongKong/2293/2017),2016年欧洲流行H3N2亚型代表株A/Norway/3806/2016(3c.2a1)等。使用MEGA软件对序列进行比对,然后构建系统进化树。构建时选用邻接法Neighbor-Joining(NJ)方法,Bootstrap设置为1000。氨基酸置换分析使用Lagergene 7.01软件包中的MegAlign对HA编码的氨基酸进行比较,查看HA抗原决定簇区域氨基酸置换情况。
1.5 H3N2亚型流感病毒耐药性检测NA抑制试验检测病毒对神经氨酸酶抑制药物的敏感性。按全国流感监测方案技术指南,采用荧光发光法(Fluorescence-based assay,FL)进行检测,试剂盒采用NA-Flour TM流感病毒NA检测试剂盒(Thermo Fisher,Cat No.4457091)。步骤:①检测 H3N2毒株的NA活性:用缓冲液在96孔检测板中2倍系列稀释待检病毒和参考病毒病毒。每个病毒的初始稀释倍数为1∶2,最后1孔为空白对照;从第12列开始至第1列依次加入底物工作液后,37℃孵育1 h。孵育完后加终止液终止反应,用仪器检测荧光信号值,选取接近靶信号值的荧光信号值来确定病毒的稀释倍数;②NA抑制试验:在第12列加50 μL缓冲液,第11列加25 μL缓冲液,由高浓度到低浓度在第1-10列中,各自加入对数稀释的25 μL的神经氨酸酶抑制药物。用多道移液器从11列到第1列加入25 μL稀释好的病毒充分混匀;37℃孵育45 min;用多道移液器按照第12-1列的顺序在每孔中加入50 μL底物工作液,充分混匀;37℃孵育1 h;加入终止液后,用仪器检测荧光信号值,得到的数据用GraphPad Prism 5或类似的软件绘制曲线,计算半数抑制浓度(IC50),即NA酶活性被抑制50%时的药物浓度。
2 结 果
2.1进化树分析16株病毒HA和NA基因核苷酸相似性分别为98.9%~99.6%、99.2%~99.3%,同源性较高。HA进化树分析显示,16株江苏分离株有15株位于3C.2a分支上,1株位于3C.2a1分支(与引起暴发流行的A/HongKong/2293/2017在同一分支),总体与全国2017年流行趋势一致。HA进化树中16株江苏分离株可以进一步分为4个小的进化分支,各进化分支的毒株数量分别为:1.1(n=13)、1.2(n=1)、1.3(n=1)和2.1(n=1)。NA进化树中,16株江苏分离株进一步分为4个分支,各分支的毒株分布为:1.1(n=12)、1.2(n=2)、1.3(n=1)和2.1(n=1)。16株病毒5个基因型(A、B、C、D和F),其中基因型A(n=11)是优势流行基因型。见表1。
2.2分子特征分析2017年H3N2流行的3C.2a1分支中,HA蛋白的(N171K、I406V和G484E)突变是该分支标志突变。16株分离株中13株病毒N171K、I406V和G484E关键位点未发生变化,见表2。另外3株毒株关键位点发生变异,有1株毒株发生该标志性氨基酸变异,1株毒株发生(N121K、T135K)的免疫相关突变。
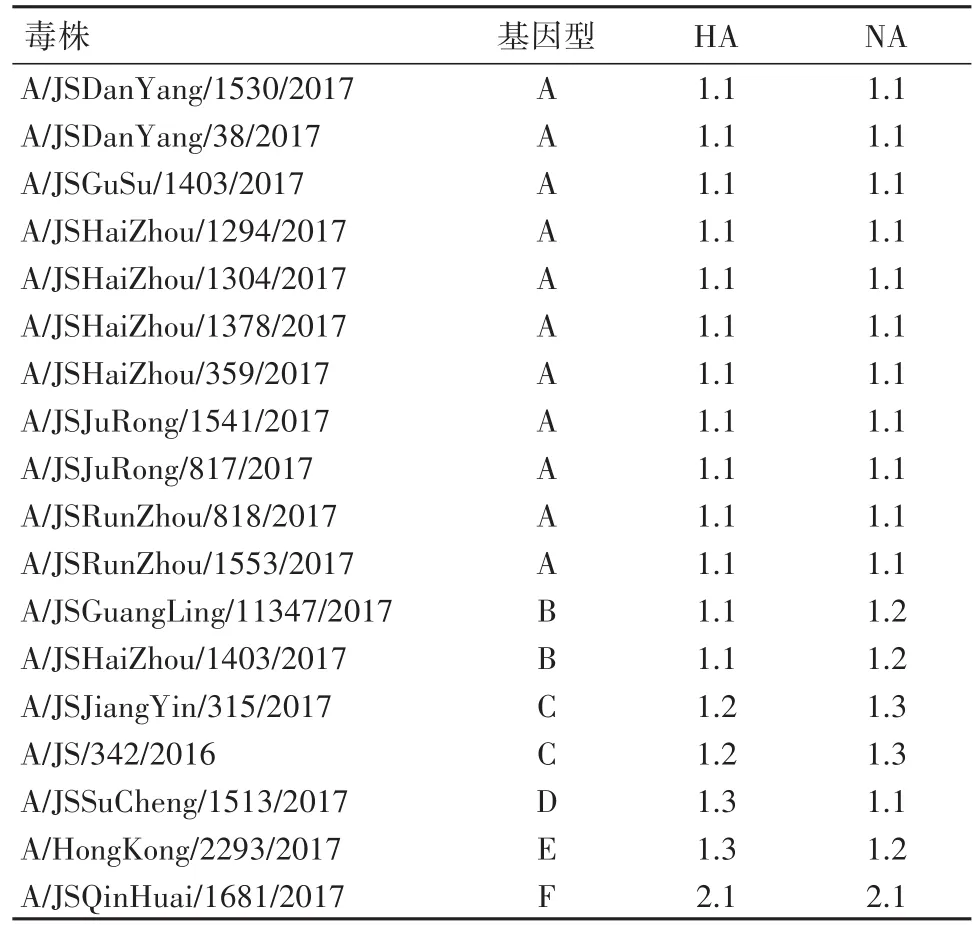
表1 2017年江苏省16株分离株HA和NA基因型分组列表Table 1 Gene constellation of influenza H3N2 viruses from Jiangsu province
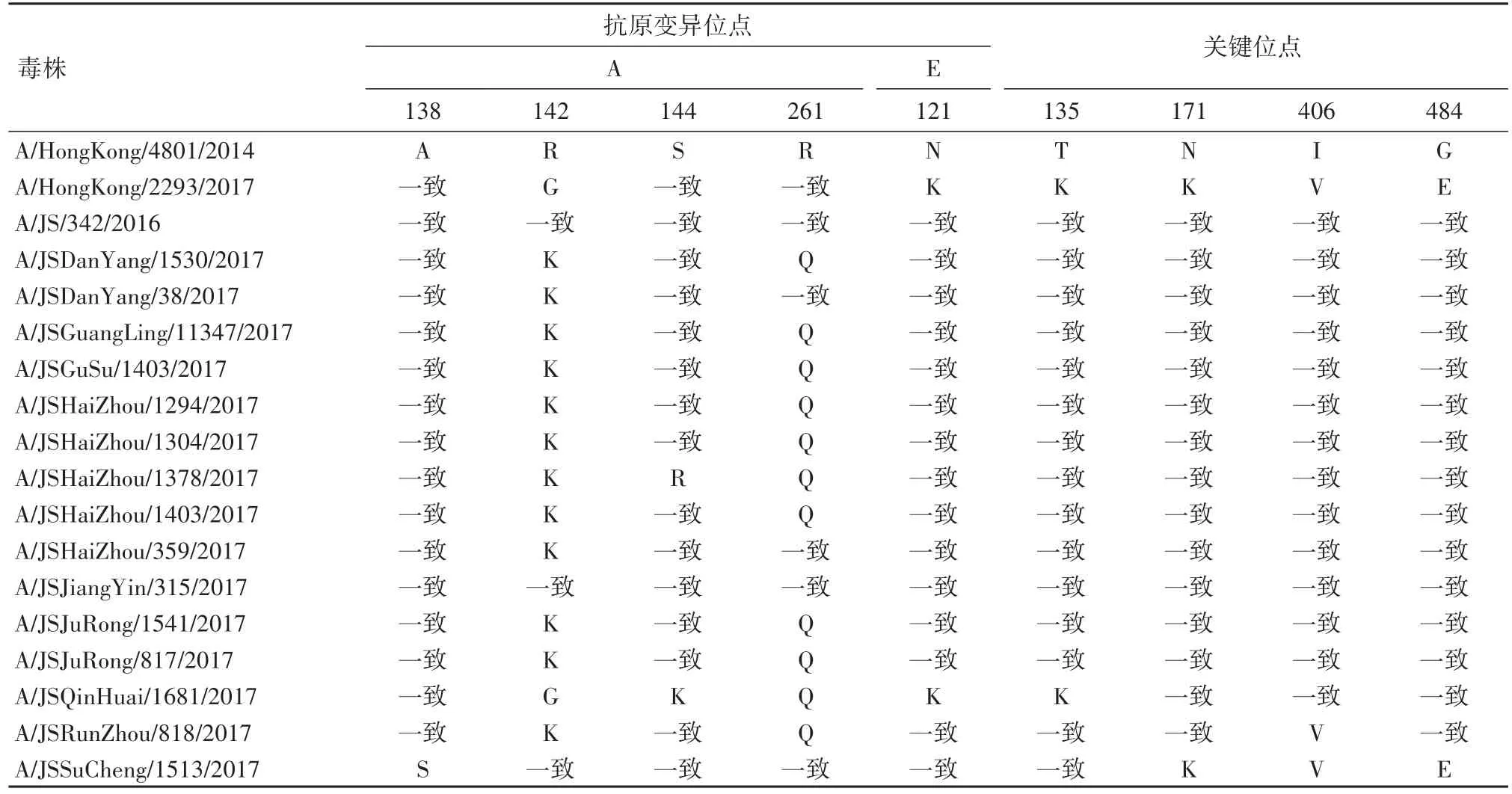
表2 2017年江苏H3N2流感病毒分离株与疫苗推荐株及香港流行株抗原变异位点及关键位点的比较Table 2 Antigentic variants and other amino acid sites of influenza H3N2 viruses from Jiangsu province
与2017-2018年度疫苗株推荐株A/HongKong/4801/2014相比,16株分离株抗原位点突变发生不同程度的改变,其中位点突变包括:A138S 1株,R142K 2株,R142K、R261Q 9株,R142KS144R、R261Q 1株,R142K、S144K、R261Q 1株 。
2.3耐药性分析对16株病毒的NA片段的分析未发现NA耐药位点。NA抑制试验结果表明,病毒IC50值<10倍NAI敏感株IC50值,表明病毒对所检测的NA药物敏感。基因型和表型分析表明,16株H3N2亚型流感毒株对抗流感药物奥司他韦及扎那米韦均敏感,均发现与M2基因耐药有关的A30T、S31N分子位点的改变。见表3。
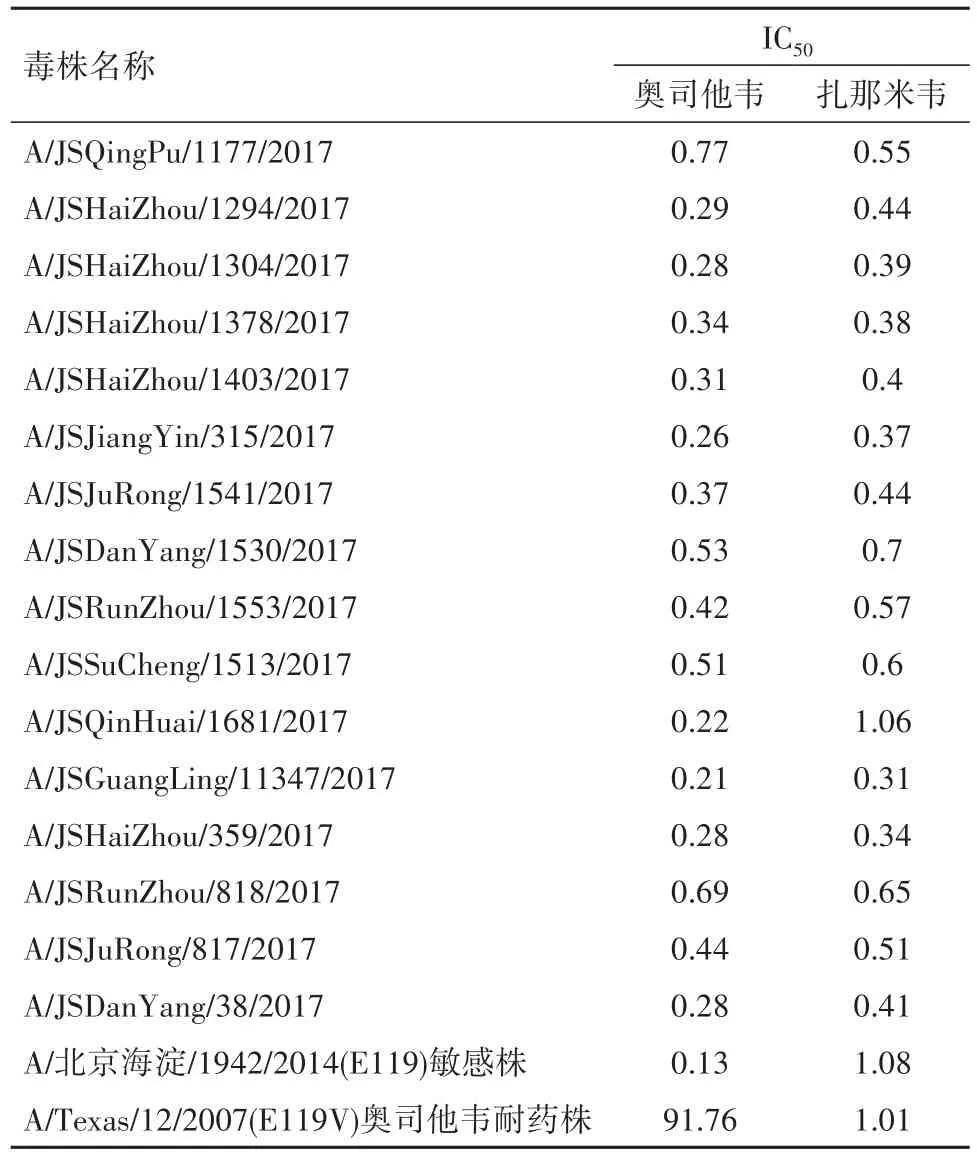
表3 2017年江苏H3N2流感病毒分离株耐药检测结果Table 3 Drug resistance test results of influenza H3N2 viruses from Jiangsu province
3 讨 论
2016-2018年中国流感监测数据显示,江苏省甲型流感病毒(H1N1pdm09和H3N2)与乙型流感病毒(Victoria系和Yamagata系)同时在人群中流行。江苏省每年流感流行病高峰除了冬春季高峰,夏季也会出现发病高峰。病原学监测结果来看。本研究选取江苏省2017年跨越夏季流行高峰的16株H3N2流行株,开展分子流行病学研究。
点突变引起的抗原漂移是H3N2流感病毒的一种重要进化方式,也是病毒逃避人群免疫压力主要策略。一般认为,具在血凝素HA蛋白抗原位点上至少有4个以上氨基酸发生替换,且需要分布在2-3个抗原决定簇,就可能导致病毒发生抗原漂移[4-5]。本研究中,与疫苗株相比,16株病毒中有11株在2个抗原决定簇上发生氨基酸变异,其中又有2株发生3个氨基酸点突变,应继续加强对HA基因抗原位点变异的监测。
2017年香港由于H3N2流感爆发,导致300余人死亡。研究发现,此次H3N2流行病毒(以A/HongKong/2293/2017为代表)的HA蛋白发生N121K、N171K位点的突变,提示这2个位点的突变可能与H3N2流感的暴发和致病性有关[6]。本研究中,有2株病毒(A/JSQinHuai/1681/2017和 A/JSSuCheng/1513/2017)分别发生N121K、N171K的突变与香港毒株(A/HongKong/2293/2017)一致,但其他14株没有发生相关突变。这些突变可能是H3N2毒株为了逃避疫苗诱导的抗体反应,逃避宿主的免疫与清除而发生的突变,16/17流感年度韩国也同样发现相同位点的突变导致流感样病例的明显上升[7]。其中A/JSSuCheng/1513/2017分离株在进化树上与17年香港流行株(A/HongKong/2293/2017)和16年欧洲流行株(A/Norway/3806/2016)进化距离最近,有多个相同的突变位点。对比可以看出A/JSSuCheng/1513/2017分离株与在HA进化上同属1.3组,都具有N171K、I406V和G484E标志性突变,属于3C.2a1分支[8],而A/JSQinHuai/1681/2017在进化树上与上一年度流感毒株较为接近。但是其跟A/HongKong/2293/2017一样具有N121K突变。提示我省H3N2流感毒株从16/17流感年度开始就已经有该位点的突变,该突变由3C.2a1分支上发现[7]提示出现抗原漂移现象。而2个位点突变的同时出现可能会导致流感毒株对免疫应答的逃避能力增强导致流行高峰,引起死亡病例增加,应加强防控。根据文献报道世界范围内位于3C.2a1分支上发生N171K突变的H3N2流感病毒很大一部分携带N121K和T135K突变[9-10],但是这两个突变没有明显改变病毒的抗原性[11],T135K突变对抗体中和率略有影响[12],所以对病毒特性的潜在影响需要进一步研究。结果显示香港流行株2017年已经传入江苏,虽然没有形成优势流行,仍需加强监测。近年来研究发现,基因重配也是H3N2病毒快速进化的重要方式,对病毒的抗原性、致病性和传播力都有重要影响。本研究中HA和NA基因进化分析表明,2017年江苏H3N2亚型流行株HA和NA基因表现出异质性特点,16株病毒有5株病毒的HA和NA基因发生基因重配现象。增加了江苏H3N2流感病毒的多样性,这些重配病毒的生物学特性尚需进一步研究。应继续加强对HA基因抗原位点变异的监测。
近年来人感染禽流感频繁发生,不断出现重症和死亡病例,更突显临床上抗流感药物的重要性。流感病毒也不断的发生着耐药性的突变。目前绝大多数甲型流感病毒已对磺胺类药物产生耐药性[13],江苏分离株均发现A30T、S31N分子位点的改变,提示对磺胺类药物耐药[14]。研究表明,N2亚型NA蛋白一些氨基酸位点的突变(E119V、Q136K、D151V/D、I222V、R224K 、E276D、R292K 、N294S、R371K)会导致病毒对神经氨酸酶抑制剂产生抗性[15]。本研究中未发现分离株存在上述位点改变。虽然目前监测发现H3N2流感病毒对该药物仍然敏感,我们仍然应该加强监测和其他类型抗流感药物的研发工作。流感疫苗和神经氨酸酶抑制剂类药物目前仍然是预防H3N2流感病毒的重要措施。随着H3N2流感病毒变异持续发生,我们应该密切监测病毒遗传进化和耐药基因的变化情况,以此为核心和切入点从而能够有效地防控H3N2流感病毒的暴发流行,为疫情防控提供科学依据[16-17]。

