无微量清蛋白尿存在的2型糖尿病患者视网膜病变危险因素分析
王霞娟,杨家悦,石 维,程海燕,朱圣炜,吴文君
0 引 言
糖尿病视网膜病变(diabetic retinopathy,DR)、糖尿病肾病(diabetic nephropathy,DN)及糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病患者最主要的3种慢性微血管并发症。在病程的不同阶段,三者可以并存或仅表现为某一种并发症单独存在。本研究对169例尿蛋白正常、无DPN存在,且并发DR的2型糖尿病(type 2 diabetes mellitus,T2DM)患者临床及实验室资料进行分析,旨在探讨单纯性DR(仅DR,无DPN存在及尿微量清蛋白正常)发生、发展的相关危险因素,从而为寻找DR早期诊断和防治的生物学指标提供参考。
1 资料与方法
1.1研究对象回顾性分析2015年1月至2018年12月我科住院,并仅有DR(无蛋白尿及周围神经病变)的169例患者临床资料(DR组)。其中男86例、女83例,年龄28~83岁,平均(59.4±9.8)岁。参照文献[1]将DR组患者进行分类。其中7例增殖期糖尿病视网膜病变(proliferation stage of diabetic retinopathy,PDR)患者及20例重度非增殖期糖尿病视网膜病变(non-proliferation stage of diabetic retinopathy,NPDR)患者列入重度DR;82例中度NPDR患者列入中度NPDR;60例轻度NPDR患者列入轻度NPDR。同时选取208例同期住院性别、年龄匹配且无微血管并发症存在的T2DM患者作为对照(NO-DR组)。所有患者均符合1999年世界卫生组织(WHO)糖尿病诊断及分型标准;排除出现糖尿病急性并发症,各种急、慢性感染性疾病以及肝、肾功能不全、严重心脑血管疾病、血液系统疾病、恶性肿瘤及妊娠者。
1.2研究方法
1.2.1临床资料获取记录患者性别、年龄、有无吸烟史(吸烟定义为每天吸烟1支以上,连续时间长于1月为吸烟)、他汀服用史(“目前服用≥4周”判断为服用)、糖尿病病程、高血压病程、糖尿病起病年龄,测量研究对象身高、体重并计算体重指数(BMI)[1]。以标准水银柱式血压计测量坐位右上臂血压,并记录收缩压(SBP)和舒张压(DBP)。
1.2.2标本留取与检测所有研究对象均禁食8~10h,并晨起暂停一切降糖方案,在空腹静息状态下抽取静脉血,测定空腹血糖(FBG)、尿素氮(BUN)、血清肌酐(SCr)、胱抑素C(cystatin C,Cys)、尿酸(UA)、总胆固醇(TC)、三酰甘油(tTG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、糖化血红蛋白(glycosylated hemoglobin,GHbA1c)、空腹C肽(fasting C-peptide,FC);标准“馒头餐试验”下的餐后2h血糖(2 h postprandial blood glucose,PBG)和餐后2hC肽(2 h postprandial C-peptide,PC)。非HDL-C值=TC值-HDL-C值;CKD-EPI公式估算的肾小球滤过 率(glomerular filtration rate,GFR)(mL/min·1.73m2)=141×(SCr/K)a×(0.993)age×1.018(女 性)(K 值:女性=0.7,男性=0.9;a值:女性,SCr≤0.7,a=-0.329,SCr>0.7,a=-1.209;男性:SCr≤0.9,a=-0.411,SCr>0.9,a=-1.209)[1]。
1.2.3慢性微血管并发症的判断①DR:所有患者均接受眼底照相和(或)眼底造影,眼底照相和眼底造影结果如有差异,以眼底造影结果为准。眼底检查由我院固定眼科医师操作进行,并对结果按照2002年国际糖尿病视网膜病变分级标准做出相应诊断。②微量清蛋白尿:在避免剧烈运动下连续留取3 d晨尿测定尿白蛋白和肌酐,计算尿白蛋白/肌酐值(ACR),以2次ACR≥30 mg/g判断为尿蛋白异常;反之,则判断为无微量清蛋白尿存在。③DPN:临床上有手足指(趾)对称性感觉障碍等临床症状或神经电生理检测有神经传导速度异常判断为DPN存在;反之,则判断为无DPN存在[2]。
1.3统计学分析采用SPSS 17.0统计学软件进行统计分析。连续型变量以均数±标准差(xˉ±s)表示。两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD检验。分类变量以n(%)表示,组间比较行χ2检验。对于有统计学差异的各项指标与DR的关系采用二分类多因素Logistic回归分析得出DR发生的危险比。各危险因素与DR分期相关性行Spearman等级相关分析。以P≤0.05为有统计学意义。
2 结 果
2.1基本资料比较2组患者年龄、性别、BMI、HBP病程、FBG、TC、LDL-C、HDL-C、非HDL-C、UA、BUN、吸烟史比较差异均无统计学意义(P>0.05);而DR组患者的DM病程、GHbA1c、SBP、DBP、PBG、TG、SCr、Cys及他汀服用率显著高于NDR组,DM起病年龄、eGFR值、FC、PC则显著低于NDR组,差异均有统计学意义(P<0.05)。见表1。
2.2二分类多因素Logistic回归分析eGFR降低(OR:0.912,P≤0.001)、TG升高(OR:1.369,P<0.05)、SBP升高(OR:1.041,P<0.01)及起病年龄低(OR:0.914,P≤0.001)均为DR发生的高危因素。见表2。
2.3各危险因素与DR分期Spearman等级相关性分析NO-DR患者与轻度NPDR、中度NPDR及重度DR患者比较,各组间eGFR、TG、SBP及糖尿病起病年龄差异均有统计学意义(P<0.001),见表3。Spearman等级相关性分析结果显示,DR程度与eGFR呈负相关(r=-0.513,P<0.001),与 TG(r=0.110,P<0.033)及 SBP(r=0.231,P<0.001)均 呈 正 相 关 。见图1。
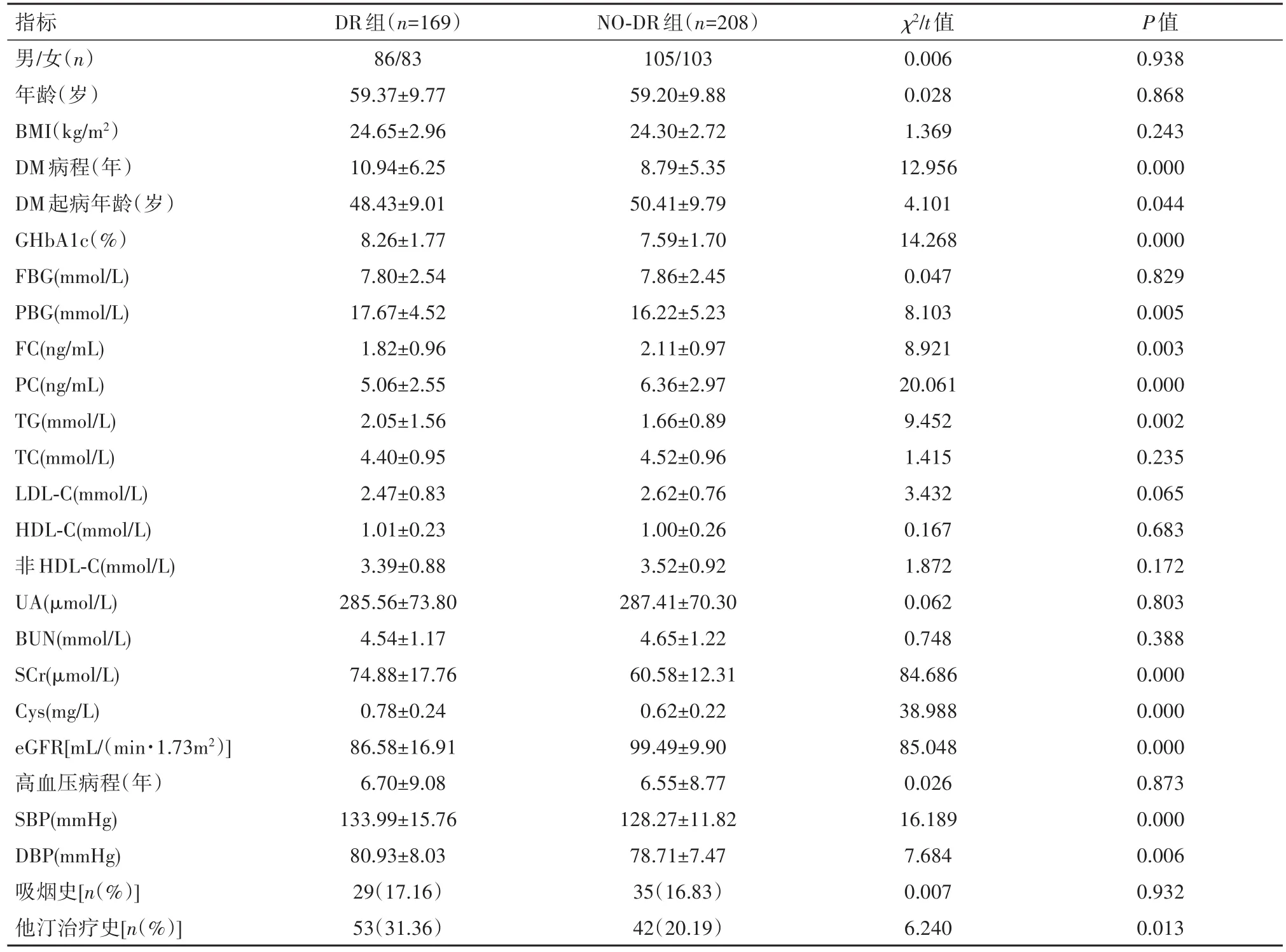
表1 2组糖尿病患者临床资料比较Table 1 Clinical data of two groups of patients with diabetes mellitus
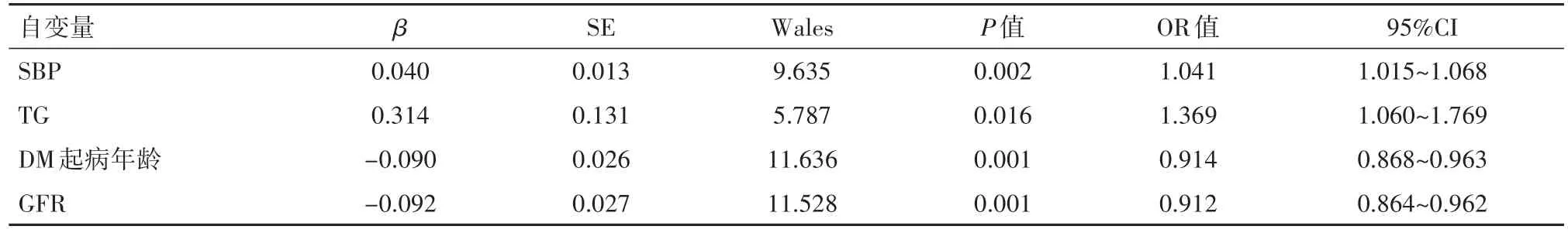
表2 单纯性糖尿病视网膜病变发生危险因素多因素分析Table 2 Multivariate analysis for diabetic retinopathy without proteinuria
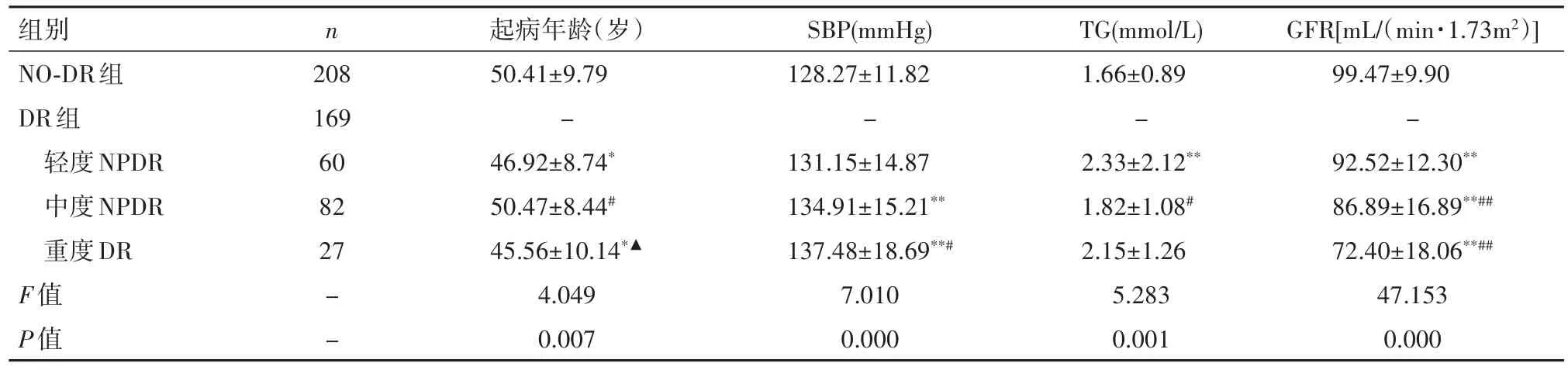
表3 不同程度DR与各高危因素比较Table 3 Comparison between the patients with different degree of DR

图1 各危险因素与DR分期Spearman等级相关性分析散点图Figure 1 Scatter diagram of the correlation between influence factors and DR stages
3 讨 论
DR是糖尿病高度特异性的微血管并发症,也是20~74岁成人新发失明病例中常见的病因。DR早期症状较为隐匿,致盲往往突然发生,而目前临床上对PDR没有确切挽救视力的强效治疗方法。因此,避免糖尿病性致盲的关键在于早期发现无症状DR,使患者在失明前得到有效治疗。既往研究中,普遍观点认为,DR发生的主要危险因素包括糖尿病病程、高血糖、高血压、血脂紊乱等[2-4];其他危险因素还涉及吸烟、肥胖、高尿酸血症及遗传因素等。
众多大型循证医学及Meta荟萃分析等均已证实,强化血糖控制能延缓糖尿病相关各种慢性并发症的发生和进展[5]。一些临床研究也发现,除血糖控制不佳外,糖尿病病程、起病年龄低等因素也与DR的发生有关[1,6]。这与本研究结果一致。有研究发现,SBP升高与视网膜病变发生强相关,收缩压从130 mmHg(1 mmHg=0.133kPa)升高至 160 mmHg,DR 的发生率增加 3.37倍[7]。Keech等[8]研究也证实,非诺贝特干预治疗后可使严重视网膜病变发生率降低34%,各种类型糖尿病视网膜病变的首次激光治疗需要降低31%,总体研究人群累积激光治疗次数减少37%[8]。本研究也发现,血压、血脂控制不佳,尤其SBP及TG升高均为DR发生、进展的独立危险因素,与Liu等[9]研究结果一致。这提示我们在关注降糖治疗的同时,更需同时血压、血脂等综合干预达标。
作为T2DM的2种最主要的慢性并发症,DR与DN由于在发病机制上存在许多共同点,因此经常相提并论并伴随发生,但临床上两者的发生、进展并不完全同步。GFR和尿ACR是DN诊断和病情评估的2个主要判断指标,既往DN主要以微量白蛋白尿值为诊断标准。但近几年的研究发现,相当部分的T2DM患者尿清蛋白正常,但GFR低于肾功能不全临界值[60 mL/(min·1.73m2)],部分患者则虽有蛋白尿但GFR正常。国外白种人群研究普遍认为,T2DM患者GFR与DR发生显著相关,GFR降低增加DR患病风险[10];亚洲人群则结果不一。Chen等[11]的研究提出相比于GFR中度降低,微量白蛋白尿对DR发生的预测价值更大;Guo等[12]的研究认为蛋白尿及GFR下降均与DR发生显著相关;而李淑婷等[13]的研究显示,GFR降低是DR发生的危险因素。本研究发现,在蛋白尿尚正常而眼底检查却证实DR已存在的患者中,衡量肾功能的3项主要指标包括SCr、Cys及以CKD-EPI公式估算的GFR较NO-DR患者差异均有统计学意义;相关性分析结果显示,GFR与DR程度呈负相关。Logistic回归分析后发现,GFR下降是DR发生的危险因素(OR:0.912,P≤0.001)。提示eGFR的降低早于蛋白尿发生,是DR发生的预警因子,eGFR越低,DR发生的风险越大。高血压导致的慢性肾功能不全常表现为轻到中度的蛋白尿与eGFR的程度也不一致,因此我们考虑在DR的发病机制上,高血压可能具有更为关键的作用。但本研究仅仅是回顾性的横断面研究,入组病例数量有限,且缺乏进行致病基因及一些相关细胞因子方面的检测。因此,下一步应扩大样本量进行证实。
综上所述,DR发生、进展受多种因素影响。在临床工作中,对于病程长、低龄化发病,特别是存在血压、血脂等多个代谢因素控制不佳的患者,更应该重视早期GFR评估,及时进行眼底病变相关筛查。

