SOX7启动子甲基化对膀胱癌增殖及凋亡的影响
吴 元,张文涛,马文超,王瑞良,郭亚东,刘 济,毛士玉,张俊峰,姚旭东
0 引 言
膀胱癌是最常见的泌尿系恶性肿瘤之一,全球范围内在新发恶性肿瘤中居第10位,在男性新发恶性肿瘤中居第6位,在男性肿瘤死亡率中居第9位[1]。临床中70%~75%的新发膀胱癌为非肌层浸润性,经尿道膀胱肿瘤电切术辅助术后膀胱灌注化疗为其主要治疗方案,然而该类患者5年复发率高达50%~70%,且有10%~15%会进展为肌层浸润性膀胱癌。肌层浸润性膀胱癌约占每年新发膀胱癌的25%左右,其5年肿瘤特异性生存率仅50%左右[2,3]。因此筛选新的膀胱肿瘤生物学标志物,对膀胱癌预防,诊断及治疗有重要意义。
DNA启动子甲基化异常是表观遗传学改变重要形式之一,与膀胱肿瘤的发生,发展有密切关系[4]。SOX7是SOX家族之一,参与多种发育过程,包括造血[5]、心血管生成[6]、内胚层分化[7]、肌卫星细胞生成[8]等。最近研究表明其在肾癌[9]、肺癌[10]、乳腺癌[11]、前列腺癌[12]等作为转录因子发挥抑癌作用,并受到启动子甲基化的调控。在膀胱癌中SOX7发挥的作用具体机制仍不明确。本研究采用甲基化特异性PCR技术检测膀胱癌患者尿中SOX7基因甲基化情况,并研究去甲基化药物5-氮杂-2′脱氧胞苷(5-aza-dc)对膀胱癌细胞系的影响。
1 资料与方法
1.1数据库分析GEPIA数据库分析TCGA和GTEx项目中的9736个肿瘤和8587个正常样本的RNA测序表达数据。包含33种恶性肿瘤。用于分析寻找肿瘤组织和正常组织中差异表达的基因,本研究中选择使用TCGA数据库。Oncomine数据库收集729个基因数据集,90000多个癌症组织和正常组织的样本数据。本研究中设置的检索条件:①Analysis type:“carcinoma vs normal analysis”;②设定条件:“Under-expression”。从Oncomine数据库中筛选基因,选择SOX7基因后,设定条件为:“Gene SOX7”,余条件同前。
MethHC数据库包括18个人类癌症、6548个芯片和12 567个RNA的超过6000个样本的测序数据。在MethHC数据库中,选择“BLCA”,在“gene search”中输入“SOX7”,在“gene region”中选择“promoter”(https://methhc.mbc.nctu.edu.tw/php/index.php)。cBioPortal(http://www.cbioportal.org)整合了126个肿瘤基因组研究的数据,涵盖了28 000例标本数据,此外部分样品还包括临床预后的信息。在网站中选择“bladder cancer”,“TCGA”,“tumor sample with methylation data”,“SOX7”,在结果中选择“survival”。
1.2临床资料收集2017年1月至10月在上海市第十人民医院泌尿外科40份尿液标本。其中膀胱癌患者20例,正常对照20例。新鲜的尿液标本立即在液氮中迅速冷冻,保存于-80℃。本研究获得上海市第十人民医院伦理委员会批准(批准号:2019-k-113),患者均签署知情同意书。
1.3细胞及试剂人膀胱癌移行细胞株(T24,UMUC3,J82,5637)及人永生化尿路上皮细胞(SVHUC-1)均购自中科院上海细胞库。RPMI-1640培养基、DMEM培养基、转染试剂Lipifectin3000购自美国life technologies公司。胎牛血清购自美国Gemini公司。甲基化酶抑制剂5-氮杂-2'脱氧胞苷(5-aza-2'deoxycytidine,5-aza-dc)购自美国Sigma公司。CCK-8试剂盒购自上海翊圣生物科技有限公司。SOX7抗体购自美国R&D公司,ACTIN,GAPDH,Bcl2、Bax、Cleaved Caspase-3等凋亡相关蛋白,羊抗兔二抗,驴抗羊二抗均购自美国Abcam。
1.4方法
1.4.1患者尿液甲基化特异性PCR 取50 mL尿液,4℃、3000转/min,离心15 min,留沉淀弃上清用DNA提取。运用自动核酸提取仪采用磁珠法进行核酸提取,经裂解与亚硫酸氢盐的转化并纯化。用甲基化特异性PCR进行扩增,最后将扩增出的产物进行琼脂糖凝胶电泳,根据电泳条带的结果分析目的基因甲基化状态。甲基化引物序列:F,5'-GTTTTGGACGTCGAGTTGTC-3',R,5'-AACC-CAAACCATAAAAACGTT-3'。非甲基化引物:F,5'-GGTTTTGGATGTTGAGTTGTTG-3'R,5'-CTTAACCCAA-ACCATAAAAACATT-3'。PCR反应条件:95℃,预变性10 min,1个循环;94℃,变性,45 s,53℃(甲基化)/57℃(非甲基化),退火45 s,72℃,延伸45 s,共35个循环;72℃再延伸10 min。
1.4.2膀胱癌细胞系培养及5-aza-da处理用含有10%胎牛血清、双抗的RPMI-1640培养基进行培养及传代,在6孔板上进行铺板。细胞密度达到30%~40%,5-aza-dc组T24细胞中加入含有5-aza-dc的培养基,使其药物浓度分别为10、20 μmol/L,对照组T24细胞加入同体积的DMSO。连续处理3 d,每天更换新鲜配置的药物。
1.4.3膀胱癌细胞系转染SOX7质粒膀胱癌细胞在6孔板上铺板,当细胞密度达30%~40%,按照转染试剂Lipifectin3000说明书进行操作,转染SOX7质粒(Ubiquitin 3FLAG GFP IRES-Puromycin,购自上海吉凯基因公司)为质粒组,转染空载质粒为空载组。
1.4.4 Western blot 每孔加入60 μg蛋白样品,电泳后湿转至PVDF膜中,5%脱脂奶粉封闭60 min,4℃冰箱中孵育一抗16~20 h,TBST洗涤5次,二抗孵育60 min,显影曝光。
1.4.5 CCK8实验采用CCK-8试剂检测细胞的增殖速率。在96孔板上以每孔1000个细胞的密度接种,细胞贴壁后,用5-aza-dc连续处理5 d,每天更换新鲜配置的药物。每孔加入10 μL的CCK-8试剂,37℃培养箱孵育2 h,2 h后用酶标仪测量450 nm的吸光度。
1.4.6平板克隆实验采用平板克隆实验检测细胞的增殖活性。在6孔板上铺板,每孔细胞数量为1000个。细胞贴壁后,每天更换含有5-aza-dc药物的培养基。当培养7~10 d,6孔板中肉眼可见克隆形成时,停止培养。
1.4.7细胞凋亡实验在6孔板上铺板,当细胞密度达30%~40%时,更换含有5-aza-dc培养基,连续处理5 d,当细胞密度达90%~95%,用胰蛋白酶消化,转移至流式管中,加入400 μL的结合缓冲液混匀后,与PI和Annexin V-FITC反应后,流式细胞仪检测细胞凋亡情况。
1.5统计学分析采用SPSS 22.0软件进行统计分析,数据库中的Kaplan-Meie曲线采用Log Rank法分析,计量数据以均数±标准差(xˉ±s)表示,多组均数比较采用单因素方差分析,组间两两比较用LSD法;计数资料采用χ2检验或Fisher确切概率法,以P≤0.05为差异有统计学意义。
2 结 果
2.1 SOX7在数据库中的表达情况TCGA数据库和Oncomine数据库中可以发现SOX7在膀胱癌中的表达下调,见图1。MethHC数据库中,SOX7有1个转录本(NM_031439),其在膀胱癌组织中甲基化水平明显高于正常组织(P<0.005)。通过cBioPortal结果可得,SOX7高甲基化的患者无进展生存期较低甲基化患者明显降低(P<0.05)。见图2。
2.2 SOX7在膀胱癌患者的尿液中甲基化水平膀胱癌患者尿液中15例(75%)SOX7甲基化水平增高,而正常人尿液中仅7例(35%),差异有统计学意义(P<0.05)。
2.3 SOX7基因在不同膀胱癌细胞株中的表达Western blot结果显示,与SV-HUC-1细胞株相比,SOX7蛋白在T24、UMUC3、J82、5637细胞株中表达均显著降低(P<0.05)。见图3。实验细胞株选择T24细胞。
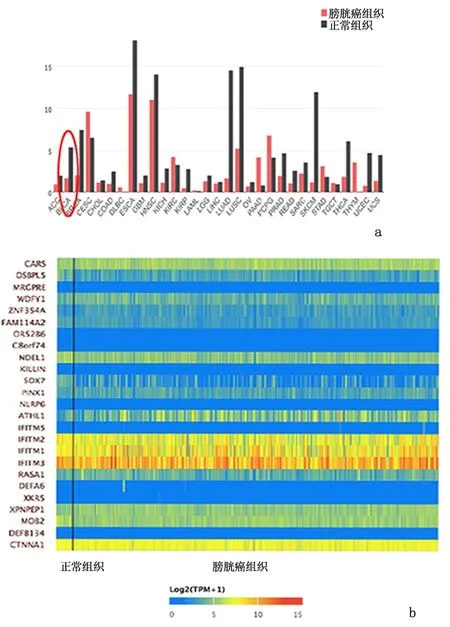
图1 SOX7基因在数据库中的表达情况Figure 1 The expression of SOX7 gene in database
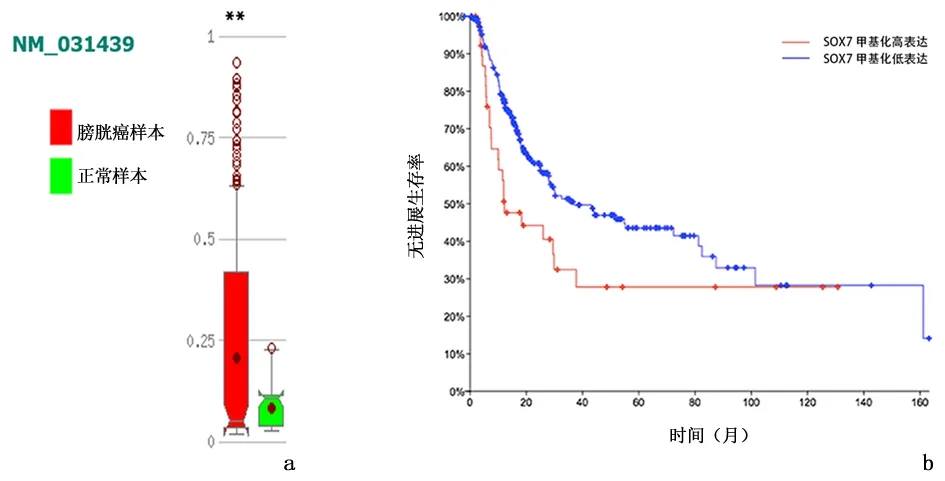
图2 数据库中膀胱癌SOX7基因甲基化及预后情况Figure 2 Methylation and prognosis of bladder cancer SOX7 gene in the database
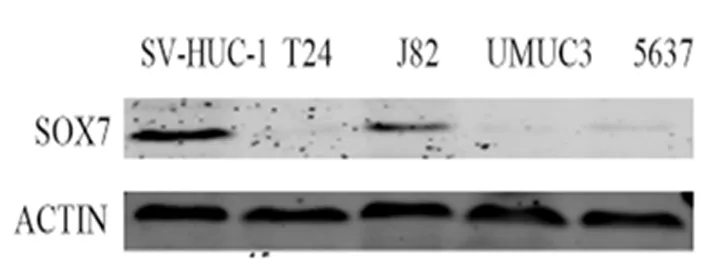
图3 SOX7基因在膀胱癌中的表达情况Figure 3 SOX7 gene expression in bladder cancer cell lines
2.4过表达SOX7质粒及5-aza-dc处理后SOX7蛋白的表达上调5-aza-dc组SOX7蛋白的表达量较对照组上调,当浓度达到20 μmol/L时,SOX7蛋白表达量相对较高。因此选择5-aza-dc的浓度为20 μmol/L为后续实验浓度。质粒组SOX7蛋白表达量较空载组上调明显,见图4。
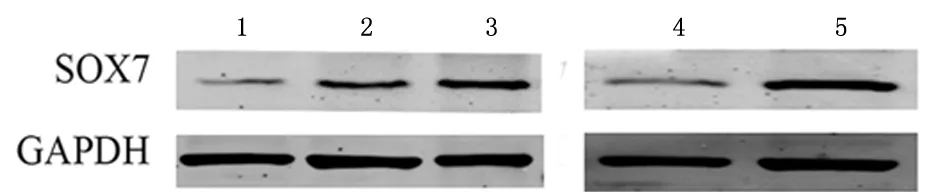
图4 5-aza-dc及转染质粒后SOX7的表达Figure 4 SOX7 expression increased after 5-aza-dc treatment and after plasmid transfection
2.5过表达SOX7质粒及5-aza-dc处理后T24细胞的增殖能力CCK-8结果显示,第5天,5-aza-dc组A值较对照组显著降低(P<0.05);质粒组A值较空载组明显降低(P<0.05)。克隆形成实验发现,5-azadc组每孔克隆形成数[(167.33±13.65)个]较对照组[(328.00±20.81)个]明显下降(P<0.05)。质粒组每孔克隆形成数[(136.00±15.00)个]较空载组[(280.67±13.43)个]明显下降(P<0.05)。见图5。

图5 5-aza-dc处理和转染质粒后T24细胞的增殖能力Figure 5 The ability of cell proliferation decreased after 5-aza-dc treatment and plasmid transfection
2.6过表达SOX7质粒及5-aza-dc处理T24细胞的凋亡流式细胞仪凋亡实验发现,5-aza-dc组T24细胞的凋亡率(27.89%)较对照组(3.79%)明显升高(P<0.05);质粒组细胞凋亡率(21.28%)较空载组(9.90%)明显增高(P<0.05)。见图6。 Western blot结果显示,与对照组比较,5-aza-dc组Bcl2蛋白表达明显下调,Bax、Cleaved Caspase-3表达上调明显。质粒组Bcl2蛋白较空载组表达明显下调,Bax、Cleaved Caspase-3表达上调明显。见图7。
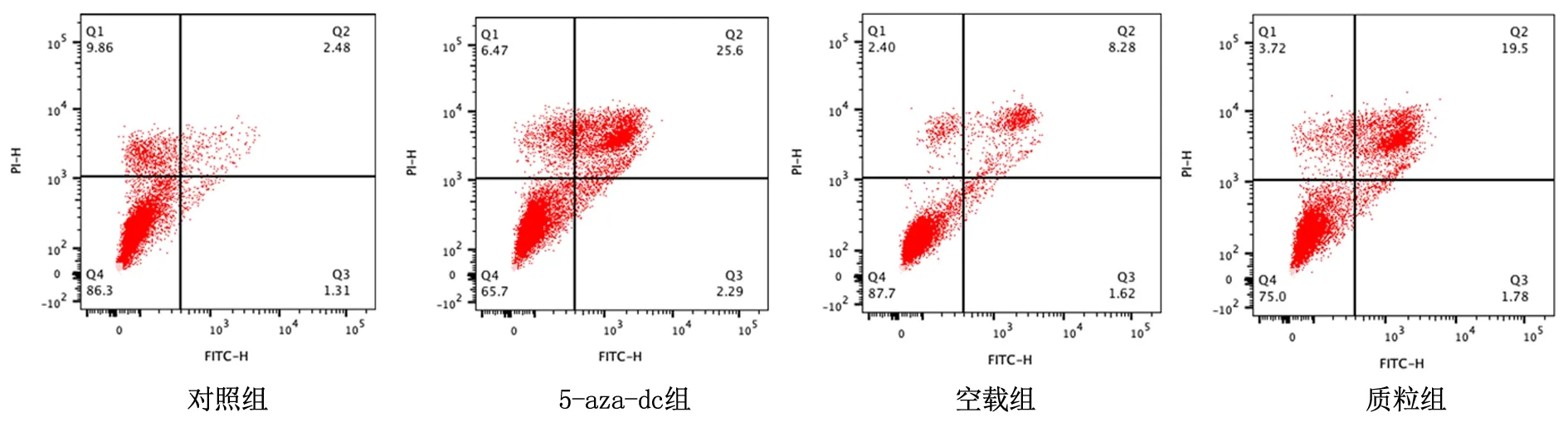
图6 5-aza-dc处理和转染质粒后细胞凋亡情况Figure 6 Apoptosis after 5-aza-dc treatment and plasmid transfection
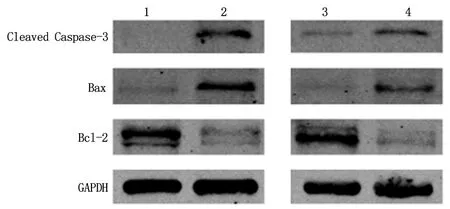
图7 5-aza-dc处理和转染质粒后凋亡蛋白表达情况Figure 7 Expression of apoptotic proteins after 5-aza-dc treatment and transfection of plasmids
3 讨 论
本研究中,通过数据库验证了膀胱癌中SOX7基因高甲基化,SOX7基因低表达,并且SOX7基因高甲基化可能影响膀胱癌的预后。而通过40例尿液检测,验证了在膀胱癌中SOX7基因甲基化水平高表达,膀胱癌细胞系蛋白Western blot检测结果表明SOX7基因在膀胱癌中低表达。Bca细胞中SOX7基因的高甲基化状态可被5-aza-dc诱导去甲基化。通过Western blot实验可以验证当5-aza-dc浓度达到20 μmol/L时,SOX7蛋白表达量显著上调,通过CCK-8实验,平板克隆实验,流式细胞仪检测细胞凋亡实验验证了SOX7基因高甲基化被逆转后,SOX7蛋白表达升高后,抑制了膀胱癌细胞的增殖,促进了膀胱癌细胞的凋亡。同时通过转染过表达SOX7质粒,进一步证明SOX7的高表达与膀胱癌细胞的增殖和凋亡相关。由此我们可以得出SOX7基因在膀胱癌中发挥重要作用,而其启动子区域高甲基化可能是其表达沉默的机制之一。
DNA甲基化是表观遗传学修饰的重要形式之一,其主要表现为富含CPG岛的启动子区域甲基化,通过启动子区域的甲基化阻碍启动子与转录因子相结合,从而阻碍基因的转录或转录水平下降[13]。研究表明,SOX7基因在多种肿瘤中的表达水平与基因的启动子甲基化水平相关。Wang等[9]报道在肾透明细胞癌中,SOX7基因的表达受其启动子甲基化水平调控,并通过Wnt/β-catenin信号通路发挥作用。Kostroma等14]报道在急性髓系白血病SOX7通过启动子甲基化与Wnt/β-catenin信号通路发生拮抗作用。Xu等15]报道SOX7甲基化对骨髓异常增生综合征的预后不良,并且与白血病的进展相关。而SOX7基因在膀胱癌中的表达及启动子甲基化情况报道较少。本研究首次通过大样本基因数据库,患者尿液标本,膀胱癌细胞系从不同角度阐述了SOX7及其甲基化状态对膀胱癌的影响。
DNA甲基化作为肿瘤的发生发展过程中非常重要的进程[16-17]。因此,基因甲基化状态可能作为一个重要的诊断标志物。膀胱作为储尿器官,通过检测尿液中基因的甲基化水平能一定程度上反应膀胱的状态。有研究通过检查尿液的一些基因的甲基化状态,如 BCL2,CDKN2A,NID2,TWIST1,GDF15,TMEFF2等,可以用于早期诊断膀胱癌,且敏感性高于尿脱落细胞学[18-20]。另有研究证实通过检测一组基因的启动子CPG岛甲基化状态,可以作为膀胱癌进展的预后的生物学标志物[21-22]。因此,SOX7启动子甲基化可能是膀胱癌的诊断和预后的潜在标志物。
细胞中存在不同状态甲基化DNA,如在TPC1细胞株中CITED1基因[23],通过改变基因启动子甲基化的程度,进而影响基因的表达,因此,在膀胱癌或癌前病变时通过去甲基化处理,很有可能对膀胱癌的治疗及预防发挥积极的作用。5-aza-dc作为一种去甲基化药物,已有用于肿瘤治疗的研究[24],在膀胱癌中是否发挥作用及其具体机制仍需进一步研究。
综上所述,本研究结果显示SOX7在膀胱癌低表达,其表达受启动子甲基化调控,是膀胱癌的潜在生物学标志,在膀胱癌的发生、发展中发挥重要作用。本研究还存在不足:样本偏少,没有患者的随访资料,另外SOX7在膀胱癌中的调控机制不明,因此需进一步的探讨SOX7在膀胱癌中的调控机制。

