甲状腺激素诱导心肌B细胞激活因子表达对小鼠心脏功能的影响
李国庆,胡 蕴,曹 欣,陆婷婷,钟 易,刘晓梅,毛晓明
0 引 言
甲状腺功能亢进症(简称“甲亢”)是各种原因引起甲状腺滤泡细胞合成和分泌超生理量的甲状腺激素(主要包括三碘甲状腺原氨酸,T3和四碘甲状腺原氨酸,T4)引起相关的高代谢临床症状。甲亢最常见的原因是Graves’病,约占甲亢的85%,甲亢在正常人群的发病率高达5%[1]。甲亢长期控制不佳会导致甲亢性心脏病,目前认为它的发生是由于过量分泌的甲状腺激素对心脏产生直接或间接毒性作用,引起心血管病理改变,如高输出性心力衰竭、扩张型心肌病等[2],它是甲亢死亡的主要原因,但对其发生机制目前尚未完全阐明。
越来越多的证据表明固有和适应性免疫系统紊乱在心血管疾病的发生过程中起重要作用[3-4]。心脏中的大多数免疫细胞是巨噬细胞,并且存在少量的肥大细胞、T淋巴细胞和B淋巴细胞[5],目前涉及心脏和血管损伤的B细胞活化证据持续增加[6]。B细胞活化因子(B cell activation factor,BAFF)是肿瘤坏死因子超家族成员之一,对B细胞的存活、分化和成熟起重要作用[7],此外它还具有抗原递呈及激活T细胞的作用[8-9]。BAFF异常表达可以介导组织的炎症反应并在多种自身免疫疾病的发病中发挥重要作用[10-11]。研究发现炎症反应在甲亢性心脏病的发生中也起重要作用[12]。为了进一步阐明BAFF及B细胞在甲亢性心脏病的作用及其机制,本实验采用腹腔注射高浓度T3的方法建立甲亢性心脏病小鼠模型,检测小鼠心肌细胞BAFF表达的变化,从而探讨其在甲亢性心脏病中的可能作用。
1 材料与方法
1.1实验材料健康清洁级C57BL/6J雌性小鼠60只,购自某院动物实验中心。随机数字表法分为对
照组和实验组。人类来源三碘甲状腺原氨酸(T3)(大连美仑生物有限公司),全蛋白提取试剂盒(南京凯基生物公司),BCA蛋白检测试剂盒(南京凯基生物公司),SDS-PAGE凝胶快速配制试剂盒(碧云天),Anti-BAFF antibody[Buffy 2](abcam)大鼠抗BAFF单克隆抗体(abcam公司),兔源TNF-α Antibody多克隆抗体(proteintech公司),兔源β-actin单克隆抗体beta-Actin(13E5)Rabbit mAb(cell signaling technologyCST公司),羊抗兔二抗Anti-rabbit IgG,HRP-linked Antibody(cell signaling technologyCST公司),羊抗大鼠IgG-HRP二抗(biosharp白鲨公司),TRIzol(美国Life公司),RNA提取试剂盒(南京凯基生物),实时荧光定量逆转录聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR)试剂盒(日本Takara公司),流式荧光标记抗体APC-anti-B220(美国BD公司),酶标仪:美国BIO-RAD公司680型,高速低温离心机:德国Eppendorf公司。
1.2实验方法
1.2.1实验动物模型的建立参照文献[13]的方法并进行改良,健康C57BL/6J小鼠60只,随机数字表法分为两组:实验组和对照组,每组30只,在实验前称重。T3溶于氢氧化钠,置于冰箱保存待用,使用前用等渗盐水稀释100倍。实验组小鼠每天腹腔注射T3 5 μg/10 g,1次/d,连续42 d,建立甲亢性心脏病小鼠模型。对照组腹腔注射等体积的等渗盐水。所有小鼠均饲大小鼠维持饲料及瓶装饮用水。
1.2.2标本收集与制作持续腹腔注射T3,42 d后成功制备甲亢性心脏病小鼠模型,小鼠使用水合氯醛麻醉后开胸心脏抽取血,使用PBS溶液冲洗切取的心脏并称重。每只小鼠的心脏切成3份,分别置于4%多聚甲醛固定、-80℃冰箱及液氮中保存。4%多聚甲醛固定的心肌组织脱水浸蜡包埋后制成石蜡切片,用于HE染色和免疫组织化学染色,冷冻保存的心肌组织用于蛋白质印迹法检测蛋白,液氮保存的心肌组织用于Real-Time PCR检测mRNA。
1.2.3血清T3、T4和BAFF浓度的检测心脏取血分离血清,采用放射免疫分析法检测小鼠血清中T3和T4的浓度,ELISA法测定血清中BAFF浓度,严格按照实验说明书进行操作。
1.2.4小鼠心脏指数检测腹腔注射T3第1天,称取各组小鼠体重;实验结束第42天,称取各组小鼠体重和心脏重量。计算小鼠心脏指数,公式如下:
心脏指数(mg/g)=心脏重量/体重[14]
1.2.5心肌细胞横径测定常规心肌石蜡切片脱蜡,使用HE染色后,在200倍光镜下观察心肌细胞大小形态变化,选择具有清晰边界的心肌细胞,并通过细胞核水平测量最短的横向直径。每张切片随机选择3个视野,每个视野随机选择10个心肌细胞,取平均值作为该小鼠的心肌细胞横径。
1.2.6 Western blot检测取心脏标本,用剪刀尽量将其剪碎,将组织块置于匀浆器球状部位,用RIPA裂解液将组织反复碾磨,匀浆提取蛋白,用BCA法定量。向样品中加入5×蛋白上样缓冲液,在沸水中于100℃煮沸10 min,将标本收集放置-20℃冰箱保存备用。制备12%聚丙烯酰胺分离胶(SDS-PAGE),进行电泳约90 min,然后将电泳后的蛋白质转移到硝酸纤维素膜(PVDF)(恒压115 V,90 min),5%脱脂奶粉室温封闭120 min,加入Anti-BAFF抗体、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)抗体及标准蛋白β-actin抗体(1∶1000稀释),在4℃冰箱中摇床过夜。磷酸盐缓冲液(PBST)洗涤3次,然后分别加入羊抗大鼠IgGHRP和羊抗兔IgG-HRP(1∶2000稀释),室温孵育120 min,PBST洗涤3次,ECL显色。将PVDF膜上的蛋白信号条带利用image J软件进行灰度扫描,计算其灰度值,结果以目的蛋白与β-actin的灰度值的比值表示,计算两组资料的灰度值进行分析。
1.2.7免疫组化法检测石蜡切片常规脱蜡至水,室温下用3%H2O2孵育,加入抗BAFF抗体室温孵育,然后加入相应二抗孵育,使用DAB显色剂显色,苏木精复染,脱水,晾干后加入适量中性树胶封固,光镜下观察。BAFF阳性细胞显示细胞质出现棕黄色。使用病理图像分析系统,在100倍光学显微镜下,每个切片随机选择5个视野,并计算积分吸光度(IA)作为BAFF的阳性表达水平。
1.2.8 RT-PCR检测通过常规Trizol法提取总RNA,RNA沉淀用去离子水稀释100倍,用分光光度计进行定性和定量分析。根据制造商的说明,使用PrimeScriptTM RT逆转录试剂盒(TaKaRa),进行两步逆转录聚合酶链反应,以合成cDNA,再进行PCR扩增测定。PCR反应体系:SYBR®Premix Ex TaqTMII(2×)10 μL,cDNA 1 μL,上、下游引物各0.4 μL,ROX Reference Dye II(50×)0.4 μL,灭菌双蒸水7.8 μL。循环参数为:95℃预变性30 s,进入PCR循环为95℃变性5 s,60 ℃退火/延伸34 s,循环40次。使用β-actin作为内参,BAFF和β-actin引物序列如下:Mouse β -actin F:5′-ATCTGCTGGAAGGTGGACAGCGA-3′,R:5′-CCCAGCACAATGAAGATCAAGATCAT-3′;Mouse BAFF F:5′-CCACCGTGCCTCTGTTTTTG-3′,R:5′-CTTCTGCGGAGTGATGGGAT-3′。
1.2.9细胞分离和流式细胞术用PBS冲去心脏组织表面的外周血,用眼科剪将组织剪成碎片,直至呈匀浆状,将组织碎片移入15 mL离心管中,加适量DHanks液,用滴管充分吹打组织碎片,将细胞悬液经200目细胞筛网过滤,使用1640培养基冲洗细胞筛网,将过滤所得的液体移入离心管。室温下,250×g,离心10 min,弃上清液。用稀释液重悬细胞并小心的加到淋巴细胞分离液上方,450×g,离心20 min,轻轻吸出第二层呈絮状的淋巴细胞,加入含有5mL清洗液的离心管中,充分混匀;250×g,离心10 min,弃上清后,获得单个核细胞。取50 μL混匀的单个核细胞悬液,加入荧光标记抗体APC-anti-B220标记细胞,使用BD canton-Ⅱ流式细胞仪收集样品,使用Flowjo进行数据分析。所有流式细胞术分析均采用散点图和7-AAD染色法进行死细胞排除。
1.3统计学分析采用SPSS 23.0软件进行统计分析。计量资料用均数±标准差(xˉ±s)表示,组间比较使用独立样本t检验,计数资料组间比较使用χ2检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1各组小鼠T3、T4和BAFF的变化与对照组相比,实验组小鼠血清T3浓度、心脏指数、BAFF、心肌细胞横径明显增加(P<0.05),T4浓度降低(P<0.05)。见表1。光镜下可见,对照组小鼠心肌细胞结构正常,实验组小鼠心肌细胞明显肥大、结构紊乱,见图1。
2.2 Western blot检测与对照组BAFF蛋白表达(0.765±0.164)相比,实验组(1.865±0.290)明显升高(P<0.05);与对照组TNF-α蛋白表达(0.537±0.089)相比,实验组(0.737±0.065)明显升高(P<0.05),见图2。

表1 各组小鼠血清相关指标和体重及心脏指数的比较(xˉ±s)Table 1 Comparison of serum T3,T4,BAFF,body weight and cardiacindex in each group(xˉ± s)
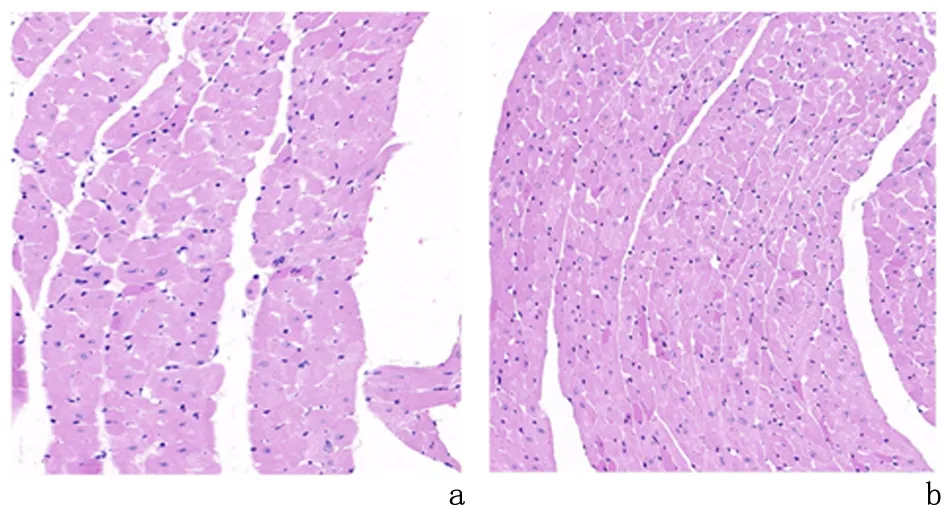
图1 镜下观察各组小鼠心肌细胞形态(HE×200)Figure 1 HE staining of cardiomyocytes in each group(HE ×200)

图2 Western blot检测各组小鼠心肌细胞BAFF、TNF-α蛋白表达Figure 2 Expression of BAFF and TNF-α protein in mouse cardiomyocytes in each group by Western blot
2.3免疫组化检测与对照组小鼠心肌细胞BAFF蛋白表达[(17.82±4.82)%]相比,实验组[(38.99±6.58)%]明显增高(P<0.05),免疫组化法可见实验组较对照组小鼠心肌细胞胞质染色面积增加、颜色加深,见图3。
2.4 RT-PCR检测BAFF的mRNA表达实验组小鼠心肌细胞BAFF的mRNA表达(1.781±0.134)较对照组(1.010±0.118)增加(P<0.05)。
2.5 T3与心肌细胞BAFF基因表达和外周血BAFF水平的相关性分析T3与心肌细胞BAFF基因表达水平呈正相关,相关系数为0.637(P<0.01),T3与外周血BAFF水平呈正相关,相关系数为0.778(P<0.01),见图4。
2.6流式细胞术检测心肌B细胞的比例通过流式细胞术检测发现,与对照组[(12.40±1.09)%]相比,实验组[(16.12±0.63)%]小鼠心肌B细胞的比例显著增加(P<0.05),见图5。
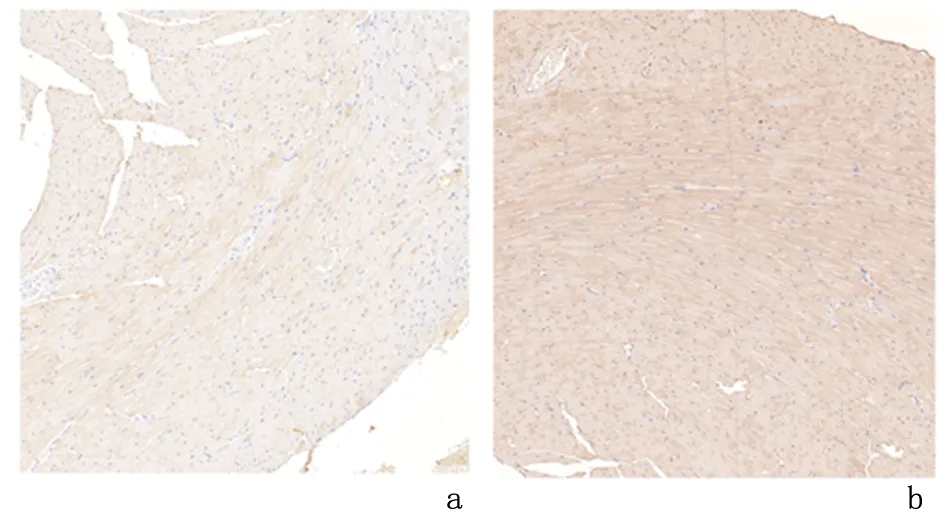
图3 镜下观察小鼠心肌细胞BAFF蛋白表达(免疫组化染色 ×200)Figure 3 Expression of BAFF protein in mouse cardiomyocytes in each group by immunohistochemical(IHC ×200)
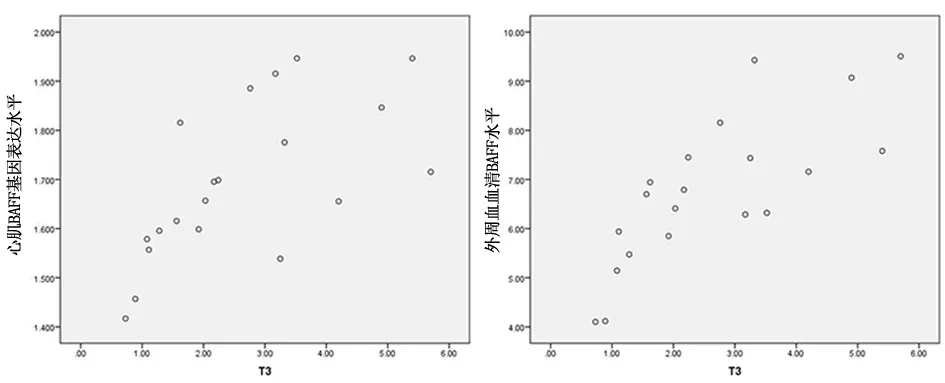
图4 T3与心肌细胞BAFF基因表达和外周血BAFF水平的相关性分析Figure 4 Correlation analysis of T3 with BAFF gene expression in cardiomyocytes and BAFF level in peripheral blood
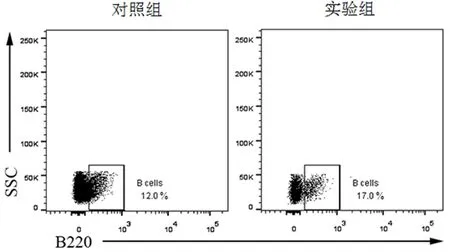
图5 流式细胞术检测心肌B细胞的比例Figure 5 The percentage of B cells in myocardium was determined by flow cytometry
3 讨 论
甲亢是由甲状腺激素过量分泌所导致的,临床上最常见的甲亢病因包括弥漫性毒性甲状腺肿、甲状腺高功能结节、腺瘤和甲状腺炎的初期,甲亢性心脏病是其严重的并发症之一[15]。甲状腺主要产生两种活性激素T4和T3,其中T4是其主要的储存形式[16]。T4通过脱碘酶脱碘,转化为生物活性更强的T3,T3的生物活性是T4的3至4倍。值得注意的是,心肌细胞中没有明显的脱碘酶,因此心脏主要依赖于血液循环输送T3到心肌细胞[17],这也是我们对小鼠腹腔注射T3的原因之一。T3可以通过基因或者非基因效应对心肌细胞发挥作用[18-19]。除了甲状腺产生甲状腺激素外,也可通过摄入外源性甲状腺激素导致T3、T4水平升高,例如甲状腺功能减退症患者服用过量的优甲乐;心律失常患者,长期服用胺碘酮等[20-21]。本实验通过向小鼠腹腔注射高浓度T3,发现小鼠外周血T3水平显著升高,体重下降等类似甲亢的临床表现,光镜下观察到心肌细胞横径明显增大,排列紊乱,表明小鼠心肌肥大,心脏指数增加等,证实已成功建立了甲亢性心脏病小鼠模型。
BAFF是TNF家族中的一员,被认为是B细胞发育和分化的必需细胞因子[9]。通过与B细胞膜上的BAFF受体结合,BAFF刺激B细胞成熟和增殖并延长存活时间。本实验通过Western blot、免疫组化及RT-PCR对小鼠心肌细胞BAFF表达检测发现,与对照组相比,T3能明显增加小鼠心肌细胞BAFF的表达,同时高浓度的T3刺激后,心脏中B淋巴细胞比例增加,因此BAFF在心肌B细胞的增殖中可能发挥着重要的作用。研究发现,BAFF水平下降会导致B细胞的缺乏,而在循环系统中加入BAFF,有助于B细胞增殖和血清抗体水平的增加[22-23]。B细胞除了分泌自身抗体外,还能分泌IL-6、TNF-α等细胞因子,在扩张型心肌病中,B细胞通过分泌TNF-α导致心肌功能障碍[24]。有文献报道BAFF受体缺陷的小鼠和通过抗BAFF抗体耗竭B细胞的小鼠模型中,小鼠心脏梗死面积减小,纤维化面积缩小,心室功能增强,IL-1β、TNF-α、IL-18细胞因子下调[25-26]。这与我们的实验结果一致,即小鼠接受腹腔注射T3后,心脏BAFF水平升高,导致B淋巴细胞增多,从而导致炎症因子TNF-α分泌增加,炎症反应增加,同时我们发现T3分别与心肌细胞BAFF基因表达和外周血BAFF水平成正相关,由此我们推测T3可能通过BAFF途径促进了甲亢性心脏病的发生。此外,研究发现存在于主动脉外膜的不同B细胞亚群激活与动脉粥样硬化明显相关,B2细胞亚群的耗竭能显著减少动脉粥样硬化的发生[26-27]。B细胞具有识别和应答抗原的作用,这些抗原包括外来抗原和自身抗原,它的自我抗原耐受能力是在骨髓和脾的成熟过程中获得的,然而在某些情况下,这种自我耐受机制可能通过分子模拟触发的免疫交叉反应而失效,特别发生在心肌炎和扩张型心肌病患者中[28-29]。这些证据都表明B细胞的活化,在心脏疾病中扮演着重要的角色,然而B细胞迁移到受损心脏组织的机制仍然存在许多争议[12,30]。
甲亢性心脏病是由甲状腺素分泌过多,多种因素相互作用的结果,近几年,随着分子生物学研究的进展,更加深了人们对甲亢性心脏病发病机制的认识[31]。本实验观察到高浓度的T3刺激小鼠心脏,心脏BAFF的表达明显增高,B淋巴细胞比例升高,炎症反应增加,说明BAFF可能在甲亢性心脏病中发挥一定的作用。因此干预BAFF介导的B细胞活化途径也许能成为甲亢性心脏病的一种辅助治疗方法。

