金黄色葡萄球菌PV杀白细胞素S组分体外诱导单核白血病细胞株THP-1巨噬细胞的研究
强雅雯,马筱玲,周 馨
0 引 言
金黄色葡萄球菌PV杀白细胞毒素(panton valentine leukocidin,PVL)是金黄色葡萄球菌分泌的毒素,由 S组分(panton valentine leukocidin-S,lukSPV)和 F组分(panton valentine leukocidin-F,lukFPV)组成。前期研究发现lukS-PV能够抑制髓系白血病细胞株(THP-1,HL-60)增殖,引起周期阻滞,活化线粒体通路促进其凋亡[1]。
巨噬细胞在不同微环境中可分别被诱导分化成经典途径活化的巨噬细胞(M1)和旁路途经活化的巨噬细胞(M2)2种亚型。M1能吞噬并清除外源性异物和坏死细胞,促进炎症反应的发生并可抑制肿瘤的生长;M2通过释放分泌TGF-β、IL-10等细胞因子,抑制炎症反应的发生,促进创伤修复,也可促进肿瘤的生长[2]。由于巨噬细胞表现出高度可塑性,炎症与肿瘤局部M1和M2亚型平衡的改变可能与多种疾病的发生及转归有关[3]。近年来,关于巨噬细胞极化的研究越来越多,如氯喹、贝壳杉烷型二萜类化合物PV006、索拉非尼等[4-6]均能诱导巨噬细胞向M1或M2型极化。但是关于lukS-PV体外诱导人源THP-1巨噬细胞研究较少。本研究旨在探讨LukS-PV能否体外诱导人源THP-1巨噬细胞的极化。
1 材料与方法
1.1材料单核白血病细胞株THP-1购自上海富衡细胞库;主要试剂和仪器:大肠杆菌BL21(DE3)重组表达载体pET28a-LukS-PV由本课题组构建,保存于-80℃冰箱;佛波酯购自美国Sigma-Aldrich公司;1640高糖细胞培养液购自美国Gibco公司;胎牛血清购自美国Hyclone公司;流式抗体FITC anti-humenCD11b、PE anti-humenCD14、PE anti-humenCD80、PE-Cy-7 anti-humenCD260来自美国BD公司;Prime Script反转录试剂盒与SYBR实时荧光定量PCR预混液均购自日本Takara公司;IL-12上下游引物(CTTGTGGCTACCCTGGTCCT,GAGTTTGTCTGGCCTTCTGG)、TNF-α上下游引物(GAGGCCAAGCCCTGGTATG,CGGGCCGATTGATCTCAGC)及 TGF-β上下游引物(CTGGATACCAACTACTGCTTCAG,TTGGTTGTAGAGGGCAAGGACCT)由上海生工合成;倒置显微镜购自日本olympus公司;罗氏480荧光定量PCR仪;流式细胞仪购自美国BD公司;多功能酶标仪购自美国Thermo Fisher Scientific公司。
1.2方法
1.2.1细胞培养用含10%胎牛血清和1%青链霉素的1640高糖培养基,在37oC,5%CO2培养箱中培养人白血病细胞株THP-1。在细胞长至80%时,4℃、1000转/min离心5 min,离心半径243 mm,弃上清进行传代,或通过半换液的方式对细胞进行传代。
1.2.2 THP-1巨噬细胞的诱导取生长良好的对数期THP-1细胞,4℃、1000转/min离心5 min,离心半径243 mm,弃上清,新鲜培养基重悬细胞并显微镜计数调整细胞数为1×106个/mL铺于6孔板内,同时加入终浓度为100 ng/mL的佛波酯继续培养72 h为THP-1巨噬细胞。
1.2.3 THP-1巨噬细胞的检测将THP-1和佛波酯刺激的THP-1细胞用不含EDTA的胰蛋白酶进行消化,4℃、1000转/min离心5 min,离心半径243 mm,弃上清,PBS洗2遍,分别加入0.5 μL FITC标记的CD11b和PE标记的CD14抗体,4℃避光孵育30 min,再用PBS洗1遍,并于1h内流式上机检测各组CD11b、CD14的表达。显微镜观察佛波酯刺激THP-1细胞后细胞形态学变化。
1.2.4重组LukS-PV的合成、纯化与定量从金黄色葡萄球菌分离株中扩增出LukS-PV序列。聚合酶链反应(PCR)产物经XhoI和BamHI(Promega,Madison,WI)双酶切后连接到pET28a载体(Roche Diag-nostics Corp,Basel,swiss)中,构建 6 X his标签的LukS-PV蛋白。重组LukS-PV用His-Bind纯化试剂盒(Millipore,Billerica,MA,USA),根据说明书的指示进行提取与纯化。采用BCA法检测蛋白浓度。
1.2.5流式细胞术检测细胞表面标志物分别用0.1、0.2、0.4 μmol/L 的LukS-PV作用THP-1巨噬细胞,分为0.1 μmol/LLukS-PV组、0.2 μmol/LLukS-PV组、0.4 μmol/LLukS-PV组,另采用佛波酯诱导THP-1巨噬细胞为对照组。用不含EDTA的胰蛋白酶进行消化,4 ℃、1000转/min,离心5 min,弃上清,PBS洗2遍,分别加入5 μL PE标记的CD80、PE-Cy-7标记的CD206抗体,4℃避光孵育30 min,再用PBS洗一遍,并于1 h内流式上机检测LukS-PV作用THP-1巨噬细胞24 h、48 h时CD80、CD206的表达。
1.2.6 qRT-PCR检测细胞相关炎性因子的表达
LukS-PV作用THP-1巨噬细胞后,qRT-PCR检测各组细胞IL-12、TNF-α、TGF-β的mRNA表达水平:按照Trizol说明书提取各组总RNA,再根据Prime Script反转录试剂说明书逆转录成cDNA,目的基因的mRNA水平通过实时荧光定量PCR测定。PCR扩增体系为SYRB®Select Master Mix预混液10 μL,c DNA 2 μL,上、下游引物各0.4 μL,无核酶水7.2 μL,总体系 20 μL。以 GAPDH作为内参照,采用 2-ΔΔCt法计算,对特异性扩增目的基因进行相对定量。
1.3统计学分析采用Flow Jo和Graphpad5软件进行数据分析。实验结果以平均数±标准差(xˉ±s)表示,组间均值比较采用t检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 THP-1分化为巨噬细胞的鉴定THP-1经佛波酯刺激48 h后,细胞表面CD11b和CD14表达量(29.02±3.14、32.46±5.36)较THP-1(2.04±0.49、2.43±0.68)增高(P<0.01);经佛波酯刺激72 h后,细胞表面CD11b和CD14表达量(79.61±3.46、72.27±4.49)较THP-1明显增高(P<0.001)。结果表明佛波酯刺激THP-1细胞向巨噬细胞分化。
2.2不同浓度LukS-PV作用THP-1巨噬细胞后表面标志物的改变0.1 μmol/L LukS-PV组、0.2 μmol/L LukS-PV组、0.4 μmol/L LukS-PV组细胞表面CD80表达量较对照组增高,且以0.2 μmol/L LukS-PV组表达量最高(P<0.01);而细胞CD206的表达差异无统计学意义(P>0.05)。故选取0.2 μmol/L LukS-PV组进行后续实验。见图1、图2。
2.3 LukS-PV作用THP-1巨噬细胞后细胞形态的改变THP-1巨噬细胞经LukS-PV作用24 h、48 h后,镜下观察细胞贴壁明显,细胞由原来圆形和椭圆形逐渐向长梭形转变并可见伪足。见图3。
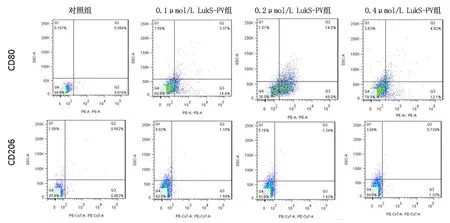
图1 流式细胞术检测不同浓度LukS-PV作用THP-1-巨噬细胞后细胞表面CD80、CD206表达情况Figure 1 The expressions of CD80 and CD206 on cells surface by Flow Cytometry after THP-1-Mφ treated with different concentrations of LukS-PV
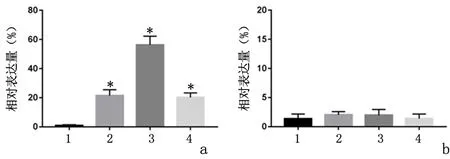
图2 不同处理组CD80、CD206的表达Figure 2 The difference of CD80 and CD206 expression in different treatment groups was compared statistically
2.4 LukS-PV作用THP-1巨噬细胞后相关炎性因子的检测qRT-PCR检测结果显示,0.2 μmol/L LukS-PV组24、48 h IL-12、TNF-α mRNA表达水平较对照组明显增高(P<0.01)。见表1。
2.5 LukS-PV作用THP-1巨噬细胞不同时间细胞表面标志物的改变0.2 μmol/L LukS-PV组24 h、48 h细胞表面CD80的表达(61.03±2.83,67.07±2.73)较对照组(1.58±0.36)明显增高(P<0.000);而CD206的表达差异无统计学意义(P>0.05)。结果表明LukS-PV可诱导THP-1型巨噬细胞向M1型极化。见图4。
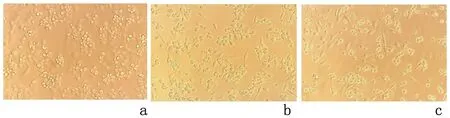
图3 倒置显微镜观察LukS-PV作用THP-1-Mφ后细胞形态的改变(×200)Figure 3 The cell transformed from circle to spindle by inverted microscope after THP-1-Mφ treated with LukS-PV(×200)
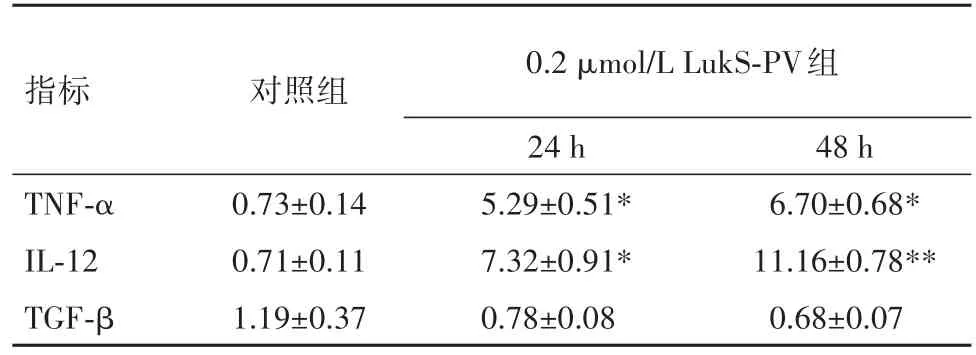
表1 各组相关炎性因子mRNA的相对表达(xˉ±s)Table 1 The mRNA expression of relative inflammatory factors in each group(xˉ±s)
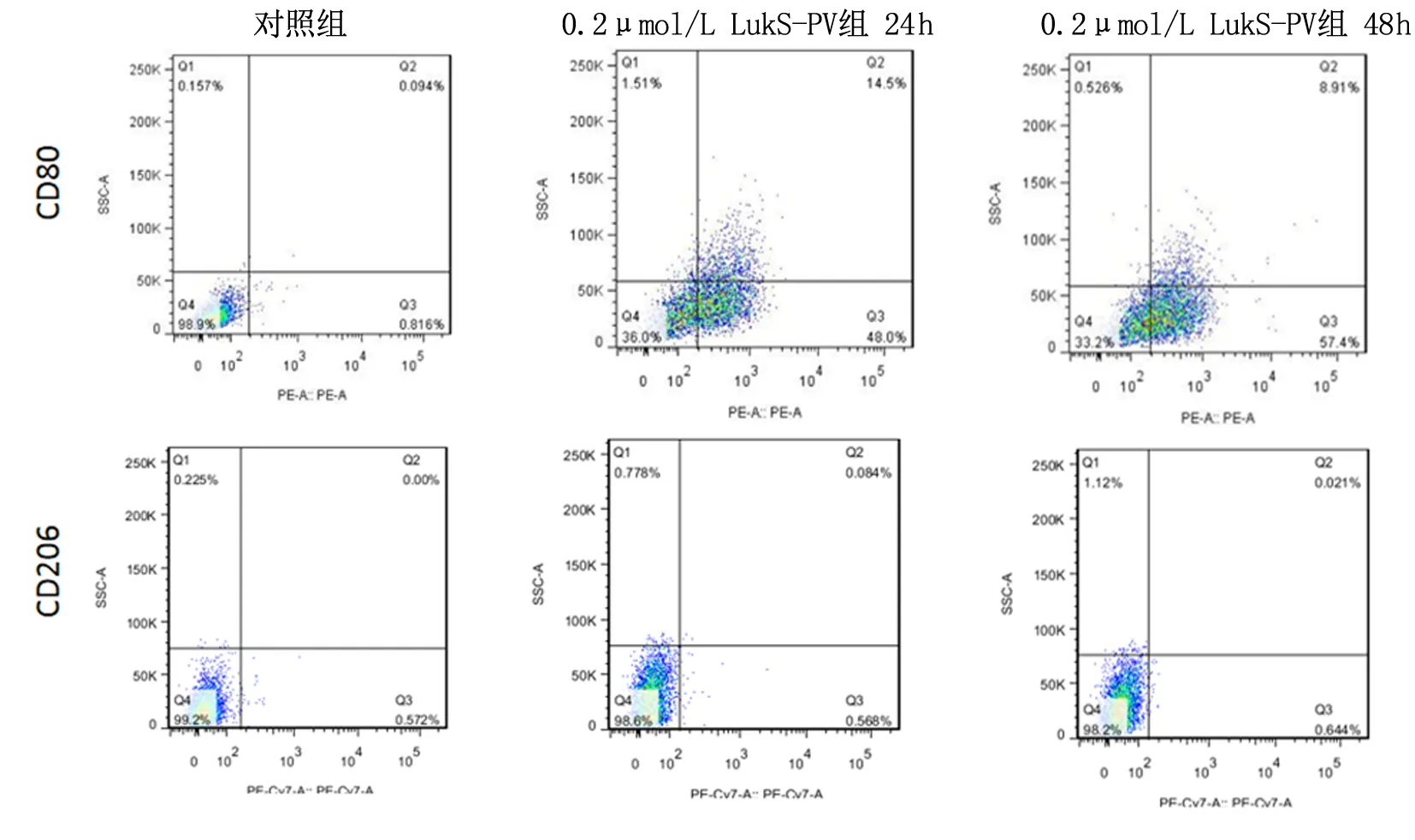
图4 流式细胞术检测LukS-PV作用THP巨噬细胞不同时间,细胞表面相关标志物的变化Figure 4 The changes of cell surface relative markers in THP-1-M φ treated with LukS-PV at different times by Flow Cytometry
3 讨 论
巨噬细胞是一种具有可塑性和多功能的固有免疫细胞,巨噬细胞M1及M2在一定条件下2种巨噬细胞亚型之间是可以相互转化的[7]。巨噬细胞在γ干扰素(interferon-γ,INF-γ)、脂多糖(lipopolysaccharide,LPS)、TOLL 样受体(TOLL-like receptor,TLR)激动剂等刺激下向M1型巨噬细胞极化;在TH2细胞因子IL-4或IL-13等条件下向M2型巨噬细胞极化[8]。2种不同亚型的巨噬细胞通过分泌不同的细胞因子从而发挥不同的功能,M1型巨噬细胞主要分泌IL-1、IL-12、TNF-α等多种促炎因子促进机体炎症反应加剧组织损伤,并抑制肿瘤的生长;而M2型巨噬细胞以分泌IL-10,IL-4及TGF-β等因子清除机体降解产物,促进组织血管生成及重塑,发挥抗炎及促肿瘤活性[9]。
佛波酯诱导THP-1细胞是体外构建THP-1巨噬细胞最常用的方法,通常体外诱导2-5d细胞贴壁,通过检测巨噬细胞表面标志物CD14、CD11b、CD68加以鉴定。当巨噬细胞进一步分化为M1或M2型后,细胞突起明显,吞噬能力增高,并可通过检测M1表面标志物CD80、CD86及M2表面标志物CD206、CD163等加以鉴定[10]。
PVL对髓系细胞具有较高的亲和力和特异的细胞毒作用,而对淋巴细胞、红细胞和其他细胞无细胞毒性。PVL能够激活NLRP3炎性小体,诱导吞噬细胞的炎症反应,发挥抗感染甚至抗肿瘤作用[11];也能通过调控多形核细胞的基因表达,增强宿主先天免疫反应[12]。lukS-PV为金葡菌杀白细胞素亚组分之一,本研究前期建立免疫缺陷的急性髓系白血病小鼠模型,证明LukS-PV在体内外对急性髓系白血病均有较强的抑制作用,且无明显毒副作用[13-14]。
本研究经佛波酯体外诱导THP-1为巨噬细胞后加入不同浓度LukS-PV诱导不同时间,细胞形态由圆形或椭圆形逐渐向长梭形转变、qRT-PCR检测M1相关炎性因子IL-12、TNF-α的表达增高,以及流式细胞术检测结果显示细胞M1表面标志物CD80表达明显增高而M2标志物CD206几乎无表达,这与巨噬细胞向 M1 极化的各种表型相符[5,9,10],说明LukS-PV能够诱导人源THP-1巨噬细胞向M1极化。并为LukS-PV发挥的抗肿瘤作用提供实验依据及进一步研究打下基础。影响巨噬细胞极化的转录因子和信号通路有很多,如AKT/mTOR/STATs和 TLR4 等信号通路[15-16]。
综上所述,本研究结果说明LukS-PV能够刺激人源THP-1巨噬细胞向M1极化。本研究不足之处:LukS-PV诱导THP-1-巨噬细胞向M1极化的具体机制,以及如何发挥抗肿瘤作用等问题需要我们进一步研究与探讨。

