不同时期回植孕酮对小鼠月经发生过程中内质网应激信号的调节机制
于明明,谢 卓,金 华,王乾兴
0 引 言
月经周期的规律与否对女性的生殖健康影响很大[1]。在妇科临床上,某些特殊情况下(如参加高考、体育比赛等)需要对月经周期进行人工调节[2]。黄体酮作为参与女性内分泌的孕激素,对调整月经周期起着重要作用。孕酮虽然可以推迟月经发生,但具有一定时效性,即月经发生中存在一个可为孕酮调控的关键生理时期,作用机制知之甚少,利用动物模型来进行月经发生机制的解析显得很有必要。作为生物医学常用的模式动物,小鼠也可人工诱导出月经样变化,本课题组前期研究发现,小鼠月经发生也存在一个可为孕酮回植逆转的关键时期,即为孕酮撤退后12~16 h,在孕酮撤退后12 h回植孕酮可以逆转月经的发生,而16 h回植则无法阻止子宫内膜的崩解[3]。但具体机制尚不明确。
研究表明,人月经期中内质网应激(endoplasmic reticulum stress,ERS)相关蛋白真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)及转录激活因子4(activating transcriptionfactor 4,ATF4)和内质网特异性凋亡信号C/EBP同源蛋白(C/EBP-homologous protein,CHOP)表达增加,且可被孕酮拮抗剂米非司酮所逆转[4-8]。提示内质网应激所致的eIF2α相关信号可能在月经发生和孕酮对其的调控中发挥了关键作用。为探索体内情况下孕酮是如何调控上述信号表达的,本研究利用生理性孕酮撤退的小鼠月经模型进行孕酮回植实验,全面探索小鼠月经发生的关键时期前后回植孕酮对小鼠月经发生过程中ERS所致的自噬关键信号通路成员表达的调控情况,为解析月经发生机制及临床月经调控的时机选择提供理论支持。
1 材料与方法
1.1实验动物与试剂SPF级8~10周龄雌性健康C57BL/6J小鼠,购自斯贝福(北京)生物技术有限公司,实验动物许可证号:SCXK(京)2016-002,光照周期12 h,自由进食和摄水,(21±1)℃控温。动物实验获得遵义医科大学伦理委员会批准。雌二醇和孕酮分别购自英国Alfa Aesar公司和美国Sigma公司;兔抗PERK、CHOP、鼠抗ATF4多抗和鼠抗GADPH单抗购自武汉三鹰生物技术有限公司;兔抗p-PERK、p-eIF2α、eIF2α、Caspase12多抗购自北京博奥森生物技术有限公司;IgG二抗购自北京中杉金桥生物技术开发公司;所有引物均由上海生工生物工程技术有限公司合成,序列分别为:PERK(F:GAGATCTGGCTCAAAGACGAAA;R:AAGGAGCTATGACTTCGATCTG)、eIF2α(F:GTCTCAGACCCATCTATCTTGG;R:CATACCTGGGTGGAGCTATTAG)、ATF4(F:GACCGAGATGAGCTTCCTGAACAG;R:CCGCCTTGTCGCTGGAGAACCACC)、CHOP (F:CTCCAGATTCCAGTCAGAGTTC; R: ACTCTGTTTCCGTTTCCTAGTT) 、 Caspase12 (F: TGGCCCATGAATCACATCTAAT; R: TGGACAAAGCTTCAGTGTATCT)、GAPDH (F:TGGTGAAGACGCCAGTGGA;R:GCACCGTCAAGGCTGAGAAC);RNAiso Plus、real-time PCR试剂盒均购自日本TAKARA公司。
1.2模型建立及孕酮回植参考本课题组前期工作进行[1]。将30只C57BL/6J雌鼠在乙醚麻醉下行双侧卵巢去除术。小鼠术后恢复1周以清除体内雌孕激素。连续3 d在09:30皮下注射雌二醇100 ng,第7天皮下注射50 ng孕酮同时埋置孕酮皮埋管(1 g/mL孕酮花生油悬浊液填充硅胶管,两端用乳胶封闭,使其功能长度为1 cm),并在7~9 d 09:30皮下注射雌二醇5 ng。在第9天11:00,乙醚麻醉下将20 μL花生油注入小鼠的子宫腔中以诱导小鼠子宫内膜蜕膜化,49 h后移除孕酮皮埋管,记为孕酮撤退后0 h。将小鼠随机数字表法分为12 h回植组、16 h回植组和未回植组,每组10只,分别在孕酮撤退后12 h(12 h回植组)和16 h(16 h回植组)回植孕酮皮埋管,未回植组则不进行回植,各组小鼠均在孕酮撤退后24 h处死,收集双侧子宫角,等渗盐水冲洗后液氮速冻或中性甲醛固定待用。
1.3 qPCR检测RNAiso Plus试剂盒提取小鼠全子宫总RNA,紫外分光光度计测定总RNA浓度后取2 μg总RNA逆转录合成cDNA,20 μL体系进行PCR反应。反应条件为:95℃预变性30 s、95℃变性5 s、60℃退火30 s,共40个循环。以GAPDH为内参,以2-△△Ct表示目的基因相对表达量。
1.4 Western blot检测取小鼠全子宫100 mg,加入1 mL混合液(按100份组织裂解液、1份PMSF、1份蛋白酶抑制剂、1份蛋白磷酸酶抑制剂配制)裂解组织提取总蛋白,BCA法测定蛋白浓度。取40 μg蛋白上样,80 V恒压电泳,300 mA恒流转膜,脱脂奶粉封闭,一抗4℃孵育过夜(浓度:t-PERK、p-PERK、t-eIF2α 为 1:1000;p-eIF2α、ATF4 为1:1500;CHOP为1:800;Caspase12为1:2000;GAPDH 为1:5000)。洗膜后二抗常温孵育2 h,ECL发光,Image Pro Plus软件进行条带分析。
1.5免疫组化法检测小鼠全子宫经10%中性甲醛过夜,石蜡包埋后3 μm层厚连续切片,常规脱蜡、水化后高压法修复抗原,一抗(p-PERK、ATF4、Caspase12浓度为1∶100;p-eIF2α浓度为1∶150;CHOP浓度为1∶50)4℃过夜。PBS洗片后,二抗37℃孵育30 min。DAB显色后用苏木精复染细胞核,梯度乙醇脱水后二甲苯透明,中性树胶封固后光镜下观察。
1.6统计学分析采用GraphPad Prime6.0软件进行统计分析,定量资料以均数±标准差(xˉ±s)表示。组间两两比较采用两独立样本t检验,多组数据比较采用单因素方差分析,以P≤0.05表示差异有统计学意义。
2 结 果
2.1小鼠子宫组织中PERK、eIF2α、ATF4的表达16 h回植组和未回植组PERK、eIF2α和ATF4 mRNA表达均明显低于12 h回植组(P<0.05),且未回植组明显低于16 h回植组(P<0.05)。各组总PERK(t-PERK)和总eIF2α(t-eIF2α)蛋白表达强度相似;但12 h回植组磷酸化形式(p-PERK、p-eIF2α蛋白)明显高于16 h回植组和未回植组(P<0.05)。见表1、表2,图1。p-PERK、p-eIF2α和ATF4 蛋白均表达于子宫内膜基底层与蜕膜化基质细胞交界处基质细胞细胞质。其中16 h回植组染色强度弱于12 h回植组,主要见于蜕膜化的基质细胞;未回植组则仅在基质细胞中呈散在的弱阳性染色。见图2。
2.2小鼠子宫组织中CHOP和Caspase12的表达与12 h回植组相比,16 h回植组和未回植组CHOP、Caspase12 mRNA和蛋白表达明显升高(P<0.05),且未回植组高于16 h回植组(P<0.05)。见表1、表2,图1。CHOP和Caspase12蛋白主要表达于蜕膜化的基质细胞的细胞质,16 h回植组和未回植组染色强度明显升高,且未回植组强于16 h回植组。见图3。与12 h回植组比较,*P<0.05;与16 h回植组比较,#P<0.05

表1 内质网应激与凋亡基因mRNA的表达变化(xˉ±s)Table 1 mRNA expression of ERS and apoptosis genes(xˉ±s)

表2 内质网应激与凋亡蛋白的表达变化(xˉ±s)Table 2 Protein expression of ERS and apoptosis(xˉ±s)
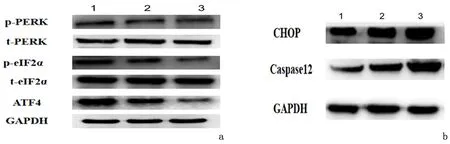
图1 相关凋亡蛋白表达的变化Figure 1 Protein expression by Western blot
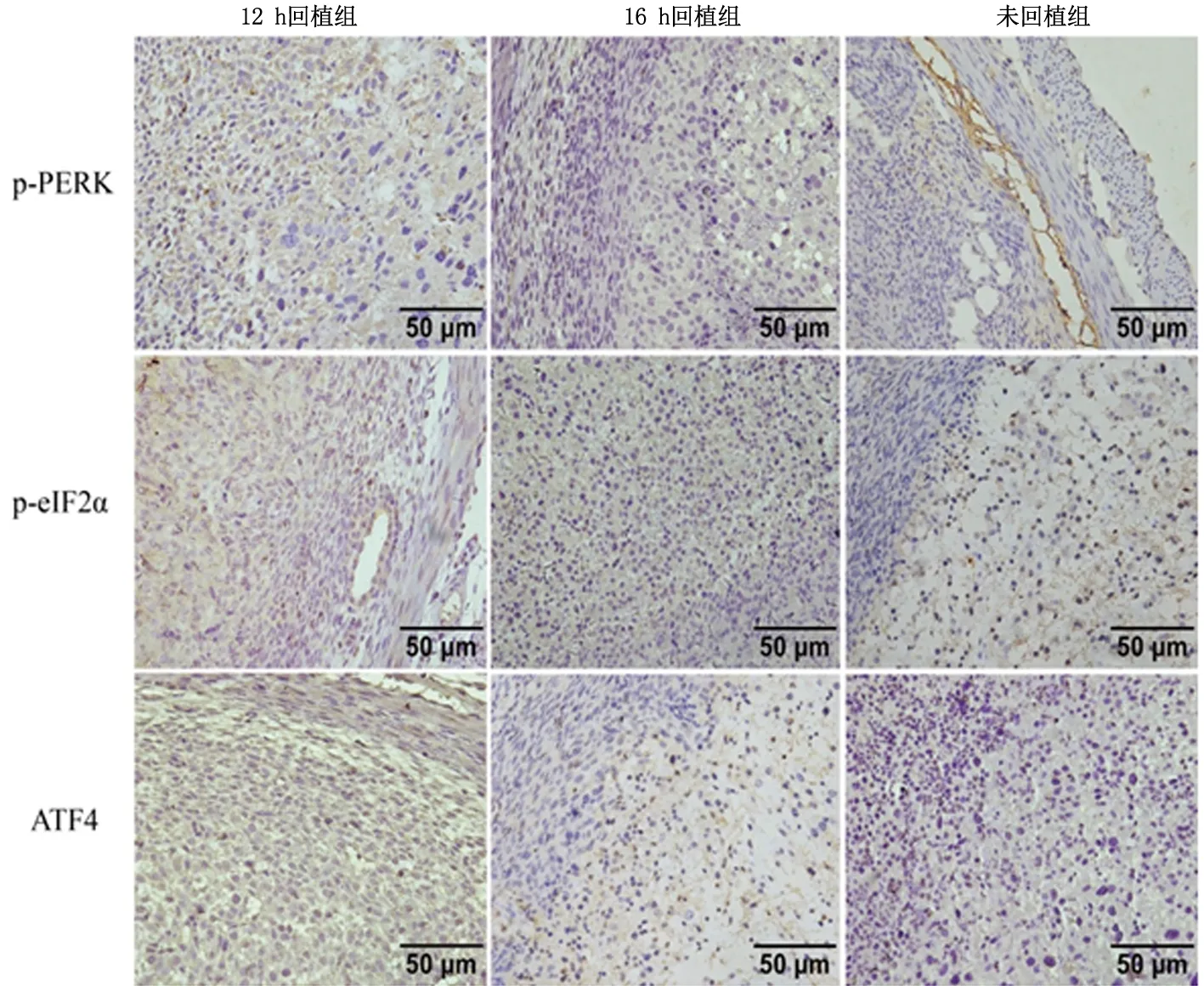
图2 镜下观察p-PERK、p-eIF2α和ATF4蛋白的原位表达(免疫组化染色)Figure2 In situ expression of p-PERK,p-eIF2α and ATF4 in mouse uterus(IHC染色)
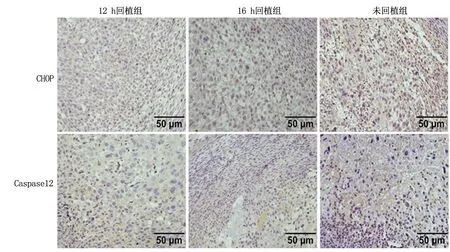
图3 镜下观察CHOP和Caspase12蛋白的原位表达(免疫组化染色)Figure 3 Insitu expression of CHOPand Caspase12 in mouse uterus(IHC染色)
3 讨 论
月经周期贯穿于女性的整个生育期,月经规律与否直接影响其生活质量[9]。月经发生机制的阐明,可为经血过多过少、痛经等疾病的治疗及月经周期的干预提供新的策略和思路。
目前认为月经发生存在由血管外周细胞(孕酮受体阳性)介导的可逆阶段和白细胞(孕酮受体阴性)介导的不可逆阶段,在前一阶段补充孕酮可阻断子宫内膜的崩解[10],因而推测月经发生存在一个可为孕酮逆转的关键时期。这已在恒河猴和小鼠模型中得到了证实[3-11]。但目前并不清楚孕酮是通过什么信号调控子宫内膜基质细胞的生存或死亡的。自噬是一个维持真核细胞内稳态的、具有复杂调控机制的分解代谢过程[12]。生理状况下,细胞通过基础水平的自噬清除受损的蛋白质或细胞器而维持细胞稳态。自噬缺陷小鼠会出现错误折叠或受损蛋白的累积[13]。自噬参与人类月经发生已见零星报道[14],但尚缺乏系统、全面的研究。蛋白激酶RNA样内质网激酶(protein kinase RNA-like ER kinase,PERK)是一种内质网跨膜蛋白,其活性受到内质网腔中的一种分子伴侣——葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)调节[13]。正常情况下PERK与GRP78结合而缺乏活性;当发生ERS时,可特异性触发内质网中未折叠蛋白反应(unfolded protein response,UPR),此时 PERK 与GRP78分离,发生自身磷酸化而快速激活[15-16],从而磷酸化eIF2α,下调蛋白合成的整体水平,减轻UPR来维持细胞生存;但当ERS加剧时,eIF2α也可通过另外一条信号通路上调 ATF4[5],ATF4 可直接上调CHOP表达,从而诱导细胞凋亡[17]。本研究通过在月经发生关键时期前(12h)、后(16h)回植孕酮,将其与未回植组小鼠进行比较,分析小鼠子宫中内质网应激诱导的自噬和凋亡信号表达情况。结果发现:虽然各组PERK和eIF2α的总蛋白表达没有明显变化,但在mRNA水平、活性形式的蛋白(p-PERK、p-eIF2α)及ATF4的表达均表现为以12 h回植组、16 h回植组和未回植组的顺序依次递减,而凋亡信号的表达则依次递增。提示在月经发生关键时期之前的12h回植孕酮,可以有效维持小鼠子宫内膜细胞的自噬作用并抑制凋亡作用,保持小鼠子宫内膜基质细胞的存活;关键时期之后的16回植孕酮,则只能部分起到维持自噬作用并抑制凋亡作用。其机制可能是:在12 h回植孕酮,可以有效维持p-PERK/p-eIF2α/ATF4表达,阻断ERS的加剧,使小鼠子宫内膜基质细胞能及时清除累积在内质网腔中的异常蛋白质而维持存活;而16 h回植孕酮,则可能在月经发生12~16 h这一时期中,因ERS的进一步加剧,大部分子宫内膜细胞已经难以清除异常蛋白质的累积,转而启动了内质网特异的凋亡信号CHOP和Caspase12的表达,因而添加孕酮已无法改变应激造成的子宫内膜基质细胞的损伤,子宫内膜将难以避免地走向崩解脱落。需要注意的是,PERK、eIF2α的mRNA的变化趋势与其磷酸化蛋白的表达趋势一致而与总蛋白表达趋势不符,其原因可能是这两种蛋白的活性调节可能并不体现在翻译水平,而是体现在对其翻译后水平上的快速磷酸化上[18-20]。综上所述,在月经发生关键时期前回植孕酮,可以阻断小鼠月经发生的进程,其可能机制是通过维持小鼠子宫内膜基质细胞中ERS诱导的自噬信号通路PERK/eIF2α/ATF4表达并抑制凋亡关键信号CHOP和Caspase12表达来实现的,其详细的分子机制还需在今后研究中进一步的明确。

