肺纤维化小鼠肺功能的动态变化
尹健彬,皮 娜,文 怡,刘 婵,李佳鑫,成梦群,白子娟,张 旋
0 引 言
肺纤维化(pulmonary fibrosis,PF)是由多种原因引起的慢性间质性肺疾病,虽然近些年对PF的认识已经有了实质性的进展,其与个体基因和环境共同作用下的病理学机制和分子机制的了解也在不断的加深[1-2],但其致病机制目前尚还不完全清楚,所以存在治疗困难,患者预后差等特点,5年的生存率仅为20%[3],PF的特征是随着时间的延长患者肺功能逐渐降低[4],直至死亡;它是特发性间质性肺炎中最常见的一种,是目前严重危害人类健康的一类慢性进展性致死性疾病[5]。
肺纤维化小鼠模型是抗肺纤维化活性物质筛选的经典动物模型,肺组织结构改变和恶化的传统评价指标主要是病理学检查和一些定量生化标志物,近些年随着呼吸药理及呼吸生理学的不断发展,肺功能相关参数已成为呼吸系统疾病判定和治疗效果评价的主要指标[6]。全身体积描记(whole body plethysmography,WBP)是一种对清醒小动物进行肺功能检测的方法,其最大优点在于检测过程动物是处在清醒无束缚的状态,无需麻醉和手术,这样可以避免由于麻醉药物和外界因素而影响检测结果,而且操作简单结果可靠,同一只动物可以重复测量,适用于重复检测和长期追踪性的研究[7]。本研究运用清醒、无束缚状态下的全身体积描记肺功能检测系统,对实验动物的呼吸指标在一段时间内进行连续监测,描述肺纤维化小鼠肺功能的动态变化过程,以期为呼吸系统疾病的药物研究和临床前试验提供科学、有效的基础数据,同时建立正常小鼠肺功能各参数的参考值范围。
1 材料与方法
1.1材料
1.1.1实验动物昆明小鼠,SPF级,雄性,7周龄,体重18~22 g,由昆明医科大学动物实验中心提供,实验动物饲养许可证:SCSK(滇K2015-002)。分笼饲养在昆明医科大学药学院动物实验室(7只/笼),饲养环境无特殊病原,温度为(25±2)℃,相对湿度为70%,自由进食进水。
1.1.2仪器无束缚全身体积描记系统(Non-invasive whole body plethysmography system,WBPs),法国EMKA科技公司,系统包括:IOX2信息采集处理软件、描记箱(4个)、压力差传感器、信号放大器、通风泵(可连4个描记箱);50 μL微量进样器,由上海安亭微量进样器厂生产。
1.1.3试剂注射用博来霉素(BLM),批准文号:国药准字H20055883,批号:16033811,规格:1.5万BLM单位,由海正辉瑞制药有限公司生产;注射用等渗盐水,批号:C170515J,由浙江国镜药业有限公司生产;水合氯醛,批号:HG 3-1004-76,由天津市光复精细化工研究所提供;质量分数为10%的水合氯醛,由昆明医科大学药学院综合实验室提供;Masson三色染色试剂盒由福州迈新生物技术开发有限公司提供。
1.2方法
1.2.1动物分组将小鼠按随机数字表法分为对照组和模型组,每组14只。模型组参照经典造模方法,小鼠行腹腔注射水合氯醛(250 mg/kg体重),大约50 μL将其麻醉,待1 min左右将麻醉小鼠固定于操作板上,用镊子拉出小鼠舌头以免窒息死亡[8];用75%乙醇消毒,于小鼠颈部正中切约1 cm小口,钝性分离组织并充分暴露气管,用50 μL微量进样器穿刺气管并缓慢注入BLM(5 mg/kg),正常对照组只行气管穿刺不注入液体;拔出针管并立即直立小鼠并旋转抖动2 min左右使BLM在肺组织中分散均匀,然后缝合伤口,进行后续观察实验。
1.2.2无创肺功能检测连接好WBP设备装置,运行信息采集软件IOX2并创建一个新的实验配置文件,设定用于小鼠WBP检测的数据参数,运行该文件并向描记箱中快速注入1 mL的气体进行实验通道的信号校正,若数据未达到标准则需要检查装置连接是否正常以及密封性。待所有通道校正通过后,将4只清醒的小鼠放入描记箱中,让其适应20 min左右;在此期间,按照小鼠编号对相应的通道进行命名并创建分组文件夹。待小鼠趋于稳定且呼吸波平稳时(应避免小鼠睡着)开始记录数据5 min,IOX2每隔10 s自动记录1次小鼠呼吸波数值,测得的11个基础数据包括吸气时间(Ti)、呼气时间(Te)、最大吸气量(PIF)、最大呼气量(PEF)、潮气量(TV)、呼气量(EV)、松弛时间(RT)、每分钟呼气量(MV)、呼吸频率(f)、被迫呼吸间隙(Penh)、50%呼气流速(EF50);实验持续4周,并将2组小鼠分别在造模后的第7、14、21、28天进行肺功能检测,每次都从上午9:00开始并且按相同的检测顺序进行。
1.2.3肺组织病理学检查分别于14 d和28 d末将2组小鼠各脱颈处死7只,取出肺组织并置于10%中性甲醛固定24 h,常规脱水、石蜡包埋、切片,并用HE染色和Masson三色染色试剂盒染色,在显微镜下观察肺组织病理变化。
1.3统计学分析采用SPSS 20.0软件进行统计分析,定量资料以均数±标准差(xˉ±s)表示,参数比较采用重复测量资料的方差分析(ANOVA),两两比较采用LSD检验;雄性小鼠肺功能各指标参考值范围依据“医学参考值范围的制定”方法计算,以P≤0.05为差异有统计学意义。
2 结 果
2.1肺组织病理学检查肺组织HE染色可见,对照组小鼠肺组织肺泡间隔正常,肺泡壁未增宽、无炎性细胞浸润;模型组可见肺泡间隔断裂、肺泡大量融合、部分可见塌陷,肺泡壁增厚、大量炎性细胞浸润,而且病变随时间的推移而加重。见图1。Masson染色显示,对照组肺组织无明显的胶原沉积,模型组在支气管周围及肺泡间隔可见大量的胶原沉积,并且在14 d时可见已经初步形成纤维化,但其在28 d时更明显。见图2。
2.2肺纤维化小鼠肺功能的动态变化小鼠气管内注射BLM后,模型组小鼠出现毛发柔顺度降低、掉毛,第2周以后活动程度下降等现象。与对照组相比,模型组Ti、Te和RT值在第4周时明显升高(P<0.05);而第4周PEF、MV、f和EF50值明显下降(P<0.05)。与模型组第 1周相比,组内Ti、Te、RT、f值在第2、3、4周时的差异有统计学意义(P<0.05),而MV和EF50值在第3、4周时的差异有统计学意义(P<0.05),PIF值则仅在第4周时存在差异(P<0.01)。如图3。
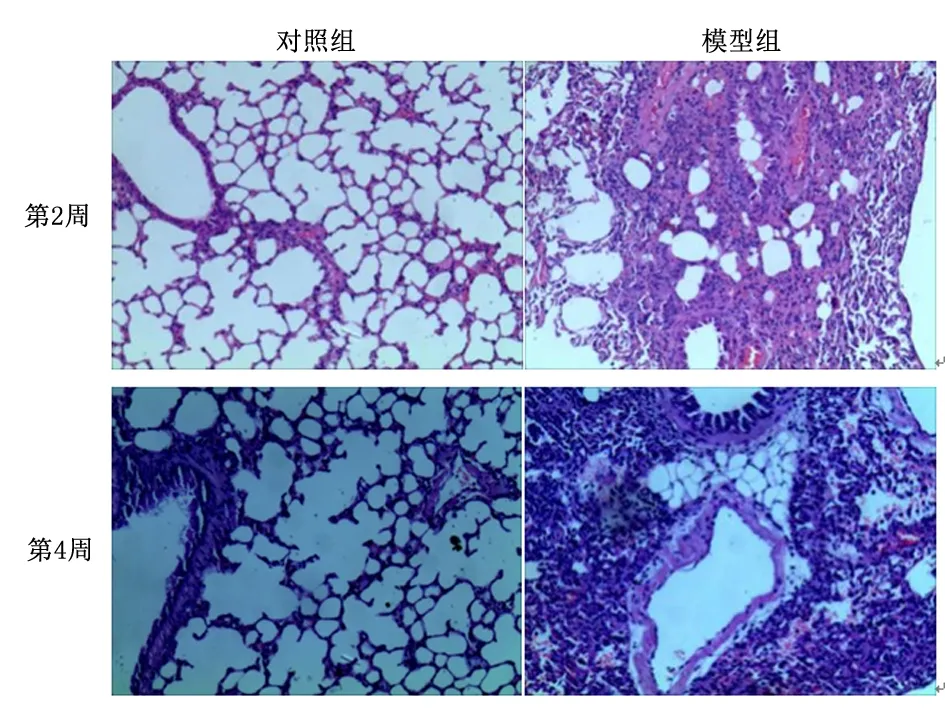
图1 肺纤维化小鼠病理学检查(×100)Figure1 Pathological examination of pulmonary fibrosis in mice(×100)
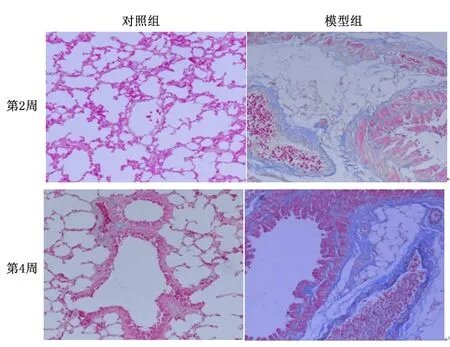
图2 镜下观察肺纤维化小鼠肺组织(Masson染色×100)Figure 2 Masson staining of lung tissue in mice with pulmonary fibrosis(Masson ×100)
2.3支气管收缩程度与同期对照组Penh比较,模型组在第2、3、4周时均升高(P<0.01);与模型组第1周相比,模型组Penh值仅在第3、4周均升高(P<0.05)。见表1。
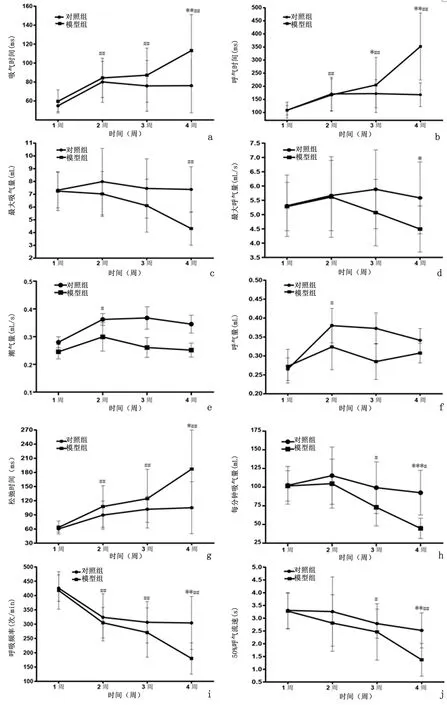
图3 肺纤维化小鼠各项肺功能指标的动态变化Figure 3 Dynamic changes of various lung function indexes in mice with pulmonary fibrosis
表1 各组小鼠Penh的变化比较()Table 1 Changes in mouse Penh(xˉ± s)
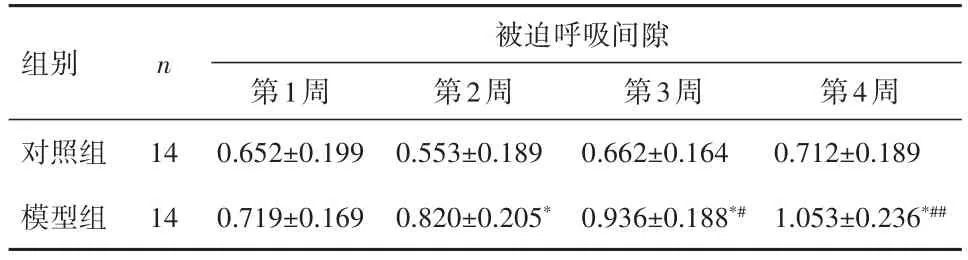
表1 各组小鼠Penh的变化比较()Table 1 Changes in mouse Penh(xˉ± s)
与对照组相比,*P<0.01;与模型组第1周相比,#P<0.05、##P<0.01
被迫呼吸间隙组别n第1周0.652±0.199 0.719±0.169第4周0.712±0.189 1.053±0.236*##第3周0.662±0.164 0.936±0.188*#第2周0.553±0.189 0.820±0.205*对照组模型组14 14
2.4建立正常雄性昆明小鼠肺功能参数参考值范围通过4周的肺功能检测,获得各项肺功能参数指标,经统计分析得到正常生理无创无束缚状态下雄性昆明小鼠各项肺功能参数值参考范围,其中主要指标Penh值的正常值范围为0.27~0.88;然而考虑到小鼠没有自主尽力呼气的意识,由此获得的PEF参考值范围3.28~7.00也仅能作为一个参照,不建议单独用于评价肺功能。见表2。
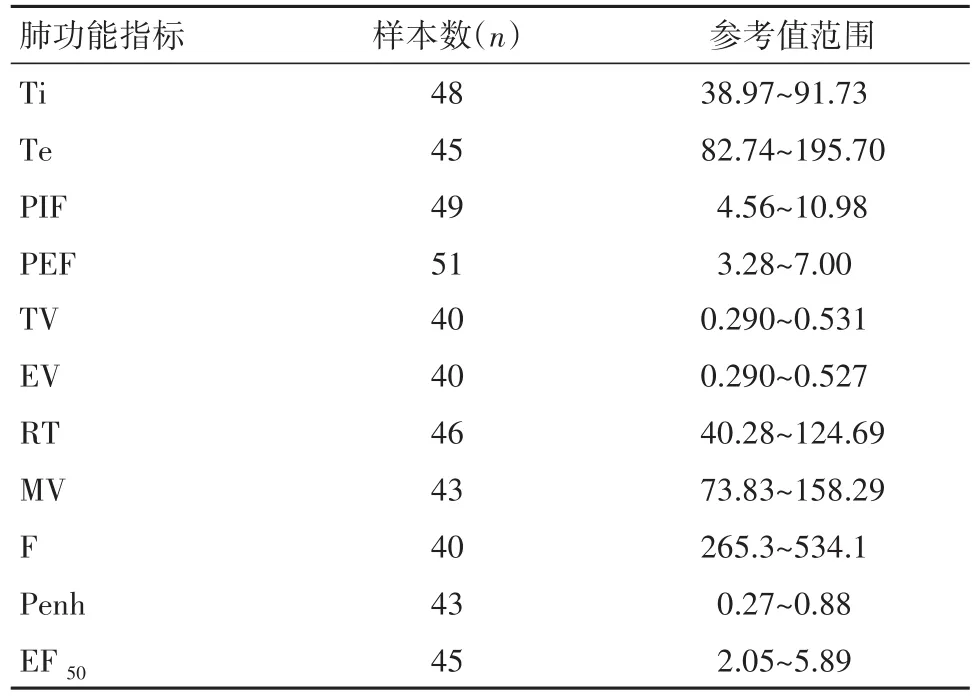
表2 正常雄性昆明小鼠肺功能参数值参考范围Table 2 Reference range of lung function parameters in normal male mice
3 讨 论
在PF疾病发病机制研究和抗PF药物筛选中,实验性PF动物模型具有重要的作用,经气管内注射BLM诱导形成PF模型是目前国际上通用的经典造模方法[9-11]。多数学者认为BLM引起PF是由于严重的炎症反应以及多种细胞因子的释放,导致肺组织内胶原异常沉积、纤维细胞转化和异常增生、组织异常修复等[12]。由于BLM诱导的PF模型存在随时间变化性和部分可逆性,并存在炎症反应和纤维化两个阶段[8,13],而所有潜在的抗 PF的化合物都应在纤维化阶段进行评估,对于评价目标化合物对PF进程的影响,肺功能将是一项比较直观的指标;同时,由于抽样误差的存在,所有实验指标应尽可能在同一批实验动物中获得;因此,相对于有创肺功能无创且没有其他药物干扰的肺功能检测将显得尤为重要。WBPs是在小鼠无创且清醒状态下进行的,所以可以避免麻醉药物对肺功能参数的影响,而且检测过的小鼠可以重复使用,很适用于跟踪性的研究[14]。
Penh是指示气道阻力的指标,表征支气管的收缩程度;有研究显示,用乙酰甲胆碱刺激导致小鼠高气道反应时会引起Penh值的增加,且随乙酰甲胆碱的浓度而改变[15-16]。值得注意的是,虽然Penh被认为可能与气道阻力密切相关,但有观点认为在使用非侵入性方法检测时不易选用Penh值作为长时间测量的理想指标,原因在于Penh值容易受环境温度和湿度的影响[17];另外,在重复测量实验中Penh值还会受到时间的影响[17],但这种影响可能也是由于不同时间点重复测量时环境的变化引起的。即使这样,Penh值在独立测量及在其他肺功能指标的参与下,还是被广泛应用于气道阻力的评价。
本研究以BLM诱导的PF模型为基础,分别对对照组和造模后的模型组小鼠在1~4周内进行无束缚状态下的肺功能检测,由病理学检查可见造模是成功的,而且随时间的推移肺组织纤维化逐渐加重;在获得的参数指标中Ti、Te(从吸气呼气开始到吸气末下一个吸气开始的时间)随着时间的延长呈上升的趋势,特别是Te(呼气时间),这可能与文献报道的IPF患者肺部的一氧化碳扩散能力降低(DLco)有关[18],说明肺的气体交换功能降低;这种现象在第2周开始逐渐显现出来,这与组织病理学表现一致,即在第2周肺组织开始出现肺泡壁增厚、肺泡间隔增宽,在支气管周围出现胶原沉积等,这也与文献报道一致[6]。PIF和PEF是指征一个呼吸过程中最大流量的指标,在4周内可观察到两个指标随时间出现波动,但仅有模型组的PIF在第4周时与对照组存在差异,而PEF却没有差异,这可能的解释是由于小鼠没有自主尽力呼气(深呼气)的意识,导致肺部有部分气体的滞留,致使测量结果不准确。研究显示模型组TV和EV值相较于对照组是明显偏低的,但模型组仅在第2周时与第1周存在差异,此后没有体现出差异;正如Milton等[6]所述,BLM处理的小鼠由于肺部形态学的改变,可用于气体交换的组织面积减少,使得纤维化后肺组织气体交换受阻并引起呼吸频率f减少,这可能是有力的解释;相较之下在1 min内的累积呼气量MV值模型组始终是低于对照组的并且持续降低,这也证明了前面的推测。
然而,可以看到Penh从第2周开始出现明显的上升趋势,而且随时间的推移其在不断增大,故增加的气道阻力在PF过程中可能是呼吸困难的原因之一,这同先前的研究报道是一致的[4,19];也反映出Penh作为小动物整个肺功能总体筛选的有效指标是可靠的。同时,代表呼气流速的EF50相较于对照组却出现了下降,这与Penh的结论一致。另外,与对照组相比松弛时间RT显示增加,这可能跟BLM处理的小鼠肺组织顺应性降低和弹力回缩增加有关[20-21]。有研究报道称,性别是决定PF风险和预后的重要因素,而性激素是性别特异性生理学的重要调节因子,这在其他肺病中也有体现[12-13];王爱欣等[22]的研究证实雌激素对百草枯诱导的PF有保护作用,当前国内外常用的PF小鼠模型绝大多数也是在雄性中进行;基于以上,本研究在重复测量的正常小鼠肺功能中,经统计分析建立了一组正常雄性昆明小鼠肺功能参数值的参考范围,以期为以后呼吸系统疾病小鼠的判定以及潜在化合物筛选研究提供一定的依据。
综上所述,经气管内滴注BLM诱导的小鼠PF模型肺功能在1~4周内持续降低,肺纤维化程度在逐渐加重,而正常昆明小鼠的肺功能各参数值波动较小;由四周内的各指标趋势图可见,造模后的小鼠肺功能在第2周以后就开始逐渐下降,到第4周时还呈现下降趋势且差异最显著,故预计肺纤维化从第2周就开始逐渐形成,所以在造模后第2~4周内可以进行抗肺纤维化合物的研究。

