丹参酮IIA抑制胃癌细胞的阿霉素耐药*
刘 源, 倪渐凤, 刘丽娜, 李芳芳, 尹先哲
(南阳市第二人民医院 1肿瘤科, 2血液科, 河南 南阳 473012; 3南阳市第一人民医院肿瘤科, 河南 南阳 473000)
胃癌是常见的恶性肿瘤,在我国,胃癌发病率和死亡率分别占据所有肿瘤的第3位和第5位[1]。化疗是胃癌的主要治疗途径之一,但胃癌患者获得性耐药一直制约着化疗效果。阿霉素(又称多柔比星,doxorubicin,DOX)是常见的胃癌化疗药物,而当肿瘤细胞产生耐药性时,化疗效果则会降低[2]。DOX是渗透性糖蛋白(permeability glyprotein,P-gp)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)及多重耐药相关蛋白1(muti-drug resistance-associated protein-1,MRP-1)的反应底物[3]。在肿瘤细胞中,过表达P-gp、BCRP及MRP-1这些药物转运体可使DOX外排,降低肿瘤细胞内的DOX浓度,从而降低化疗效果[4]。已有研究发现丹参可以抑制DOX等化疗药物转运体P-gp的表达,从而诱导结肠癌的细胞凋亡[5]。丹参的主要有效化合物为丹参酮IIA(tanshinone IIA,TAN IIa),也是丹参中含量最多的成分。本研究主要关注于Tan IIA对耐DOX胃癌细胞的DOX化疗敏感性的改变和机制,为治疗耐DOX胃癌的化疗提供新的方法。
材 料 和 方 法
1 实验材料
人胃癌细胞系SNU-216、SNU-601、SNU-620、SNU-638、SNU-668和SNU-719购自于中国细胞资源库保藏中心。丹参酮IIA及阿霉素(Sigma-Aldrich);胎牛血清(fetal bovine serum,FBS;Gibco);RPMI-1640培养基(Invitrogen);胰蛋白酶(Thermo Fisher Scientific);CCK-8染色液和细胞色素C(cytochrome C,Cyt C)抗体(上海生工);Annexin V/PI染色试剂盒(Biotool);周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)抗体(Santa Cruz);抗MRP-1抗体(Abcam);抗p21和p53抗体(Cell Signaling Technology);抗cyclin B1及LC3-II抗体(Biosis);抗Bax及Bcl-2抗体(Thermo Fisher);PVDF膜(Bio-Rad)。
2 方法
2.1细胞培养 SNU-216、SNU-601、SNU-620、SNU-638、SNU-668和SNU-719细胞生长于含有10% FBS的高糖RPMI-1640培养基中,加入100 mg/L链霉素及1×105U/L青霉素。逐级加大DOX浓度(1 μg/L直至1 mg/L)从亲本细胞系中多次筛选获得耐DOX细胞系SNU-719R及SNU-601R。通过DOX逐级筛选,最终获得的耐DOX细胞系SNU-601R及SNU-719R的IC50分别为0.271 mg/L和0.286 mg/L,较其亲本细胞系SNU-601及SNU-719分别提高了6.2倍和7.9倍,进一步证明了其耐DOX性。
2.2MTT方法检测细胞活力 细胞接种于96孔板中,每孔加入200 μL密度为2.5×107/L的细胞。DOX处理24 h、48 h及72 h后,每孔加入浓度为5 g/L的MTT 20 μL,37 ℃、4 h。加入150 μL DMSO,振荡10 min,利用全自动定量绘图酶标仪(Bio-Rad,Hercules)在490 nm处测量各孔吸光度(A)值。
2.3流式细胞仪检测细胞周期 加入1 mL浓度为1.0×108/L的胃癌细胞至24孔板中,在检测细胞周期前用DOX或(和)Tan IIA处理24 h,收集细胞,预冷PBS洗涤,加入70%乙醇-20 ℃固定过夜,1 600×g离心5 min,用含碘化丙啶和核酸酶的染色液重悬15 min后,BDLSR Fortesse细胞分析仪(BD Biosciences)于488 nm激光发射器处激发,同时检测575 nm处的荧光强度。
2.4RT-qPCR测定药物转运体在胃癌细胞中的表达 首先,按照指定方案实验处理细胞,然后收集已处理的细胞于EP管中,按照 RNAisoPLus说明书步骤,依次采用RNAisoPLus变性缓冲液、20%体积氯仿、异丙醇、75%乙醇萃取细胞总RNA。其次,取1 μg总RNA通过逆转录试剂盒方法逆转录合成cDNA。再次取cDNA模板和目的基因引物,按照按照SuperReal PreMix试剂盒说明书利用ABI 7500荧光定量 PCR仪(Applied Biosystems)进行PCR。反应条件为:95 ℃ 30 s;95 ℃ 2 s、60 ℃ 30 s、66 ℃ 1 min,共40循环。选用GAPDH作为目的基因的内参照,目的基因的相对表达结果以2-ΔΔCt表示。P-gp的正向引物序列为5’-TGTAGTTTTCGGAGTTAGTGTCGCGC-3’,反向引物序列为5’-CCTACGATCGAAAACGACGCGAACG-3’;BCRP的正向引物序列为5’-GGGCTGGCAAGCCACGTTTGGTG-3’,反向引物序列为5’-CCGGGAGCTGCATGTGTCAGAGG-3’;MRP1的正向引物序列为5’-GGCGTATCACGAGGCCCTTTCG-3’,反向引物序列为5’-CATTACTGGATCTATCAACAGG-3’;GAPDH的正向引物序列为5’-TGCCGCCTGGAGAAACC-3’,反向引物序列为5’-TGAAGTCGCAGGAGACAACC-3’。
2.5Western blot法检测蛋白表达水平 按照实验目的,利用RIPA裂解液萃取细胞全蛋白。利用BCA法将各组蛋白样品定量至相同浓度后,取40 μg蛋白进行SDS-PAGE。电泳结束后,湿转法将蛋白质转移至甲醇预活化的PVDF膜,转膜条件为恒压100 V,时间为2 h。之后利用5%脱脂牛奶室温下封闭1 h并以1 ∶1 000的稀释比例孵育Ⅰ抗(抗MRP-1、CDK1、p21、p53、cyclin B1、LC3-II、Bax及Bcl-2抗体), 4 °C过夜。次日,以TBST洗涤后于室温下孵育相应的HRP标记的 II 抗1 h,最终以TBST洗涤后利用化学发光成像仪显影。
3 统计学处理
利用SPSS 17.0软件进行统计学分析。实验数据以均数±标准差(mean±SD)表示,对于多组定量资料的两两比较,数据在方差齐的条件下,采用单因素方差分析及Bonferroni法进行比较。以P<0.05为差异有统计学意义。
结 果
1 6种人胃癌细胞对DOX的敏感性
首先,本研究检测了6种人胃癌细胞在DOX中暴露24 h、48 h及72 h时细胞活力的变化。结果显示经过24 h的处理,IC50值最高的为SNU-620细胞(0.537 mg/L),其次分别为SNU-216细胞(0.289 mg/L)、SNU-668细胞(0.225 mg/L)、SNU-638细胞(0.143 mg/L)、SNU-601细胞(0.044 mg/L) 和SNU-719细胞(0.036 mg/L)。SNU-620细胞表现出最大的耐药性而SNU-719细胞最敏感,见图1。由于SNU-620与SNU-719在24 h时的IC50差异大于2者在48 h及72 h时的差异,因此,本研究选取24 h时点作为后续细胞处理时间。另外,由于SNU-601 细胞与SNU-719细胞对DOX最为敏感,因此,本研究通过逐步加大DOX浓度(1 μg/L~1 mg/L)筛选获得了2种耐DOX细胞系SNU-601R 及SNU-719R。每种细胞分为3组,对照组用PBS处理;DOX组给予DOX 0.5 mg/L处理;DOX+ Tan IIA 组用0.5 mg/L DOX+5 μmol/L Tan IIA处理。
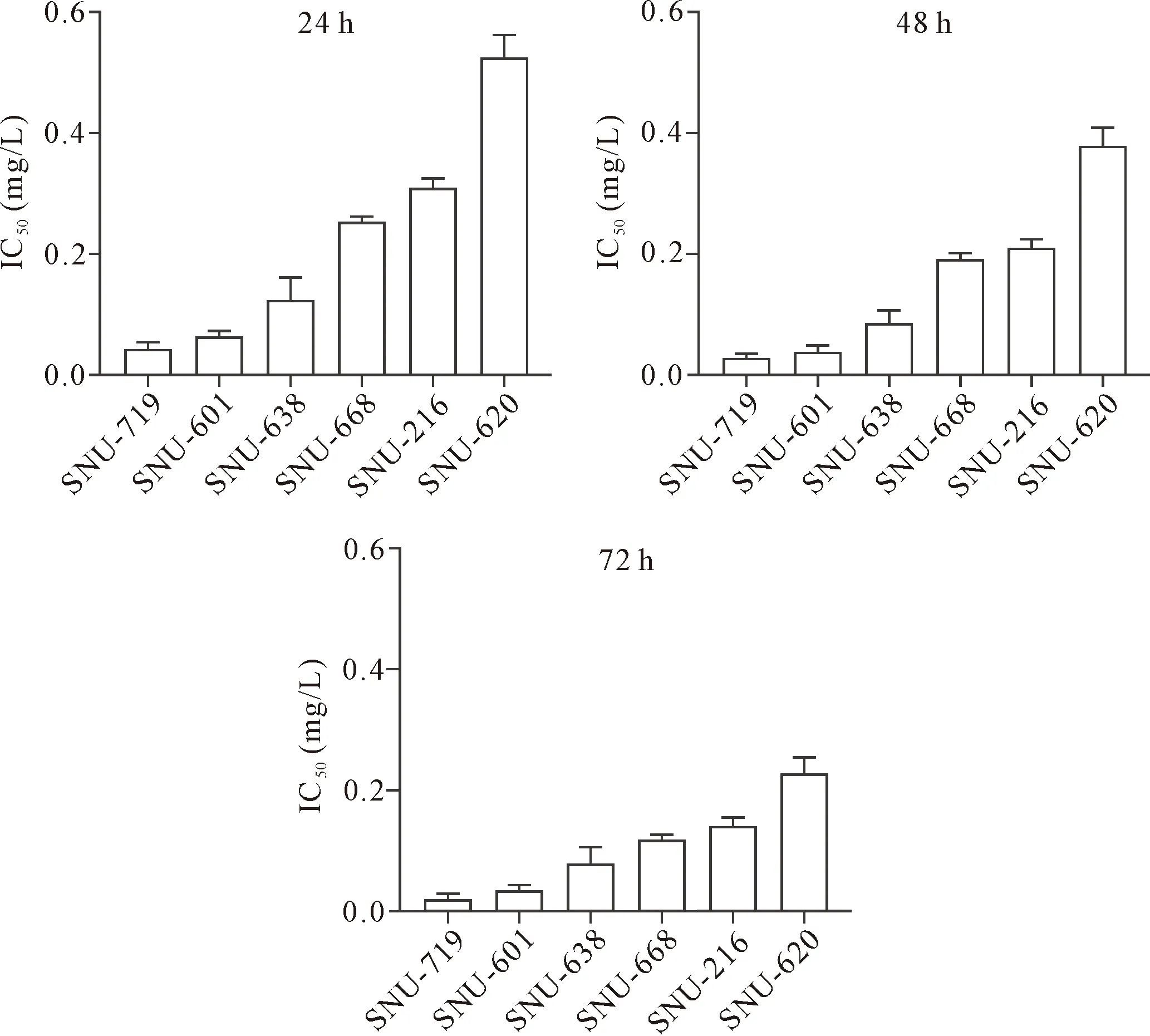
Figure 1. The cytotoxicity of doxorubicin (DOX) on gastric cancer cells. The IC50 values of DOX for a panel of gastric cancer cells were showed. The cells were treated with DOX at a series of concentrations for 24 h, 48 h and 72 h. Mean±SD. n=3.
2 Tan IIA抑制MRP-1介导的胃癌细胞的DOX外排
RT-qPCR结果显示,各组细胞中P-gp及BCRP的mRNA表达并无明显差异,但SNU-638、SNU-216及SNU-620细胞的MRP-1 mRNA明显升高(P<0.05)。DOX是MRP-1的底物之一,过表达MRP-1可减少肿瘤细胞内的DOX积聚,导致肿瘤细胞的耐药。经过药物筛选得到的耐DOX细胞株SNU-601R与SNU-719R的MRP-1 mRNA表达水平也均较相应的正常细胞株升高(P<0.01),见图2B、C。因此,DOX可导致胃癌细胞的MRP-1表达上调。
经过Tan IIA (5 μmol/L)处理后,SNU-719R细胞及SNU-620细胞的MRP-1在mRNA及蛋白水平的表达均较control组降低(P<0.01),见图2D、E。
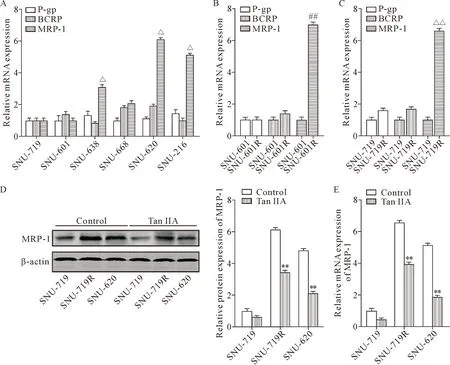
Figure 2. Inhibition of MRP-1-mediated efflux of doxorubicin (DOX) by tanshinone IIA. A: the relative mRNA expression of drug efflux transporters P-gp, BCRP and MRP-1 in a panel of gastric cancer cells; B: the relative mRNA expressions of drug efflux transporters P-gp, BCRP and MRP-1 in DOX-selected gastric cancer cells SNU-601R; C: the relative mRNA expressions of drug efflux transporters P-gp, BCRP and MRP-1 in DOX-selected gastric cancer cells SNU-719R; D: the relative protein expression of MRP-1 in gastric cancer cells after treatment with tanshinone IIA at 5 μmol/L for 24 h; E: the mRNA expression of MRP-1 in gastric cancer cells after treatment with tanshinone IIA at 5 μmol/L for 24 h. Mean±SD. n=3. △P<0.05 vs SNU-719 group; ##P<0.01 vs SNU-601 group;**P<0.01 vs control group.
3 Tan IIA诱导耐DOX胃癌细胞周期停滞
DOX可诱导细胞周期停滞,因此,本研究检测了胃癌细胞系SNU-719,SNU-719R及SNU-620的细胞周期分布。结果显示与对照组相比,单用DOX处理能降低SNU-719细胞在G2/M期细胞的数量,而SNU-719R及SNU-620细胞的G2/M期细胞分布无差异;与单用DOX处理组相比,5 μmol/L Tan IIA与DOX联用能减少SNU-719R及SNU-620细胞的G2/M期细胞的数量(P<0.05),而SNU-719细胞中两组的差异无统计学显著性,见图3A。同时,本研究也检测了细胞周期相关蛋白p21、cyclin B1及CDK1的表达。经DOX处理后,SNU-719R细胞的p21、cyclin B1及CDK1表达水平与control组相比差异无统计学显著性,而经5 μmol/L Tan IIA与DOX联用处理后,p21的表达水平升高,而cyclin B1及CDK1的表达水平较DOX组均降低(P<0.05),见图3B。同样的,SNU-620细胞DOX组的p21、cyclin B1及CDK1较control组相比差异无统计学显著性,而经5 μmol/L Tan IIA处理后,p21的表达水平升高,而cyclin B1及CDK1较DOX组均降低(P<0.05),见图3C。

Figure 3.Tanshinone IIA enhanced doxorubicin-induced cell cycle arrest in drug-resistant gastric cancer cells. A: the cell cycle distribution in the gastric cancer cells after treated with DOX at 0.5 mg/L with or without tanshinone IIA (5 μmol/L) for 24 h; B: the protein expression of p21, cyclin B1 and CDK1 in the gastric cancer SNU-719 cells and DOX resistant SNU-719R cells after treated with DOX at 0.5 mg/L with or without tanshinone IIA at 5 μmol/L for 24 h; C: the protein expression of p21, cyclin B1 and CDK1 in the gastric cancer SNU-719 cells and DOX resistant SNU-620 cells after treated with DOX at 0.5 mg/L with or without tanshinone IIA at 5 μmol/L for 24 h. Mean±SD. n=3.*P<0.05 vs DOX group.
4 Tan IIA诱导耐DOX胃癌细胞凋亡与自噬
Western blot检测结果显示,DOX对SNU-719R及SNU-620细胞的p53、Bax及Bcl-2表达均无影响,但DOX与Tan IIA合用却可升高这两种细胞的p53及Bax,降低Bcl-2,与DOX组相比差异有统计学意义(P<0.05),见图4A、B。DOX处理后,SNU-719R细胞及SNU-620细胞的LC3B-II及p62与对照组比较差异无统计学显著性,但DOX与Tan IIA合用时,LC3B-II较DOX组升高,而p62较DOX组下降。提示DOX与Tan IIA合用时可诱导耐DOX细胞自噬增强(P<0.05),见图4C、D。
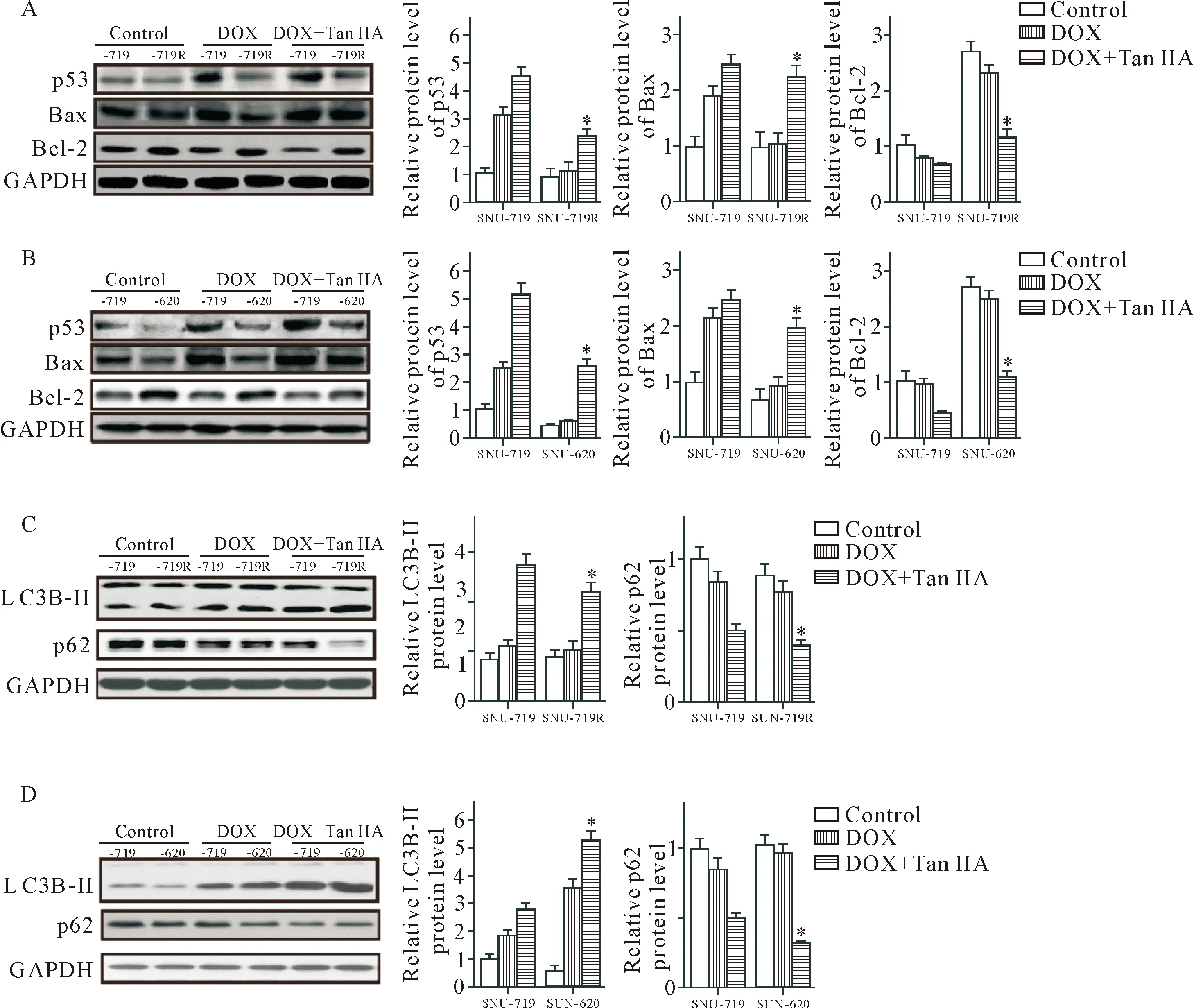
Figure 4.Tanshinone IIA increased DOX-induced apoptosis and autophagy in drug-resistant gastric cancer cells. A: the protein expression of p53, Bax and Bcl-2 in the gastric cancer SNU-719 cells and DOX resistant SNU-719R cells after treatment with DOX at 0.5 mg/L with or without tanshinone IIA at 5 μmol/L for 24 h; B: the protein expression of p53, Bax and Bcl-2 in the gastric cancer SNU-719 cells and DOX resistant SNU-620 cells after treated with DOX 0.5 mg/L with or without tanshinone IIA at 5 μmol/L for 24 h; C: the protein expression of LC3B-II and p62 in the gastric cancer SNU-719 cells and DOX resistant SNU-719R cells after treated with DOX at 0.5 mg/L with or without tanshinone IIA at 5 μmol/L for 24 h; D: the protein expression of LC3B-II and p62 in the gastric cancer SNU-719 cells and DOX resistant SNU-620 cells after treated with DOX at 0.5 mg/L with or without tanshinone IIA at 5 μmol/L for 24 h. Mean±SD. n=3. *P<0.05 vs DOX group.
讨 论
胃癌耐药性的产生与许多因素相关,包括药物排出、药物失活、前药活性降低、药物靶点改变、细胞死亡、调节失调、缺氧、细胞外基质改变、细胞因子、以及微小RNA的参与[6]。丹参酮是从丹参中分离的亲脂性成分,丹参是一种在亚洲国家广泛用于治疗心血管和肝病的传统中药[7],且丹参滴丸目前正对于评估其对糖尿病视网膜病变患者疗效和安全性的III期临床试验中[8]。丹参酮IIA是丹参中含量最丰富的丹参酮,为了评价丹参的抗肿瘤活性,研究丹参酮IIA的抗肿瘤活性尤为重要[9]。有研究发现丹参酮IIA可抑制胃癌细胞SGC-7901的生长并逆转其恶性表型,然而,关于丹参酮IIA抑制胃癌耐药性的研究很少[10]。尽管丹参酮IIA对本研究中使用的胃癌细胞几乎无细胞毒性,但我们的发现表明它具有增强阿霉素对耐药胃癌细胞的细胞毒性的能力。在耐阿霉素的胃癌细胞SNU-216、SNU-620、SNU-719R和SNU-610R中,P-gp和MRP-1在介导一些胃癌细胞系的耐药性方面都起着重要作用,本实验中,我们发现药物转运体MRP-1过表达。P-gp、BCRP和MRP-1是3种常见的药物外排转运体,它们被发现在耐药性肿瘤细胞中过表达,并通过减少其底物抗肿瘤药物的细胞内积累而赋予肿瘤细胞的耐药性[11-12]。我们的研究结果显示MRP-1过表达在胃癌细胞对阿霉素的内源性和获得性耐药性发展中均起到关键作用。
在本研究中,我们报道了丹参酮IIA对胃癌细胞MRP-1排出功能的抑制作用。丹参酮IIA与阿霉素联用可抑制DOX的转运蛋白MRP-1将DOX泵出细胞外,提高细胞内DOX浓度,且可降低cyclin B1水平,通过Bax-caspase-3通路促进凋亡。丹参酮IIA对胃癌细胞的MRP-1的抑制作用与另一研究中丹参酮IIA对乳腺癌细胞MRP-1表达的下调机制是一致的[13]。除了MRP-1的过度表达外,我们还发现阿霉素耐药的胃癌细胞存在抑制性凋亡信号传导通路,即促凋亡蛋白p53和Bax的表达下调以及抗凋亡蛋白Bcl-2上调。抗凋亡有助于肿瘤细胞产生耐药性,因许多抗肿瘤药物通过诱导凋亡破坏肿瘤细胞并抑制肿瘤生长。凋亡和自噬分别是I型和II型程序性细胞死亡,诱导自噬被认为是一种潜在的治疗抗凋亡肿瘤细胞的方法[14-15]。在本研究中阿霉素和丹参酮IIA共同作用后,耐DOX胃癌细胞自噬被激活,其中机制尚不清楚。另外,cyclin B1具有调控真核生物有丝分裂的作用,本实验中给予丹参酮IIA及DOX后,cyclin B1水平较单纯DOX组明显降低,表明丹参酮可明显抑制由cyclin B1介导的肿瘤细胞增殖与分裂,将细胞周期阻滞在G2/M期之前,降低G2/M期数量,抑制细胞增殖。
综上所述,本研究显示丹参酮IIA可通过抑制MRP-1功能、增强细胞周期阻滞、增加细胞凋亡和诱导自噬来增强耐DOX胃癌细胞对DOX的敏感性。

