单链抗体在毕赤酵母中表达的研究进展
林婷,黄义德
福建师范大学生命科学学院,福建福州350100
抗体经历了四代:一代抗体为异源多克隆抗体,特异性不好;二代抗体为鼠源单克隆抗体,可大量生产高纯度的单抗,特异性高;三代抗体为基因工程产生的人源化单克隆抗体,减少了鼠源抗体带来的免疫排斥问题;第四代抗体为全人源单克隆抗体。从鼠源抗体到人鼠嵌合抗体再到人源化抗体,以及发展到现在的全人源抗体,逐渐解决了人体的免疫排斥问题[1]。由于全尺寸的抗体通常是相对分子质量约150×103的免疫球蛋白G1 形式,这种大分子存在2 个基本问题:一是它们对组织(如实体瘤)的渗透性差;二是与某些分子表面上的区域(如人类免疫缺陷病毒包膜糖蛋白)的结合不良或结合不上,而那些区域能够被较小尺寸的分子结合[2]。抗体作为治疗性药物并非每个部分都是必需的,有报道显示若只有与抗原结合的可变区的存在,抗体依旧能够发挥其作用。因此,科研人员研制出了多种形式的小分子抗体,如单域抗体、单链抗体和双体抗体。片段抗体越小半衰期越短,单域抗体的半衰期只有几分钟[1],单链抗体(single-chain variable fragment,scFv)的半衰期相对较长一些,在体内降解较单域抗体慢。单链抗体是通过15~20 个氨基酸残基的短肽(linker)将一条抗体重链可变区和一条轻链可变区连接起来的。缺乏恒定区的单链抗体依旧能够稳定地与抗原特异性结合并发挥作用[3]。单链抗体相对分子质量只有25×103,结构稳定,可溶,并且易于采用微生物表达获得。目前,单链抗体在医学方面主要用于抗肿瘤、抗病原生物、自身免疫疾病研究、心血管疾病研究以及抗辐射损伤等;在食品安全方面主要用于食品毒素检测、农兽药物残留检测以及食品中重金属污染检测。因此单链抗体的需求量日益增长,其大量获得与制备一直是研究的焦点。
1 单链抗体的发展及应用
1.1 单链抗体的发展
单链抗体最早是在骆驼科动物的血清中发现的,之后于1988 年,首次被Bird 和Huston 研制获得[4]。只由一条轻链可变区和重链可变区组成的单链抗体称作单价单链抗体。在单链抗体制备技术逐渐成熟的过程中,研究人员对单链抗体进行了改进,继单价单链抗体之后出现了单链抗体多聚体。该抗体是经过缩短其linker 的长度,使得多个单链抗体结合在一起,增加了针对抗原的特异性。1993 年,Holliger 等同时表达了2 种不同特异性的单链抗体,其能同时与不同的抗原结合,于是称之为双特异性单链抗体[5]。
迄今,单链抗体所运用的展示系统有噬菌体展示系统、核糖体展示系统和酵母表面展示系统;其表达系统有原核细胞表达系统、酵母表达系统、哺乳动物细胞表达系统、昆虫表达系统及植物细胞表达系统;其运用到的基因转染技术有磷酸钙共沉淀技术、脂质体技术和电穿孔技术[6]。
1.2 单链抗体的应用
单链抗体属于小分子抗体,穿透性好,靶向性好,副作用小,在医学和食品安全方面都有广泛的应用。
在抗肿瘤中单链抗体用于靶向治疗,治疗形式主要有靶向性病毒载体、靶向脂质体及单链抗体融合蛋白等。单链抗体还可用于肿瘤的影像分析,经过放射性同位素标记的单链抗体可轻易渗入肿瘤形成清晰的影像,从而达到特异性放射治疗。例如,IFN-γ与碘标记的scFv 使得肿瘤显像效果极强[7]。
在抗病原微生物方面,单链抗体已经用于丙肝病毒、乙肝病毒、狂犬病病毒和牛冠状病毒等常见病毒。胡娟制备了抗狂犬病毒磷蛋白单链抗体-碱性磷酸酶融合蛋白,初步应用获得了很好的效果[8]。单链抗体也用于抗动植物各种致病细菌的研究,郑子钦制备了抗丁香假单胞菌HrpA单链抗体[9]。单链抗体也可用于抗寄生虫,单超构建了抗利什曼原虫表面糖蛋白的单链抗体库,为后续的该抗体应用奠定了基础[10]。
单链抗体在抗自身免疫疾病、抗心血管疾病以及抗辐射损伤方面也都有研究。在艾滋病治疗上已制备出单链抗体b12-scFv、ScAb2219 等[11];在心血管疾病上已制备了抗胆固醇酯转运蛋白的scFv 等;抗Ras 单链抗体则能够抗辐射损伤[12]。
单链抗体在食品安全方面主要用于食品毒素检测、农兽药物残留检测以及食品中重金属污染检测[13]。
2 单链抗体在毕赤酵母中的重组表达
单链抗体的表达系统类型如上述,这些表达系统都有各自的优点和不足。酵母表达系统包括毕赤酵母表达系统和酿酒酵母表达系统。毕赤酵母惟一的碳源为甲醇,属于甲醇营养型酵母。相对于酿酒酵母,毕赤酵母含有一个强有力的受到严格调控的启动子醇氧化酶1(AOX1),可以进行高密度发酵,且分泌效率比酿酒酵母高[14]。
与其他表达系统相比,毕赤酵母具有表达菌株稳定、表达质粒不易丢失、可高密度发酵、表达周期短、操作简单、成本低、能对表达的外源蛋白进行有限的翻译后加工修饰,以及几乎没有人类致病病毒感染风险等优点,现已成为重要的工业微生物。近年基因组测序的完成以及转录组和蛋白组数据的积累,为研究者提供了清晰的毕赤酵母遗传背景[15]。人源化糖基化菌株的工程化,意味着除了酶和碱性蛋白质之外,还可以产生更复杂的蛋白质,使得抗体或抗体片段能够拥有更高的生物活性。同时标准的分子遗传操作方法和CRISPR-Cas9 技术的建立,已经为毕赤酵母在合成生物学上的应用铺平了道路[16]。
虽然毕赤酵母表达系统在表达外源蛋白上有很大的优势,但不同来源的蛋白在毕赤酵母中的表达量存在差异,已经有许多外源蛋白的表达量达到克每升数量级,而目前单链抗体的表达量几乎只能达到毫克每升数量级(表1)。因此,优化毕赤酵母表达系统对于提高单链抗体表达量至关重要。

表1 单链抗体在毕赤酵母中的表达量
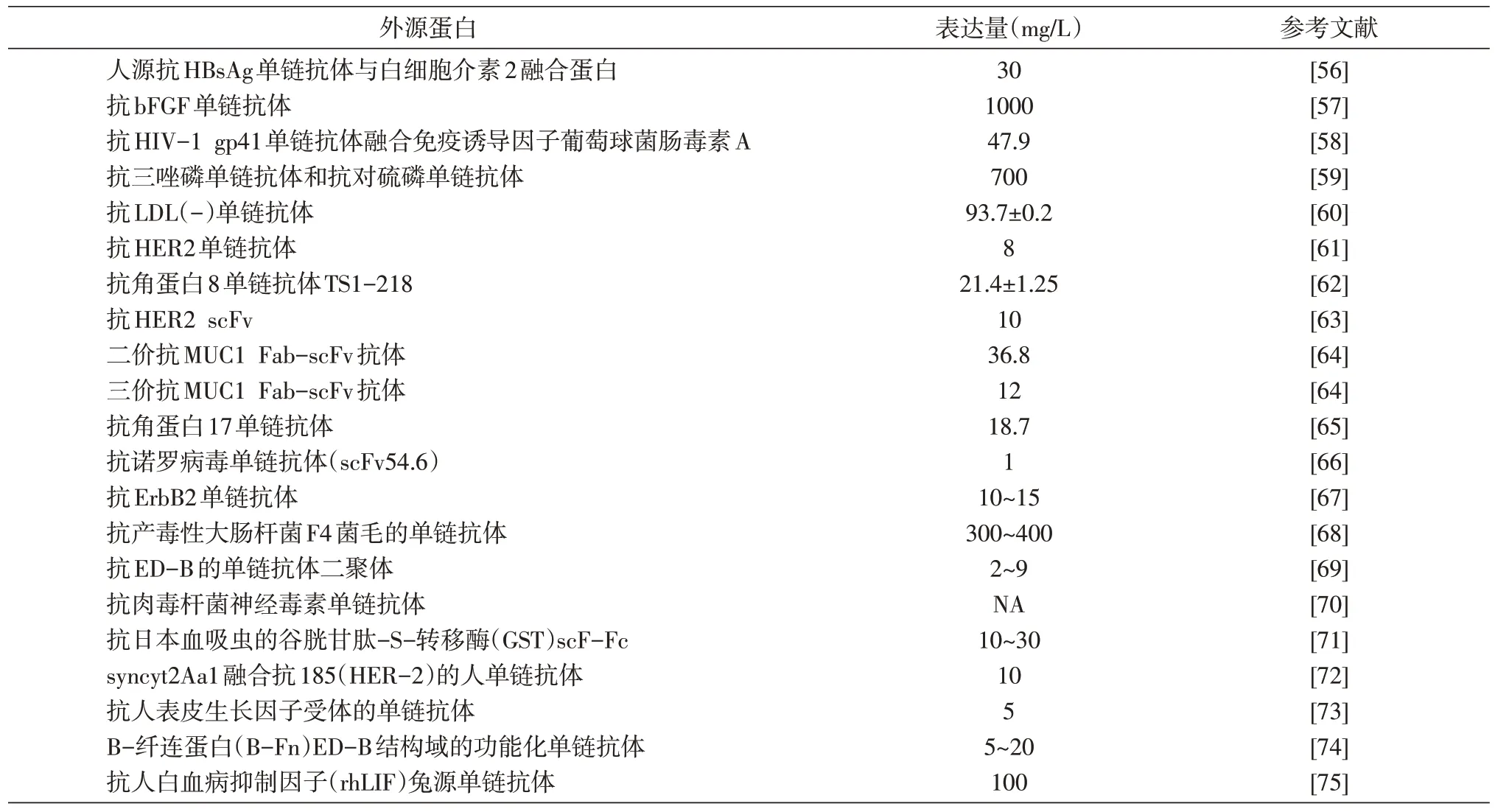
续表1 单链抗体在毕赤酵母中的表达量
3 提高单链抗体在毕赤酵母中的表达量可采取的策略
毕赤酵母表达系统表达外源蛋白,其表达量在分子水平上的影响因素有外源基因的内在特性、基因拷贝数、启动子、信号肽的选择、糖基化修饰、分子伴侣及外源蛋白降解等;在工业化水平上,发酵条件和发酵工艺也影响了表达量。下文主要描述分子水平上的影响因素及其高表达策略。
3.1 外源基因的内在特性
由于外源基因的内在特性,其影响因素主要有3 个。①密码子偏好性。不同物种的密码子使用频率是不一样的,外源蛋白在毕赤酵母中表达,其中的稀有密码子会阻碍翻译的进行甚至提前终止翻译。可以根据同义密码子的替换和毕赤酵母的密码子使用频率来优化外源蛋白的基因序列,从而提高表达量[76]。有研究者将抗ErbB2 单链抗体进行密码子优化,产量由1~2 mg/L 提高到6~10 mg/L[67]。②A+T 含量。毕赤酵母中转录提前终止信号为一段共有序列ATTATTTTA TAAA,A+T 含量高的基因容易出现转录提前终止的情况,从而影响表达量。可将A+T 含量高的序列重新设计,将A+T 的含量控制在30%~55%[77]。③mRNA 5′非翻译区(5′UTR)。5′UTR 的长度和核苷酸成分影响了外源蛋白的表达,适当的长度可以使mRNA 顺利进行有效翻译。5′UTR 的长度不合适会使核糖体40S 亚单位发生识别障碍。AOX1 基因的5′UTR 长度为114 bp 且A+U 含量高时,其编码的醇氧化酶的表达量也非常高,因此保持外源蛋白5′UTR 与AOX1 的5′UTR 一致是必须的[78]。
3.2 基因拷贝数
外源蛋白的表达量受基因拷贝的影响,相比于单拷贝基因,多拷贝基因的表达量会高很多,可以将带有卡那霉素抗性基因的表达载体导入毕赤酵母菌,使毕赤酵母获得G418 抗性,便可通过转化子对G418 的抗性快速筛选出拷贝数高的转化子[79]。但并非拷贝数越多其表达量越大,当拷贝数达到极限后无论拷贝数怎么增加,其表达量还是一样的,甚至在有限的资源和能量的细胞内,拷贝数过多可能会给转录和翻译造成负担,从而抑制蛋白的表达[80]。有研究者将甘露聚糖酶的拷贝数分别提高到2、4、6 倍,其表达量比单拷贝分别增加了1.7、2.2 和1.3 倍[81]。
3.3 启动子
一般在表达外源蛋白时选择强启动子可以提高蛋白的表达量。然而强启动子对于有些外源蛋白来说并不能提高其表达量,因为过量表达有时会导致蛋白折叠与定位错误,这些蛋白选择弱启动子更具优势[82]。因此,启动子的合理选择和使用也很关键。高源等构建了AOX1 和FLD1的双启动子质粒,在毕赤酵母中表达重组FGF1蛋白,其产量为197 mg/L,大约是目前已知最高表达水平的2 倍[83]。
3.4 信号肽的选择
毕赤酵母表达的外源蛋白大部分是胞外蛋白,这些蛋白分泌到胞外需要信号肽引导外源序列共转录到内质网,因此胞外蛋白的获得量与信号肽的选择息息相关。有报道,经过改变信号肽的疏水性、改变序列、使用密码子偏好性、进行位点突变等,可以增加外源蛋白的分泌效率[80]。谢涛将毕赤酵母的信号肽序列进行密码子优化后,用于表达2 个突变的植酸酶phyA 基因的突变基因phyA~m 和phyA~(m-4),其酶活性较信号肽改造之前分别提高了3.95 和1.53 倍[84]。
3.5 糖基化修饰
真核生物蛋白基本上都需要糖基化修饰后才可正确折叠、分泌并具有活性。毕赤酵母中存在2 种糖基化形式,即O-糖基化与N-糖基化[79]。毕赤酵母的糖基化主要是指N-糖基化,尽管其程度比酿酒酵母要弱,但是和天然蛋白相比还是存在糖基化过度问题。研究表明,在不影响蛋白活性的情况下,对N-糖基化位点进行突变、去除或引进新的糖基化位点,可提高分泌蛋白在毕赤酵母中的表达量及重组蛋白过度糖基化问题[82]。有研究者在疏水性角质酶的N 端区域引入N-糖基化共有序列,分泌增加了5 倍[85]。
若表达的蛋白质是抗体,其需要正确的糖基化模式以便抗体正确折叠。糖基化改造的人源化巴斯德毕赤酵母表达系统可以产生具有与哺乳动物系统类似的糖基化谱的糖蛋白。由人源化巴斯德毕赤酵母系统产生的治疗性糖蛋白在临床前模型中显示出与由CHO 细胞产生的蛋白有相当的折叠、稳定性和体外体内功效[86]。
3.6 分子伴侣
分子伴侣是具有协助细胞内其他分子组装及蛋白质正确折叠功能的蛋白质。毕赤酵母分泌的蛋白需要在内质网上形成二硫键及正确折叠后运输至高尔基体。在内质网上,分子伴侣参与了这2 种蛋白质修饰,分子伴侣还可以与内质网上的新生肽相互作用保持其可溶形式[87]。内质网上的分子伴侣主要有蛋白质二硫键异构酶(PDI)、人免疫球蛋白结合蛋白(BIP)、钙联蛋白和钙网蛋白。PDI 是硫氧还蛋白超家族成员,能够催化二硫键的形成及帮助蛋白正确折叠;BIP能够结合到疏水性氨基酸延伸端来稳定未成熟的蛋白[88]。因此,分子伴侣对于毕赤酵母分泌蛋白起着重要的作用。许多研究表明,分子伴侣和外源基因一起表达,外源蛋白的表达量可以明显提高,例如陈飞等将灰盖鬼伞过氧化物酶与分子伴侣PDI 共表达,其酶活性较共表达之前提高了2.43 倍[89]。
3.7 外源蛋白降解
由于毕赤酵母中存在蛋白水解酶,所以外源蛋白无论是胞内蛋白还是胞外蛋白,在表达和分泌过程中都存在被蛋白水解酶降解的风险,影响其表达量[90],因此降低相关外源蛋白水解酶是非常必要的。有研究者敲除了毕赤酵母的相关蛋白酶基因,并证明蛋白酶基因的敲除可以提高外源蛋白的产量。目前已有商业化的蛋白酶缺陷毕赤酵母菌株可供选择[91]。降低外源蛋白降解的策略还有:共表达目的蛋白和蛋白水解酶抑制剂,该策略目前还在探索阶段;将目的蛋白与过氧化物酶体靶向信号连接,目的蛋白即可转运到过氧化物酶体中,免受蛋白酶降解;对外源蛋白序列进行改造,去除蛋白酶作用位点且不改变原有蛋白性质[80]。

