裂谷热病毒截短型Gc蛋白的真核表达与纯化
郝勐,张胜男,李建民,夏咸柱
1.中国医学科学院&北京协和医学院医学实验动物研究所比较医学中心,北京100021;2.军事医学研究院生物工程研究所,北京100071;3.东北林业大学野生动物与自然保护地学院,黑龙江哈尔滨150040;4.军事医学研究院军事兽医研究所,吉林长春130000
裂谷热(Rift Valley fever,RVF)是由一种蚊媒病毒引起的急性人兽共患病,20 世纪初主要流行于肯尼亚境内的东非大裂谷区域,因此该病毒得名为裂谷热病毒(Rift Valley fever virus,RVFV)[1]。RVFV 可以导致牛、羊和骆驼等动物的母畜流产,流产率可高达100%,并对幼畜具有较高的致死率。同时,RVFV 可以导致人类发热、肌肉疼痛,严重可至神经紊乱、视力减弱、出血热,甚至死亡[2]。裂谷热病毒属于布尼亚病毒科白蛉热病毒属,是单股负链分节段的RNA病毒,其基因组由L、M 和S 片段构成,其中,L 片段编码病毒复制所需的RNA 依赖的RNA 聚合酶(RdRp),M片段编码病毒的糖蛋白Gn、Gc 和非结构蛋白NSm,S 片段以双义的形式编码病毒的核蛋白N和非结构蛋白NSs。Gn 和Gc 蛋白主要介导病毒的吸附、入侵和膜融合过程,因此,这2 个蛋白成为设计RVFV 疫苗和中和抗体的主要靶标。
自裂谷热病毒被分离后,裂谷热疫情不断发生[3]。1950~1998 年,裂谷热疫情主要发生于非洲地区,南非、肯尼亚、埃及以及东非一些国家均暴发过多次较大规模的人感染裂谷热病毒的疫情,并且造成了数百人的死亡[4-8]。2000 年,有研究者首次报道了发生在非洲大陆以外的裂谷热疫情,该疫情发生于沙特阿拉伯,在6 个月的时间内有总计880 例实验室确诊患者,其中123 名患者死亡[9]。在此期间也门也发生裂谷热疫情,1328 名感染患者中有166 人死亡。研究表明,引起阿拉伯半岛疫情的裂谷热病毒毒株与导致1997~1998年东非疫情的毒株是一致的[10]。距今较近的疫情发生于2008 年的苏丹,总计747 感染患者中有230 人死亡。2016 年,在尼日尔和东非发生了小规模疫情,导致数人死亡[11]。同年,我国也发现首例输入性裂谷热病例[12]。上述研究表明,裂谷热病毒有跨区域传播的趋势。然而,目前暂无商品化的疫苗或抗体用于预防或治疗RVFV 的感染。
在本研究中,我们利用悬浮型293 细胞表达了RVFV 截短型Gc 蛋白(691~1119 aa),并对该蛋白进行了纯化及免疫反应性鉴定,为后续RVFV亚单位疫苗的研发和中和抗体筛选提供基础。
1 材料与方法
1.1 材料
Expi293F 细胞、真核表达载体pCAGGs、抗Gc蛋白兔多抗、Gc 蛋白单克隆抗体B6 以及马尔堡病毒GP 蛋白单克隆抗体1A8 均由本研究室保存;大肠杆菌Top10 感受态细胞、去内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司;限制性内切酶EcoRⅠ、NotⅠ和NEBuilder 同源重组酶购自NEB 公司;胶回收试剂盒购自Omega 公司;Expi293F 细胞培养基及转染试剂购自Thermo Fisher 公司;StrepTrap 预装柱购自GE 公司;TMB单组分显色液和终止液购自索莱宝公司;山羊抗兔二抗(HRP)、山羊抗人二抗(HRP)购自Abcam公司;Western 印迹显色液购自Millipore 公司;RVFV M 片段的开放读框基因(pUC57-MORF)由生工生物工程(上海)公司优化并合成。
1.2 真核表达质粒的构建
利用重叠延伸PCR 将有助于目的蛋白分泌表达的tPA 信号肽和纯化标签StrepⅡ-tag 克隆至截短Gc 蛋白基因的5′端和3′端。具体流程如下:以pUC57-MORF 为模板,利用上游引物OpGc2-F和下游引物GC-C-Strep2R 进行PCR 扩增,将tPA信号肽和StrepⅡ-tag 的部分序列克隆至截短Gc基因的5′端和3′端,并进行胶回收;然后,以上述所得片段(opGc2-c)为模板,利用上游引物tPA-F和下游引物Strep1R 进行PCR 扩增,将tPA 信号肽和StrepⅡ-tag 的剩余部分序列克隆至截短Gc 基因的5′端和3′端,以获得含有完整的tPA 信号肽序列和StrepⅡ-tag 序列的截短Gc 基因(opGcc1),进行胶回收,用限制性内切酶EcoRⅠ/NotⅠ对真核表达载体pCAGGs 进行双酶切,并进行胶回收;最后,通过同源重组酶将所得目的基因和表达载体连接,转化大肠杆菌TOP10 感受态细胞,挑取单克隆菌落送生工生物工程(上海)公司测序,将测序正确的单克隆菌落进行去内毒素大提,获得质粒pCA-Gcopt-c 以备后续转染使用。所用引物及序列见表1。
1.3 RVFV 截短型Gc 蛋白在Expi293F 悬浮型细胞中的表达
转染前,将3×106Expi293F 细胞接种于30mL Expi293F 表达培养基中,于5% CO2、37℃、120 r/min 条件下持续培养数小时,当细胞密度达3.5×106/mL 时,将80 μL ExpiFectamine293 转染试剂加入1.5 mL 培养基中混匀,室温孵育5 min。将30 μg pCA-opGc-c 加入1.5 mL 培养基中混匀,然后将孵育好的转染试剂与培养基的混合物加入质粒与培养基的混合物中轻轻混匀,室温孵育25 min,最后缓慢加入细胞培养瓶中。培养16 h 后,在上述细胞培养瓶中分别加入150 μL转染增强剂1 和1.5 mL 转染增强剂2,培养数小时后取细胞上清进行截短Gc 表达量的鉴定。
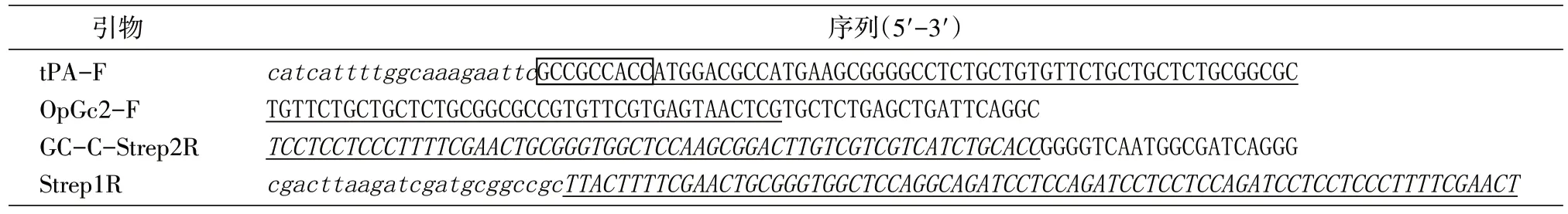
表1 引物及序列
1.4 RVFV 截短型Gc 蛋白表达量的鉴定
取上述添加转染增强剂后培养84 h 的细胞培养液50 μL,4℃、12 000 r/min 离心5 min,用含有还原剂的蛋白上样缓冲液制样并电泳;电泳结束后,用湿转方法将蛋白转移到经甲醇激活的PVDF 膜上;转膜后,用5%脱脂乳对PVDF 膜室温摇床封闭1 h,分别用抗Gc 兔多抗(1∶5000)和StrepⅡ-tag(HRP)抗体(1∶30 000)与封闭后的PVDF 室温孵育1.5 h;用PBST 清洗PVDF 膜3 次,每次10 min;以1∶10 000 的比例加入羊抗兔二抗(HRP)室温孵育1 h;用PBST 清洗PVDF 膜3 次,每次10 min;利用Western 印迹显色液进行显色。
1.5 RVFV 截短型Gc 蛋白在Expi293F 细胞中不同时间点表达量的鉴定
在完成转染并添加转染增强剂后,每隔12 h收取细胞培养基100 μL,直至收到第96 h,每次收取培养基后,立即测定Expi293F 细胞的活率,然后4℃、12 000 r/min 离心5 min,取上清制备样品进行Western 印迹,方法同1.4。
1.6 RVFV 截短型Gc 蛋白的纯化
收取细胞上清,用0.22 μm 滤膜过滤。上样前,先用平衡缓冲液(100 mmol/L Tris-HCl, 150 mmol/L NaCl,1 mmol/L EDTA,pH8)对StrepTtrap亲和柱进行平衡,平衡5 个柱体积后上样,同时收取柱后。上样结束后继续平衡5 个柱体积。平衡结束后,用洗脱缓冲液(100 mmol/L Tris-HCl,150 mmol/L NaCl,1 mmol/L EDTA, 2.5 mmol/L脱硫生物素,pH8)进行洗脱,收集洗脱峰。最后,对收集的目的蛋白进行SDS-PAGE 和Western 印迹鉴定。
1.7 BCA 法测定蛋白浓度
根据标准品和样品数量,将A 液和B 液按50∶1 的比例充分混匀配制成适量的BCA 工作液。取标准品和待测蛋白样品,按10 μL/孔加入96 孔板中,每个样品各做一个复孔,各孔加入200 μL BCA 工作液,避光,37℃孵育30 min。最后用酶标仪测定D570nm值,并根据标准曲线计算蛋白浓度。
1.8 ELISA 检测RVFV 截短型Gc 蛋白的免疫反应性
取纯化的截短型Gc 蛋白包被酶联板(2 μg/mL,100 μL/孔),4℃过夜,PBST 洗涤3 次后,用2% BSA 于37℃封闭1 h;洗涤3 次后加入初始浓度为10 μg/mL 的B6 和1A8,以1∶3 的比例梯度稀释,37℃孵育1 h;洗涤3 次后加入HRP 标记的羊抗人二抗,37℃孵育1 h;洗涤3 次后加入100 μL TMB 单组分显色液,室温显色5 min,再加入50 μL 终止液,最后用酶标仪读取D450nm-D630nm值。
2 结果
2.1 RVFV 截短型Gc 蛋白真核表达质粒的构建
重叠延伸PCR 中第1 次扩增的DNA 片段Op-Gc2-c 为1323 bp,第2 次PCR 扩增所得DNA 片段OpGc1-c 为1590 bp,核酸电泳结果显示条带大小均与预期相符(图1)。利用同源重组将目的片段克隆至真核表达载体pCAGGs 后,挑取单克隆菌落测序,测序结果显示目的片段与预期完全一致,没有任何突变和缺失,将构建的质粒命名为pCA-Gcopt-c。
2.2 RVFV 截短型Gc 蛋白真核表达量的鉴定
将测序正确的真核表达质粒pCA-Gcopt-c 转染Expi293F 细胞,84 h 后收取细胞上清,利用Western 印迹鉴定截短型Gc 蛋白的表达量,结果如图2。抗Gc 蛋白的兔多抗和针对StrepⅡ-tag 的抗体都可以特异地检测到Expi293F 细胞上清中的截短型Gc 蛋白,且蛋白大小与预期结果相符。同时,抗Gc 蛋白的兔多抗和针对StrepⅡ-tag 的抗体可以同时与一个相对分子质量约为23×103的蛋白结合,我们推测该蛋白为Gc 蛋白断裂所致。
2.3 RVFV 截短型Gc 蛋白在Expi293F 细胞中不同时间点表达量的鉴定
上述结果显示,RVFV 截短型Gc 蛋白在Expi293F 细胞中有较高的表达量。但是为了能够进一步提高截短型Gc 蛋白的表达量,我们对转染后不同时间点的Expi293F 细胞表达截短型Gc 蛋白的量进行了Western 印迹鉴定,同时测定了不同时间点Expi293F 悬浮细胞的活率,以确定最晚收取细胞上清的时间,结果如图3。截短型Gc 蛋白的表达量在转染后96 h 最高,此时Expi293F 细胞的活率降到了41%(图4),已不适于继续培养。因此,我们确定转染后96 h 为收取细胞上清的最佳时间。

图1 重叠延伸PCR扩增RVFV截短型Gc片段
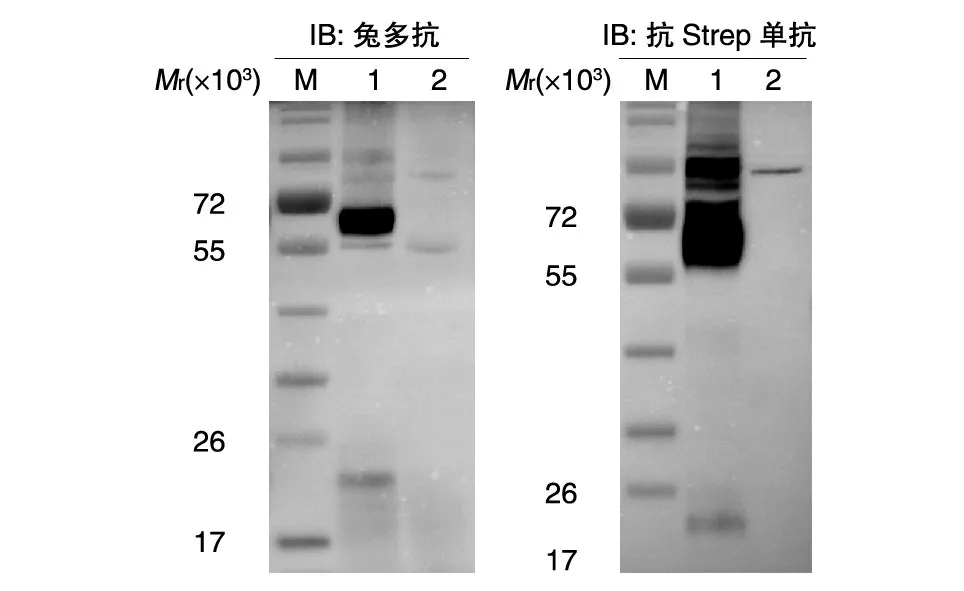
图2 Western印迹鉴定RVFV截短型Gc蛋白

图3 截短型Gc蛋白在Expi293F细胞中不同时间点的表达量
2.4 RVFV 截短型Gc 蛋白的纯化及鉴定
在确定最佳细胞上清收获时间后,我们利用StrepTrap 亲和柱对收获后的细胞上清进行了纯化,同时在纯化过程中收取了目的蛋白的洗脱峰、柱前和柱后,进行SDS-PAGE 分析,结果如图5,在收取的洗脱峰中获得了纯度较好的截短型Gc 蛋白。用BCA 方法测定的纯化后的Gc 蛋白浓度为0.7 mg/mL。最后,利用抗Gc 蛋白的兔多抗和针对Strep 标签的抗体对洗脱峰中的蛋白进行了Western 印迹鉴定,结果如图6,抗Gc 蛋白的兔多抗和针对Strep 标签的抗体不仅可以与纯化后的截短型Gc 蛋白特异性结合,还可以与一个大小约为23×103的蛋白结合,与图2 结果一致。
2.5 ELISA 检测RVFV 截短型Gc 蛋白的免疫反应性
在得到比较纯的截短型Gc 蛋白后,我们通过ELISA 实验,利用Gc 蛋白的单克隆抗体B6 对截短型Gc 蛋白的免疫反应性进行了初步检测,结果如图7。单克隆抗体B6 与截短型Gc 蛋白具有良好的结合活性,而马尔堡病毒GP 蛋白的单克隆抗体1A8 对照与截短型Gc 蛋白没有结合活性,说明我们通过真核表达并纯化所得的截短型Gc 蛋白具有较好的免疫反应性。

图4 转染后96 h内Expi293F细胞活率的变化情况

图5 纯化后的截短型Gc蛋白的SDS-PAGE分析
3 讨论
裂谷热病毒是一种蚊媒且人兽共患的烈性病原,同时也是一种潜在的生物战剂。目前国际上尚无获批的疫苗或药物来预防和治疗裂谷热病毒的感染。随着全球化程度的日益加深,裂谷热病毒跨区域传播的趋势愈发明显,2018 年世界卫生组织公布的当前最需要关注的十大病原,裂谷热病毒仍位列其中[13]。裂谷热病毒的预防和治疗引起了越来越多的研究者的关注。裂谷热病毒的Gn 和Gc 蛋白在病毒入侵过程中起重要作用,因而是裂谷热病毒疫苗和中和抗体研发的主要靶点,获得纯化的Gn 和Gc 蛋白具有重要的生物学意义。

图6 纯化后的截短型Gc蛋白的Western印迹
图7 ELISA检测截短型Gc蛋白的免疫反应性
目前,裂谷热病毒Gc 蛋白多为原核表达。在原核表达过程中,大肠杆菌并不能够对Gc 蛋白进行糖基化。相较于原核表达系统,真核表达系统更能模拟病毒在感染人或动物后,Gc 蛋白在真核细胞中翻译、折叠及成熟的过程,使之更贴近天然构象。研究表明,裂谷热病毒的Gc 蛋白存在数个位点的糖基化修饰,而这些糖基化修饰对Gc 蛋白的构象维持具有重要作用[14-15]。
在本研究中,我们利用Expi293F 悬浮细胞表达裂谷热病毒截短型Gc 蛋白,并纯化得到纯度较高的Gc 蛋白。我们发现Gc 蛋白容易发生断裂,但导致该现象的具体因素以及该蛋白具体断裂位点尚未见相关报道,仍须进一步研究。通过SDS-PAGE 可以看出断裂所致蛋白较少,应不影响对截短型Gc 蛋白的后续研究与应用。最后,我们也对纯化后蛋白的免疫反应性进行了初步检测,结果显示该蛋白的免疫反应性较好,可用于后续疫苗抗原开发和中和单抗的筛选。

