子宫内膜癌患者血清LncRNA ROR、miR-29a表达变化及临床意义
李欣,孟静,任瑞,管翠平,冯超林,陈曼曼
(1 山东大学第二医院,济南 250000;2 山东省胸科医院)
关键字:子宫内膜癌;长链非编码RNA重编程调节物;微小RNA-29a;临床分期
子宫内膜癌是最常见的妇科恶性肿瘤之一,美国癌症协会报道美国2015年约有5.5万例新发病例,死亡例数达1.1万例,且发病率和病死率有逐渐增加的趋势,严重危害女性患者的健康[1]。目前子宫内膜癌的治疗包括手术治疗、放化疗及内分泌治疗等方式,但对晚期患者,术后仍有复发转移的风险,患者5年生存率低于30%[2]。因此需深入研究子宫内膜癌的发病和疾病发展的机制,寻找新的关键的诊断治疗靶点。长链非编码RNA(LncRNA)是长度大于200个核苷酸的RNA分子,具有结合靶基因启动子区调控基因转录、介导染色质重构及结合mRNA抑制翻译过程等生物学功能[3]。近年来研究发现,LncRNA在炎症、肿瘤、心血管疾病及自身免疫等多种疾病中均发挥重要的调控作用,有望成为疾病诊断治疗的生物学标志物[4]。研究表明,肿瘤细胞中LncRNA重编程调节物(ROR)表达升高,能促进MYC等癌基因的表达,促进肿瘤细胞的增殖并抑制凋亡[5]。miRNA长度为18~25个核苷酸,成熟的具有颈环结构miRNA参与构成RNA诱导的沉默复合物(RISC),调控靶基因mRNA翻译。miR-29家族包括miR-29a、miR-29b、miR-29c三个成员,miR-29a在卵巢癌、肾癌及膀胱癌等多种肿瘤中表达下降,导致对Bcl-2等抑癌基因表达抑制减弱,促进肿瘤的增殖、迁移及浸润等[6]。miR-29a受转录后水平精细调控,如LncRNA-MIAT能与miR-29a相互作用,影响下游癌基因如组蛋白去乙酰化酶4(HDAC4)的表达,影响肿瘤细胞的生物学行为[7]。国内有学者亦报道LncRNA ROR表达与miR-29a表达之间存在一定相关性[8]。本研究通过检测85例子宫内膜癌患者血清中LncRNA ROR与miR-29a的表达水平,初步探讨两者的临床意义。
1 资料与方法
1.1 临床资料 选择2017年3月~2019年3月在山东大学第二医院诊治的85例子宫内膜癌患者(癌症组)。纳入标准:①子宫内膜癌患者均经病理学检查明确确诊为子宫内膜癌;②患者的临床病理资料及随访资料完整;③患者均为初次诊治,既往未接受过放化疗等抗肿瘤治疗。排除标准:①伴有严重的心肝肾等脏器功能不全;②合并其他器官系统的恶性肿瘤;③患者处于孕期或者哺乳期。癌症组患者年龄29~72(49.1±10.1)岁;病理类型:子宫内膜样腺癌62例,黏液/浆液性腺癌23例;肿瘤直径:≤5 cm者49例,>5 cm者36例;分化程度:高分化25例,中分化27例,低分化33例;参考2009年国际妇产科联盟FIGO标准进行分期[9],Ⅰ~Ⅱ期57例,Ⅲ~Ⅳ期28例;肌层浸润深度:浅肌层60例,深肌层25例;伴淋巴结转移20例,不伴淋巴结转移65例。以同期诊治的40例子宫肌瘤患者作为对照组,年龄28~69(49.3±9.3)岁。纳入标准:①经病理检查明确诊断为子宫肌瘤;②既往未接受过其他治疗。癌症组与对照组年龄比较差异无统计学意义。
1.2 血清中LncRNA ROR与miR-29a相对表达量检测 采用qRT-PCR法检测所有研究对象术前血清中的LncRNA ROR、miR-29a。抽取研究对象清晨空腹静脉血标本5 mL,置于枸橼酸钠抗凝管中,4 ℃下3 000 r/min离心10 min,取上清血清-80 ℃保存待测。提取血浆中总RNA:取约300 μL样品,按TRIzol和样品体积比例3∶1加入TRIzol,混匀后静置5 min,加入200 μL氯仿沉淀蛋白,混匀后静置10 min,4 ℃下12 000 r/min离心10 min,取上层水相加入异丙醇500 μL沉淀RNA,4 ℃下12 000 r/min离心10 min,去上清保留底部白色沉淀RNA,75%乙醇洗涤RNA,4 ℃下7 500 r/min离心5 min,吸弃上清,室温下干燥RNA,50 μL的DEPC水溶解,并鉴定RNA的浓度及纯度。以1 μg RNA为模板反转录为cDNA,实验步骤严格按照TaKaRa反转录试剂盒进行。反转录条件:37 ℃ 15 min,85 ℃ 5 s,得到的cDNA 4 ℃保存。qRT-PCR反应体系为cDNA 0.2 μL,2×SYBR 5 μL,ROXⅡ 0.2 μL,上游和下游引物各0.5 μL,RNA-free水3.6 μL。反应条件为:95 ℃预变性5 min,95 ℃变性30 s,62 ℃退火30 s,70 ℃延伸30 s,变性退火延伸共40个循环。LncRNA ROR正向引物序列:5′-CCAGGACAATGAAACCAC-3′,反向引物序列:5′-AGGAGCCCAAAGTAACAG-3′;内参基因GAPDH正向引物序列:5′-GGTGAAGGTCGGAGTCAACG-3′,反向引物序列:5′-CAAAGTTGTCATGGATGHACC-3′。miR-29a正向引物序列:5′-CTGAGTTTCTATTTAGACACTACAACA-3′,反向引物序列:5′-ACAATTTGACATGTGGCATTAACG-3′;内参基因U6正向引物序列:5′-CTCGCTTCGGCAGCACA-3′,反向引物序列:5′-AACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt法计算目的基因相对表达量。
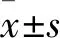
2 结果
2.1 两组血清LncRNA ROR、miR-29a表达比较 癌症组血清中LncRNA ROR、miR-29a的相对表达量分别为1.86±0.23、0.60±0.14,对照组分别为1.09±0.17、1.27±0.22,癌症组血清中LncRNA ROR的相对表达量高于对照组(t=18.870,P=0.000),癌症组血清中miR-29a的相对表达量低于对照组(t=20.615,P=0.000)。癌症组血清中LncRNA ROR、miR-29a的表达呈明显负相关(r=-0.634,P=0.001)。
2.2 癌症组患者血清中LncRNA ROR、miR-29a表达与临床病理参数的关系 癌症组患者血清中LncRNA ROR、miR-29a表达与肿瘤临床分期有关(P均<0.05),而与年龄、病理类型、肿瘤大小、分化程度、肌层浸润深度、是否伴淋巴结转移无关(P均>0.05)。见表1。
2.3 血清LncRNA ROR、miR-29a单独及联合检测对子宫内膜癌的诊断价值 血清LncRNA ROR诊断子宫内膜癌的ROC曲线下面积为0.762(95%CI:0.676~0.859),截断值为1.4时,诊断子宫内膜癌的敏感度为0.753,特异度为0.701,约登指数为0.454;血清miR-29a诊断子宫内膜癌的ROC曲线下面积为0.805(95%CI:0.794~0.917),截断值为1.0时,诊断子宫内膜癌的敏感度为0.780,特异度为0.748,约登指数为0.528。采用临床实用的综合联合诊断模式:仍使用两指标各自的诊断阈值,两指标同为阳性或阴性时做阳性或阴性诊断,否则进行复测。若复测结果不变,则结合专业实践及医师观点进行诊断并侧重考虑miR-29a指标(其敏感度和特异度均较高)。两者联合诊断的敏感度为0.824,特异度为0.800,约登指数为0.624。
3 讨论
子宫内膜癌是起源于子宫内膜上皮组织的恶性肿瘤。随着我国社会经济的发展、人民生活水平的提高,子宫内膜癌发病率亦有逐渐增加的趋势。子宫内膜癌的病因尚不清楚,肥胖、糖尿病及高血压是子宫内膜癌重要的危险因素。子宫内膜癌发病机制是学者研究的热点,子宫内膜癌的发生发展是遗传因素和环境因素共同作用的结果,而癌基因的激活、抑癌基因的失活、染色体杂合性缺失、染色质构象的改变等机制均参与子宫内膜癌的发生发展的过程[10]。近年来新的放化疗等辅助治疗的发展改善了子宫内膜癌的治疗效果,但部分患者术后仍有复发转移的风险。因此,有必要深入研究子宫内膜癌发生发展的关键分子生物标志,寻找具有临床意义诊断治疗靶点。

表1 癌症组患者血清中LncRNA ROR、miR-29a表达与临床病理参数的关系
随着高分辨率微阵列和大规模平行测序技术的发展,lncRNA在人类肿瘤发生和发展过程中发挥重要作用。LncRNA ROR最早在诱导性多能干细胞(iPSCs)中被发现,在多种生物过程中起调节分子的作用。LncRNA ROR在许多类型的癌症(包括乳腺癌、胰腺癌、肝细胞癌、子宫内膜癌和鼻咽癌等[11])中表达失调。然而,LncRNA ROR在肿瘤中的潜在机制及其临床意义仍有待阐明。本研究中,癌症组患者血清中LncRNA ROR的相对表达量高于对照组,目前具体机制尚不清楚。LncRNA ROR基因位于18q21.31,其基因启动子序列含LINE、SINE和LTR元件,肿瘤发生时细胞内多能转录因子如Oct4、Sox2和Nanog结合LncRNA ROR基因启动子区域,促进LncRNA ROR表达[12]。此外,子宫内膜癌血清中LncRNA ROR的表达与肿瘤分期有关,Ⅲ~Ⅳ期血清中LncRNA ROR的表达明显较高。结果表明子宫内膜癌血清中LncRNA ROR表达参与子宫内膜癌的发生发展。其机制一方面是LncRNA ROR能够直接抑制P53蛋白功能,阻断P53的DNA损伤修复作用,过度激活下游癌基因,导致肿瘤细胞无限增殖,肿瘤分期增高[13]。另一方面,LncRNA ROR可作为内源竞争性RNA(ceRNA)抑制miR-205活性,导致miR-205对上皮间质转化基因如ZEB1、ZEB2表达抑制作用减弱,促进肿瘤的恶性增殖[14]。
miRNA是一种短的非编码RNA调控分子,miRNA基因经RNA聚合酶Ⅱ转录后形成前体miRNA,在Dicer核糖核酸酶剪切下形成成熟miRNA,参与构成RISC后,以碱基互补配对的方式结合靶基因mRNA的3′UTR,改变靶基因mRNA的稳定性调控基因表达。研究表明,miR-29a作为一种潜在的肿瘤抑制性miRNA,在喉癌等多种肿瘤中起调节作用,miR-29a可通过靶向抑制PROM1基因的表达抑制肿瘤细胞的增殖[15]。本研究中,癌症组患者血清中miR-29a的表达低于对照组,表明子宫内膜癌患者血清中miR-29a表达下降。其原因与c-myc、核因子-κB对miR-29a基因表达调控作用有关。研究表明,肿瘤发生时细胞内c-myc、核因子-κB表达升高,Hedgehog信号通路激活,通过结合miR-29a基因启动子区,抑制miR-29a基因的表达[16]。本研究中,Ⅲ~Ⅳ期子宫内膜癌患者血清中miR-29a表达明显较低,表明miR-29a表达与肿瘤分期有关。其原因可能是miR-29a能够直接结合并抑制微管成核因子2(TPX2)的表达,而TPX2表达具有抑制肿瘤细胞恶性增殖的能力,miR-29a表达降低后对TPX2抑制作用减弱,结果肿瘤细胞的增殖明显增强[17]。本研究中子宫内膜癌患者血清中LncRNA ROR与miR-29a表达呈显著负相关,其原因可能是LncRNA ROR表达升高后,可作为内源竞争性RNA结合并抑制miR-29a的肿瘤抑制功能,发挥促进肿瘤进展的作用[18],但其二者具体作用机制有待进一步深入研究。
临床上肿瘤多为散发性,寻找无创或微创并且具有较高敏感性和器官特异性的血清诊断标志物,有助于子宫内膜癌的早期诊断,从而早期治疗,对提高患者的生存预后具有重要意义。本研究进一步分析血清LncRNA ROR、miR-29a及两者联合检测在子宫内膜癌中的诊断价值,结果血清LncRNA ROR、miR-29a联合检测的敏感度、特异度均高于单一指标,表明联合检测的诊断效能较高,两者联合检测诊断的敏感性高于任一单一指标,表明联合检测血清LncRNA ROR、miR-29a对于子宫内膜癌患者具有较高的诊断价值,可能有助于提高子宫内膜癌诊断的准确性。但由于损伤、感染及免疫等因素均可能影响血清非编码RNA的水平[19],并且本研究样本含量较小,联合检测血清LncRNA ROR、miR-29a对子宫内膜癌的诊断价值,尚需大样本、多中心的随机对照试验深入研究。
综上所述,子宫内膜癌患者血清中LncRNA ROR表达上调,而miR-29a表达下调,两者表达与肿瘤分期有关,联合检测血清LncRNA ROR、miR-29a对子宫内膜癌具有较高的诊断价值,有望成为新的诊断子宫内膜癌的肿瘤标志物。

