急性脑梗死患者血浆β-淀粉样蛋白水平变化及临床意义
刘金城,姚璇,冯玉华,冯文敏,周佩洋
(1锦州医科大学湖北医药学院,湖北十堰 442000;2湖北医药学院附属襄阳市第一人民医院)
急性脑梗死是由于局部脑血管动脉粥样硬化使管腔狭窄或者形成的粥样硬化斑块脱落堵塞血管引起脑组织供血不足所致的脑组织坏死,以及由此引发的神经功能损伤等[1]。急性脑梗死发病急骤、病情危重、致残率和病死率高、预后较差[2],早期诊断急性脑梗死并评估其病情的严重性,可为临床制定有效的治疗方案来改善患者预后提供参考。CT、MRI是早期诊断急性脑梗死的重要手段,但是受限于患者病情特殊,无法准确有效评估病情严重性,也不能预测预后。因此,寻找灵敏、特异的生化标志物辅助临床诊治急性脑梗死成为研究热点。β-淀粉样蛋白(Aβ)是主要由脑组织产生的氨基酸片段,Aβ40、Aβ42含量最多;Aβ具有神经毒性,通过诱导自由基损伤、炎症反应以及氧化应激等减少突触而损伤神经元,破坏神经网络,导致脑损伤[3,4]。已有研究显示,Aβ与阿尔茨海默病发病及进展密切相关,可作为评估颅脑损伤病情严重性的指标[5,6]。本研究探讨血浆Aβ水平与急性脑梗死患者神经功能损伤及脑梗死体积的关系,并评估其预测患者预后的价值。
1 资料与方法
1.1 临床资料 选择2017年9月~2018年12月湖北医药学院附属襄阳市第一人民医院收治的急性脑梗死患者93例(观察组),男57例、女36例,年龄(56.89±11.33)岁,BMI(23.16±2.08)kg/m2;糖尿病史24例、高血压史46例、吸烟史28例,发病至入院时间(18.34±6.29)h。按照神经功能缺损程度[7]分为轻度组(NIHSS评分≤5分)39例,中度组(5分
1.2. 血浆Aβ40、Aβ42水平检测 采集观察组患者入院后或对照组体检当日外周静脉血5 mL,置于含EDTA的抗凝管中,静置2 h后以3 000 r/min的转速离心,离心半径12 cm,持续时间20 min,将血浆置于EP管中,-80 ℃环境下保存。血浆Aβ40、Aβ42水平采用酶联免疫吸附法检测,试剂盒由南京森贝伽生物科技有限公司提供。严格按照试剂盒说明进行相关操作。
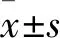
2 结果
2.1 观察组与对照组血浆Aβ40、Aβ42水平比较 两组血浆Aβ40、Aβ42水平比较,差异均有统计学意义(t=20.673、-36.112,P均<0.05)。观察组血浆Aβ40水平高于对照组,血浆Aβ42水平低于对照组。见表1。

表1 观察组与对照组血浆Aβ40、Aβ42水平比较
注:与对照组比较,*P<0.05。
2.2 不同神经功能缺损程度急性脑梗死患者血浆Aβ40、Aβ42水平比较 不同神经功能缺损程度急性脑梗死患者血浆Aβ40、Aβ42水平比较差异有统计学意义(F=104.859、108.429,P均<0.05);轻度组、中度组、重度组血浆Aβ40水平依次增高,Aβ42水平依次降低,两两比较,差异均有统计学意义(P均<0.05)。见表2。
2.3 不同梗死体积急性脑梗死患者血浆Aβ40、Aβ42水平比较 不同梗死体积急性脑梗死患者血浆Aβ40、Aβ42水平比较差异有统计学意义(F=63.514、65.983,P均<0.05);小体积梗死组、中体积梗死组、大体积梗死组血浆Aβ40水平依次增高,血浆Aβ42水平依次降低,两两比较,差异均有统计学意义(P均<0.05)。见表3。
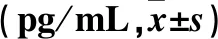
表2 不同神经功能缺损程度急性脑梗死患者血浆Aβ40、Aβ42水平比较
注:与轻度组比较,*P<0.05;与中度组比较,#P<0.05。
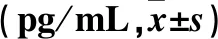
表3 不同梗死体积急性脑梗死患者血浆Aβ40、Aβ42水平比较
注:与小体积梗死组比较,*P<0.05;与中体积梗死组比较,#P<0.05。
2.4 不同预后急性脑梗死患者血浆Aβ40、Aβ42水平比较 不同预后急性脑梗死患者血浆Aβ40、Aβ42水平比较,差异有统计学意义(t=-18.163、23.365,P均<0.05),预后良好组血浆Aβ40水平低于预后不良组,血浆Aβ42水平高于预后不良组。见表4。
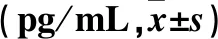
表4 不同预后急性脑梗死患者血浆Aβ40、Aβ42水平比较
注:与预后不良组比较,*P<0.05。
2.5 急性脑梗死患者血浆Aβ40、Aβ42与NIHSS评分、脑梗死体积的关系 经Pearson积矩相关分析,急性脑梗死患者血浆Aβ40水平与NIHSS评分、脑梗死体积呈正相关关系(r=0.793、0.725,P均<0.05),血浆Aβ42水平与NIHSS评分、脑梗死体积呈负相关关系(r=-0.769、-0.751,P均<0.05)。
2.6 血浆Aβ40、Aβ42对急性脑梗死患者治疗90 d的预后预测价值 Aβ40预测急性脑梗死预后的AUC为0.893(95%CI:0.844~0.943),截断值为337.16 pg/mL,灵敏度、特异度分别为0.89、0.85,准确性为0.85;Aβ42预测急性脑梗死预后的AUC为0.858(95%CI:0.798~0.919),截断值为122.29 pg/mL,灵敏度、特异度分别为0.87、0.80,准确性为0.81;Aβ40联合Aβ42预测急性脑梗死预后的AUC为0.940(95%CI:0.907~0.973),灵敏度和特异度分别为0.93和0.91,准确性为0.89。
3 讨论
流行病学调查表明,我国每年有超过250万例新发脑卒中患者,每年病死人数高达100万例,脑卒中已成为严重威胁人类健康的重大公共卫生问题[9,10]。急性脑梗死占脑卒中发病人数的60%~80%,是脑卒中的主要类型[11]。急性脑梗死起病急,短时间内就可引发炎症反应、自由基损伤、氧化应激以及神经元凋亡等系列瀑布式病理生理学级联反应,并且病情进展迅速,坏死病灶快速扩大而损伤神经功能,造成肢体功能以及语言不同程度障碍[12,13]。因此,寻找有效的指标辅助评估急性脑梗死患者入院时的脑梗死体积和神经功能缺损程度具有重要意义。
Aβ是由中枢神经系统的胶质细胞以及血小板的淀粉样前体蛋白(APP)经β-分泌酶及γ-分泌酶降解后的产物,包括Aβ40和Aβ42两种主要亚型。Aβ表达上调对神经具有很强的毒性,可诱发病理级联反应,如炎症反应、自由基损伤、细胞凋亡以及氧化应激等[14]。研究显示,在阿尔茨海默病发病过程中,Aβ作为共同通路发挥关键作用,机制为Aβ水平升高破坏血脑屏障后在脑组织沉积,导致淀粉样斑块形成,使中枢神经系统发生退行性改变;同时Aβ还可通过级联反应减少突触而损伤神经元,破坏神经网络而引起中枢整合功能障碍[15,16]。研究还发现,Aβ不仅参与了阿尔茨海默病的发生及进展,而且可通过增加血管收缩力损伤血管内皮细胞,Aβ沉积抑制新生血管形成损害血管张力等,与血管性相关疾病如冠心病、动脉粥样硬化以及高血压等密切相关[17,18]。APP在脑缺血后表达异常升高,β-分泌酶的活性显著增强,造成脑组织中Aβ大量生成并沉积。Aβ在急性脑梗死患者血液中能大量检测,并由此推断其与脑梗死灶体积、NIHSS评分密切相关[19]。Liu等[20]研究发现,急性脑梗死患者Aβ水平升高,但其与NIHSS评分无关。
本研究结果显示,与健康体检者比较,急性脑梗死患者血浆Aβ40显著升高,血浆Aβ42水平降低,提示两指标可能与急性脑梗死发病有关,可能是因为脑缺血损伤后神经元以及神经胶质细胞中的APP表达异常升高,导致Aβ增加。Aβ40约占Aβ的90%,Aβ40亲水性的特点致使其表达升高而发挥神经毒性作用;Aβ42约占Aβ的10%,具有疏水性,其水平降低更易使机体在脑缺血后形成Aβ寡聚体或者淀粉样斑块而导致神经系统功能的退行性改变;同时Aβ升高可进一步加重炎症反应,促使动脉粥样硬化斑块破裂、脱落形成血栓,加重急性脑梗死病情。本研究结果还显示,不同神经功能缺损程度的急性脑梗死患者血浆Aβ40、Aβ42存在显著差异,轻度、中度、重度神经功能缺损患者血浆Aβ40水平依次增高,Aβ42水平依次降低,提示血浆Aβ40、Aβ42与急性脑梗死患者神经功能缺损程度密切相关。因为脑组织中Aβ本身具有神经毒性,其异常改变在大脑神经元中沉积而损伤神经功能,同时Aβ还可诱发炎症反应,进一步加重神经功能损伤。不同梗死体积也是判断神经功能损伤的指标之一。本研究显示,脑梗死体积越大,Aβ40水平越高,Aβ42水平越低。Aβ可诱使血小板活化,并形成血栓,扩大脑梗死面积。上述结果提示,血浆Aβ40、Aβ42可作为反映急性脑梗死患者神经功能缺损以及脑梗死体积的重要指标。Pearson积矩相关分析显示,急性脑梗死患者血浆Aβ40水平与NIHSS评分、脑梗死体积呈正相关性,血浆Aβ42水平与NIHSS评分、脑梗死体积呈负相关性,说明Aβ可作为评估急性脑梗死病情严重性的指标,其中Aβ40水平越高,神经毒性作用越显著,神经功能损伤越严重,同时炎症反应也愈显著,可加速斑块脱落形成栓子,堵塞血管。随访患者治疗90 d的结局发现,预后良好的患者血浆Aβ40水平更低,Aβ42水平更高,表明两指标与急性脑梗死患者治疗90 d的预后有关。采用ROC曲线评估血浆Aβ40、Aβ42对预后的预测价值,结果显示两指标均能有效预测急性脑梗死患者治疗90 d的预后,并且联合预测的价值更高。
综上所述,血浆Aβ40、Aβ42异常改变参与了急性脑梗死的发病及进展,并与神经功能缺损程度、脑梗死体积及预后相关,早期联合检测可辅助临床评估病情严重性及预测预后,从而指导临床治疗。

