纳米t-PA基因涂层支架对犬冠状动脉损伤后血栓形成和再狭窄的影响
李军,章玲,梁新剑,周阳泱,曾碧媚,芦爱霞,赵洪磊
(1深圳市人民医院,广东深圳518000;2深圳市孙逸仙心血管病医院)
研究显示,支架内血栓形成、内膜过度增生是冠状动脉介入术急性和慢性再狭窄发生的病理生理基础。携带抗栓或抗增殖药物的新型药物涂层支架置入冠状动脉狭窄病变处,通过持续药物释放抑制内膜增生和血小板聚集,增加血管正重构,可减少血管再狭窄[1~3]。纤维蛋白诱导并激活组织型纤溶酶原激活物(t-PA),使纤溶系统激活,从而促进纤维蛋白降解,抗栓效果较强[4,5],而组织染色发现纳米t-PA基因可以获得支架血管壁和其周围组织t-PA有效表达[6]。2016年7月~2018年3月,本研究用纳米t-PA基因载体涂层支架置入犬冠状动脉,实现局部血管壁t-PA基因转染,观察其对犬冠状动脉血栓形成和支架再狭窄的影响。现报告如下。
1 材料与方法
1.1 主要材料 健康雄性家犬22只,体质量35~40 kg,由深圳大学动物实验中心提供;质粒pSecTag2B由亚能生物技术(深圳)有限公司保存;感受态细胞E Coli JM109购自Promega公司;CHO细胞系由香港城市大学深圳医药与生物研发中心提供;限制性内切酶Hind Ⅲ、KpnⅠ、Bam HI和XhoⅠ购自宝生物工程有限公司;Vent DNA聚合酶和T4 DNA连接酶购自New England Biolabs公司;QIAprep Spin Miniprep Kit、 QIAquick Gel Extraction Kit、QIAgen PCR Product Purification Kit购自QIAGEN公司;DNA marker DL 2000购自上海生工生物有限公司;DMEM、胎牛血清购自GIBCO公司;一抗(兔抗人tPA抗体)、二抗(FITC耦合的羊抗兔IgG抗体)、对照一抗(兔抗β-caterin抗体)由美国Burnham研究所提供。免疫组化检测试剂一抗(羊抗人t-PA多克隆抗体)、二抗(兔抗羊多克隆抗体)、牛血清白蛋白、t-PA ELISA检测试剂盒均由晶美生物工程有限公司提供;免疫组化试剂盒系DAKO公司产品。
1.2 白蛋白纳米t-PA基因涂层支架制备 首先构建t-PA基因真核高表达质粒,制备载t-PA基因白蛋白纳米粒。然后将支架浸泡于白蛋白纳米粒液中30 min,晾干后再置入血管基底膜涂层液中30 min,交替操作,使每个支架含有1 mg白蛋白纳米t-PA基因质粒涂层。
1.3 犬冠状动脉内膜损伤支架置入模型建立 22只犬采用5%戊巴比妥静脉麻醉(25 mg/kg)后,常规手术消毒铺巾,经皮穿刺股动脉留置6 F鞘管,通过导丝送入直径3.0 mm球囊导管至冠状动脉主要分支血管;球囊8~10个大气压扩张后,缓慢回撤,重复3次,造成血管内皮夹层形成甚至撕裂。术后动物均不用抗凝治疗,立即随机分为观察组12只和对照组10只,分别置入载基因支架和裸金属支架。
1.4 血液t-PA和D-二聚体含量检测 两组分别于术前及术后1、2、4、8周取血2 mL,采用Roche E170全自动电化学发光检测仪检测t-PA和D-二聚体含量,电化学发光试剂盒由德国罗氏公司提供。
1.5 血管内超声影像学检查 两组术后8周行冠状动脉造影检查,观察血管、支架形态及血管直径等情况,同时行血管内超声影像学检查。使用Boston血管内超声仪,导管直径为2.5 F,探头频率40 MHz,测量部位为支架内病变,利用导管自动回撤系统共测量3次,计算血管晚期管腔丢失、内膜增生面积、内膜增生容积等指标。
1.6 支架血管病理观察 8周后处死犬,取出心脏,经冠状动脉加压注射4%多聚甲醛适当固定,石蜡包埋切片,病理制片。苏木素-伊红染色法染色显微镜下观察局部血管腔内血栓形成、支架内血栓形成和血管壁病理改变,计算血栓形成率。内膜平滑肌细胞及增殖检测采用标记的链菌卵白素-生物素免疫组化法,一抗分别为鼠抗SMC α-actin和PCNA,观察纳米t-PA基因载体涂层支架犬冠状动脉内膜PCNA阳性细胞分布情况。
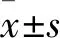
2 结果
2.1 两组手术前后血液t-PA、D-二聚体水平变化 两组术前血液t-PA、D-二聚体水平比较差异无统计学意义(P均>0.05);观察组置入支架后1、2、4、8周t-PA、D-二聚体水平均高于对照组(P均<0.05)。见表1。

表1 两组手术前后血液t-PA、D-二聚体水平比较
注:与对照组比较,*P<0.05。
2.2 两组术后冠状动脉血管内超声检查结果 支架置入术后8周对两组行血管内超声影像学检查,显示观察组支架管腔丢失、内膜增生面积、内膜增生容积均优于对照组,两组比较差异均有统计学意义(P均<0.05)。见表2。
2.3 支架血管病理改变和血管壁t-PA表达 肉眼及显微镜下观察,对照组10例血管支架内均可见血栓,血栓形成率100%;观察组12例中2例可见血栓,血栓形成率16.67%;两组血管支架内血栓形成率比较有统计学差异(P<0.05)。对照组支架冠状动脉内膜明显不规则增厚,内膜中增生细胞不规则,排列紊乱,细胞间基质堆积多,见散在炎性细胞。与对照组比较,观察组支架冠状动脉内膜明显变薄,内膜细胞多为长梭形,PCNA阳性细胞少;PCNA阳性细胞主要分布在增生的血管内膜表面,在血管中膜见散在和较弱阳性信号分布,而血管外膜PCNA阳性细胞染色阴性。
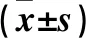
表2 两组术后冠状动脉血管内超声检查指标比较
注:与对照组比较,*P<0.05。
3 讨论
目前,单支架内再狭窄仍是冠心病介入治疗技术中难以回避的难题,其发生机制主要有下面几个方面:①血管弹性回缩。球囊扩张结束后血管在数分钟内发生急性反应,可造成血管壁的机械性塌陷,导致管腔直径的丢失。②血栓形成。球囊扩张及支架置入造成对血管壁的损伤,内皮下细胞外基质暴露,导致血小板聚集黏附,凝血酶激活,产生血管内附壁血栓。此外,内皮细胞的损伤还可促进纤溶酶抑制物、血栓素和血小板活化因子的产生,而肝素类物质及纤溶酶激活物合成和分泌减少,也可引起血管局部血栓。③平滑肌过度增生。血管损伤导致平滑肌细胞能从收缩表型转变为合成表型,复制能力增强,合成功能随着粗面内质网的增加而增强,参与血管损伤的组织修复。④炎症反应。球囊扩张及支架置入后血管损伤部位有大量单核巨噬细胞及T淋巴细胞浸润,并产生多种生长因子、趋化因子、细胞因子,进一步促进白细胞浸润,引起局部炎症反应。
从支架内再狭窄机制可以看出,内皮细胞的损伤导致肝素类物质及纤溶酶激活物合成和分泌减少,引起血管局部血栓是重要的再狭窄原因,而纳米t-PA基因载体涂层支架的设计充分利用这一特点。T-PA是另一类溶血栓药物,对血凝块的作用有相对特异性,通过其氨基末端附近的赖氨酸结合位点与纤维蛋白-纤溶酶原复合物高度亲和,而在没有纤维蛋白时活性相对较低。临床上已使用重组t-PA有效治疗急性心肌梗死和缺血性中风。t-PA的cDNA克隆成功使能够构建其逆转录病毒载体并体外转导内皮细胞获得t-PA高表达[7,8]。我们前期实验室构建了t-PA高表达基因质粒,体外转染CHO细胞可见t-PA蛋白高表达,并利用超声微泡技术实现了纳米基因载体的靶向兔血管壁转染,有效地抑制了裸金属支架术后早期血栓形成和内膜增生[9,10],基因治疗提供了局部t-PA较高的活性并避免了全身出血和血栓反弹[11,12]。
本研究在前期研究的基础上,对犬冠状动脉置入纳米t-PA基因载体涂层支架的效果行进一步观察。犬冠状动脉支架术的模型建立有较高的成功率及可操作性,且犬冠状动脉内径与人的冠状动脉相似[13],取材方便,成本低,并发症少,成功率高,本研究中犬在支架置入术后8周研究期间全部存活。结果显示犬冠状动脉置入纳米t-PA基因载体涂层支架后,内膜不仅无血栓负荷,而且内膜较薄,增生不明显,考虑这和纳米t-PA基因载体抑制了内膜平滑肌增生以及血栓形成有关。t-PA和D-二聚体血液浓度是常规反映血管血栓形成的指标,本结果显示t-PA和D-二聚体血液浓度在犬冠状动脉置入支架以后术后可以持续8周的高水平。犬冠状动脉血管内超声影像学检查结果显示,置入纳米t-PA基因载体涂层支架的犬冠状动脉支架内在支架官腔丢失方面明显较对照组减少,而内膜增生面积也远远小于对照组,这说明纳米t-PA基因载体涂层支架也可以有效的防止血管弹性回缩,可以有效保持血管通畅,防止血栓并发症的发生[14]。
综上所述,纳米t-PA基因载体涂层支架有效预防了支架术后血栓形成,且有效抑制冠状动脉支架内再狭窄,为新型药物t-PA基因载体涂层支架临床应用的提供了动物试验依据。

