LncRNA LIFR-AS1过表达对非小细胞肺癌细胞生物学性能的影响
林忠琨,李锴男,王雷
(山东省立第三医院,济南 250031)
肺癌已成为全球致死率最高的肿瘤[1~3],尽管治疗已取得了很大进步,但患者术后的复发率仍然较高,预后较差[4~6]。目前非小细胞肺癌(NSCLC)发生发展的确切分子机制尚不完全明确。长链非编码RNA(LncRNA)是一类长度大于200 nt,缺乏开放阅读框,不参与蛋白质编码的RNA[7]。已有研究表明,LncRNA可以通过影响RNA的转录、剪切、降解和翻译等生物学过程,从而影响细胞的增殖和转移[8]。许多研究发现LncRNA的异常表达与NSCLC的发生和进展密切相关[9,10]。白血病抑制因子受体反义RNA-1(LIFR-AS1)是一种新的肿瘤相关LncRNA,其在NSCLC细胞中的表达及其与细胞增殖、凋亡和转移之间的关系尚不明确。2018年7月~2019年7月,本研究观察了LIFR-AS1在正常细胞及NSCLC细胞中的表达情况,并进一步探讨了LIFR-AS1对A549细胞增殖、凋亡、侵袭、转移的影响。
1 材料与方法
1.1 材料 NSCLC细胞(A549、H226、SPCA1和H358)以及正常人支气管上皮细胞(BEAS-2B)购于中国科学院上海生命科学研究所。引物均由上海生工生物工程股份有限公司设计并合成;pcDNA3.1、pcDNA3.1-LIFR-AS1(上海吉玛制药技术有限公司);Transwell小室(美国Corning公司);TRIzol(美国Invitrogen公司);Lipofectamine2000转染试剂盒(Thermo Fisher公司,美国);PrimeScriptTMRT Reagent Kit(TaKaRa公司,日本);CCK-8试剂盒(Biosharp公司,中国);SYBRGreen qPCR Master Mix(TaKaRa公司,日本);AnnexinV-FITC/PI凋亡试剂盒(BD公司,美国);Dual-LuciferaseTM(Promega,美国)。
1.2 细胞培养 BEAS-2B细胞在BEGM培养基中进行培养。A549、H226、SPCA1和H358在含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI1640培养基中培养。所有细胞置于37 ℃、5% CO2培养箱中进行培养。
1.3 细胞中LIFR-AS1表达检测 采用实时荧光定量PCR法。按照TRIzol说明书中RNA提取方法提取A549、H226、SPCA1、H358以及BEAS-2B细胞的总RNA。逆转录参照PrimeScriptTMRT reagent Kit试剂盒说明进行,将1 μg RNA逆转录成cDNA。按SYBRGreen试剂说明进行PCR扩增。引物序列如下:LIFR-AS1上游引物为5′-TGGCCTCGGTTTTCTAGCAG-3′;下游引物为5′-TGTGCCGAAGAGAACACCAT-3′;GAPDH上游引物为5′-CCCTTCATTGACCTCAACTACA-3′;下游引物为5′-ATGACAAGCTTCCCGTTCTC-3′。PCR反应体系如下:1 μL cDNA,上下游引物各0.5 μL,10 μL SYBR Premix Ex Taq,8 μL ddH2O。反应条件:95 ℃下进行预变性5 min,之后在95 ℃(15 s)、60 ℃(34 s)条件下进行40个循环。以GAPDH作为内参,采用2-ΔΔCt法计算目的基因的相对表达量。实验重复3次,取平均值。A549、H226、SPCA1、H358和BEAS-2B中LIFR-AS1的相对表达量分别为0.91±0.02、1.21±0.04、1.24±0.05、1.15±0.02和1.96±0.05,NSCLC细胞中LIFR-AS1相对表达量均低于BEAS-2B细胞(P均<0.05)。A549细胞的LIFR-AS1表达量最低,选择A549细胞进行后续实验。
1.4 细胞转染 取2×105个A549细胞,将其接种于24孔培养板,加入500 μL不含抗生素的完全培养基培养过夜。取5 μL Lipofectamione2000置于250 μL Opti-MEM培养基中,混匀室温静置5 min。分别取1 μg的pcDNA3.1-NC或pcDNA3.1-LIFR-AS1置于250 μL的Opti-MEM培养基中,然后把含Lipofectamione2000的Opti-MEM培养基分别与含pcDNA3.1-NC或含pcDNA3.1-LIFR-AS1的Opti-MEM培养基混匀,室温静置25 min。将质粒混合液分别加入每孔的细胞中,轻轻混匀,放培养箱中培养,分别标记为pcDNA-NC组和pcDNA-LIFR-AS1组。12 h后更换含10%胎牛血清的完全培养基。48 h后使用实时荧光定量PCR法检测转染效率,结果如下:pcDNA-LIFR-AS1组LIFR-AS1相对表达量为5.34±0.22,高于pcDNA-NC组的0.93±0.03(P<0.05),可进行后续实验。
1.5 细胞增殖能力检测 采用CCK-8法。转染48 h后,胰酶消化pcDNA-NC组和pcDNA-LIFR-AS1组A549细胞,制成单细胞悬液。取100 μL细胞悬液,以每孔1 000个细胞的标准种到96孔板中,将所有细胞置于37 ℃、5% CO2的培养箱中进行常规培养。分别培养0、24、48、72 h后,每孔加入10 μL CCK-8,在培养箱中孵育1 h后,使用酶标仪检测450 nm处的OD值,重复3次,取平均值。细胞增殖率=OD值(24、48、72 h)/OD值(0 h)×100%。
1.6 细胞凋亡检测 采用AnnexinV-FITC法。用不含EDTA的胰酶对转染48 h后的pcDNA-NC组和pcDNA-LIFR-AS1组的A549细胞进行消化;取5×104个细胞,加入Binding Buffer让细胞重新悬浮并将其转移到流式管中;加入5 μL的AnnexinV-FITC到流式管中,混匀后于室温避光条件下孵育15 min,上机前5 min加入5 μL PI进行染色,流式细胞仪检测细胞凋亡。实验重复3次,取平均值。
1.7 细胞迁移与侵袭能力检测 采用Transwell法。将质粒转染48 h后的pcDNA-NC组和pcDNA-LIFR-AS1组的A549细胞用无血清培养基制备成单细胞悬液,然后将100 μL细胞悬液加入到Transwell小室的上室中。下室中加入500 μL含10% FBS的完全培养基。将小室置于37 ℃、5% CO2培养箱中培养24 h,取出小室,用棉签擦掉上室中残余的细胞,PBS洗小室1遍,使用4%多聚甲醛固定,0.1%的结晶紫染色。PBS洗后,在显微镜下随机选取5个视野,对其进行拍照观察以及计数。当检测细胞的侵袭能力时,首先将Matrigel胶按1∶8稀释,然后包被Transwell小室底部膜的上室面,置37 ℃培养箱30 min,使Matrigel聚合成凝胶,然后将100 μL细胞悬液加入到Transwell小室的上室中,进行后续的细胞穿梭实验。
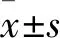
2 结果
2.1 LIFR-AS1过表达对A549细胞增殖的影响 见表1。

表1 过表达LncRNA LIFR-AS1对A549细胞增殖的影响
注:与pcDNA-NC组相比,*P<0.05。
2.2 LIFR-AS1过表达对A549细胞凋亡的影响 pcDNA-NC组、pcDNA-LIFR-AS1组细胞凋亡率分别为(3.18±0.21)%、(10.78±1.23)%,两组相比P<0.05。
2.3 LIFR-AS1过表达对A549细胞迁移和侵袭能力的影响 pcDNA-NC组和pcDNA-LIFR-AS1组细胞迁移数分别为(228±25)、(108±18)个,细胞侵袭数分别为(325±30)、(210±28)个,两组相比P均<0.05。
3 讨论
LncRNA尽管没有编码蛋白质的功能,但其通过调控相关功能基因的表达,对细胞增殖、凋亡、衰老和迁移等细胞学行为产生一定的影响[11]。Cui等[12]发现,LncRNA SNHG1通过靶向miR-101-3p/Wnt/β-catenin信号通路促进NSCLC的迁移和侵袭。LncRNA MALAT1通过miR-206调控Akt/mTOR通路,促进NSCLC的增殖、迁移和侵袭[13]。LncRNA UCA1通过海绵吸附作用调控miR-193a-3p从而促进NSCLC的进展[14]。因此,LncRNA作为重要的调控因子,已成为NSCLC的研究热点。
LIFR-AS1是与肿瘤进展密切相关的一种新的LncRNA,它以反义的方式从人类染色体5p13.1上的LIFR基因中转录出来[15]。最近的研究表明LIFR-AS1的异常表达与某些肿瘤的发病及预后密切相关。Okamura等[16]的研究发现LIFR-AS1可以抑制肝癌细胞的增殖和迁移,是肝癌不良预后的重要指标。但是LIFR-AS1在NSCLC细胞中的表达及其对NSCLC细胞生物学行为的影响尚未见报道。本研究首次探讨了LIFR-AS1在NSCLC细胞中的表达及其在NSCLC进展中的作用。
本研究结果表明LIFR-AS1在NSCLC细胞(A549、H226、SPCA1和H358)中的表达低于正常细胞(BEAS-2B)。当在NSCLC细胞A549中过表达LIFR-AS1,LIFR-AS1可以抑制A549细胞的增殖、促进细胞的凋亡。细胞的无限增殖和凋亡受阻是肿瘤细胞的主要特征,LIFR-AS1表达下调可能是引起NSCLC细胞无限增殖的原因之一。侵袭和转移是造成绝大多数肿瘤相关死亡的重要原因,本研究进一步观察了LIFR-AS1过表达对A549细胞迁移和侵袭的影响,结果表明过表达LIFR-AS1可以明显抑制A549细胞的迁移和侵袭能力,这就说明LIFR-AS1在控制NSCLC转移过程中发挥重要作用。以上研究表明在NSCLC细胞中LIFR-AS1可以作为抑癌基因发挥作用,但是LIFR-AS1影响NSCLC细胞生物学行为的分子机制尚不明确。Xu等[17]研究发现LIFR-AS1可以与miR-197-3p相互作用,上调肿瘤抑制基因Sufu的表达,从而抑制乳腺癌细胞的生长和增殖。此外,Liu等[15]发现LIFR-AS1可以作为竞争性内源RNA与miR-29a相互作用,下调TNFAIP3的表达,从而降低结肠癌治疗中对PDT的抗药性。对于NSCLC细胞中LIFR-AS1发挥作用的具体分子机制将是我们以后的研究方向。
综上所述,NSCLC细胞中LIFR-AS1表达下调,过表达LIFR-AS1可以抑制NSCLC细胞的增殖和迁移侵袭能力,促进细胞凋亡。LIFR-AS1有可能成为NSCLC诊断和治疗的新靶点。

