siRNA下调RYR1表达对小鼠成肌细胞中线粒体的影响*
王天爽, 张 静, 任雅丽, 常杏芝△
(北京大学第一医院 1儿科, 2电镜室, 北京 100034)
骨骼肌雷诺丁受体1(ryanodine receptor 1,RYR1)基因编码的RyR1蛋白是骨骼肌内质网上重要的钙通道,参与骨骼肌的兴奋收缩偶联。RYR1突变是最常见的先天性肌病中央轴空病(central core disease,CCD)最主要的致病原因。中央轴空病特征性的病理改变为肌纤维在氧化酶染色时存在不着色的轴空样区域,超微病理检查发现轴空区域内线粒体明显减少或缺失[1]。RYR1突变导致肌纤维轴空区域内线粒体缺失的发病机制尚不明确。线粒体融合蛋白2(mitofusin 2,Mfn2)是调节细胞内线粒体稳态的最重要的蛋白之一[2],受上游过氧化物酶体增殖物激活受体γ辅激活因子 1α(peroxisome proliferator-activated receptor-γ coactivator 1α,PGC- 1α)蛋白的调控[3]。Mfn2的N端有Ras结合结构域,能够调节Ras相关信号通路,如Mfn2可以与Ras结合后抑制其活化,进而抑制Ras介导下游细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)氧化应激通路的激活[4]。有文献报道ERK1/2通路参与了RYR1突变所致的疾病发生过程[5]。因此,推测Mfn2及其下游相关氧化应激通路参与了RYR1突变所致骨骼肌内线粒体缺失的发生。本研究中,我们采用小干扰RNA(small interfering RNA,siRNA)敲减小鼠成肌细胞C2C12中RYR1的表达,观察线粒体数目及形态的改变,以及PGC-1α、Mfn2及其下游信号通路的标志分子ERK1/2及其磷酸化蛋白的变化,探讨RYR1表达下调对于线粒体形态和数目的影响及其机制。
材 料 和 方 法
1 主要实验材料、仪器和试剂
小鼠成肌细胞系C2C12购自国家实验细胞资源共享平台。Olympus光学显微镜(Olympus);透射电子显微镜(JEOL-1230);ABI 7500 Real-Time PCR System和Power SYBR Green PCR试剂盒(Life)。PGC-1α抗体和Mfn2抗体(Abcam);ERK1/2抗体和p-ERK1/2抗体(Cell Signaling Technology);GAPDH抗体、山羊抗兔IgG/辣根过氧化物酶标记和山羊抗小鼠IgG/辣根过氧化物酶标记(北京中杉金桥生物技术有限公司);化学发光液(Thermo);TRIzol reagent、Lipofectamine 3000 Reagent转染试剂(Invitrogen);逆转录试剂盒(北京全式金生物技术有限公司)。
2 方法
2.1siRNA设计合成 从NCBI数据库中获取小鼠RYR1编码序列(Gene ID: 20190;mRNA:NM_009109.2),由北京柏林罗核酸技术有限公司合成RYR1干扰序列RYR1-siRNA(5’-GCGAUGAUCUCUAUUCUUATT-3’)和非靶向的阴性对照序列NC-siRNA(5’-UUCUCCGAACGUGUCACGUTT-3’)。
2.2实验分组 本实验分3组,即RYR1敲减(knock-down,KD)组和阴性对照(negative control,NC)组及空白对照(blank control,BC)组。
2.3C2C12细胞的培养方法 C2C12细胞常规培养于生长培养基(DMEM+10%胎牛血清+1%双抗)中,诱导分化时换为分化培养基(DMEM+2%马血清+1%双抗),37 ℃、5% CO2培养箱中培养。
2.4siRNA转染 转染前24 h铺板,C2C12细胞按照每孔5×105的密度接种于6孔板中,当细胞生长至70%时,分别转染RYR1-siRNA和NC-siRNA。转染培养6 h后换分化培养基诱导细胞分化为骨骼肌细胞,诱导5 d后收集细胞。
2.5C2C12细胞的电镜标本制备和图片摄取 收集细胞于15 mL离心管中,1 000 r/min离心4 min,弃上清,加入2 mL PBS重悬,吹打清洗,收集于2 mL离心管中。再次3 000 r/min离心10 min,弃上清,重复上述步骤2次后,弃上清,沿离心管侧壁缓缓加入1%戊二醛固定液1.5 mL,4 ℃固定2 h以上,送北京大学第一医院电镜室进行标本处理和制备。在透射电子显微镜(JEOL-1230)下,设置放大倍数为20 000倍,选择反差效果好、无污染及损坏的部位,随机选取视野进行拍照,每例标本拍摄不少于10张照片且拍摄的线粒体总数不少于100个。每组独立重复6次实验,每组拍摄照片不少于60张。
2.6线粒体体视学分析 将电镜照片输入图像分析软件(Analysis Image Processing)中,将每张图片中的线粒体轮廓勾勒出来,计数线粒体的数目,并测量线粒体的面积、周长、形状因子和最大长宽比。
2.7Real-time PCR检测C2C12细胞内RYR1、PGC-1α、Mfn2、ERK1/2和GAPDH的mRNA表达 根据real-time PCR引物合成要求,使用Primer 3软件进行引物设计,由天一辉远生物科技有限公司合成。Real-time PCR所用引物序列见表1。采用TRIzol法进行C2C12细胞的RNA提取,逆转录为cDNA。逆转录条件设置为25 ℃ 10 min,42 ℃ 30 min,85 ℃ 5 s。Real-time PCR条件设置为: 95 ℃ 10 s; 95 ℃ 5 s,60 ℃ 34 s,共40个循环。熔解曲线条件为:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。结果用2-ΔΔCt法进行计算。
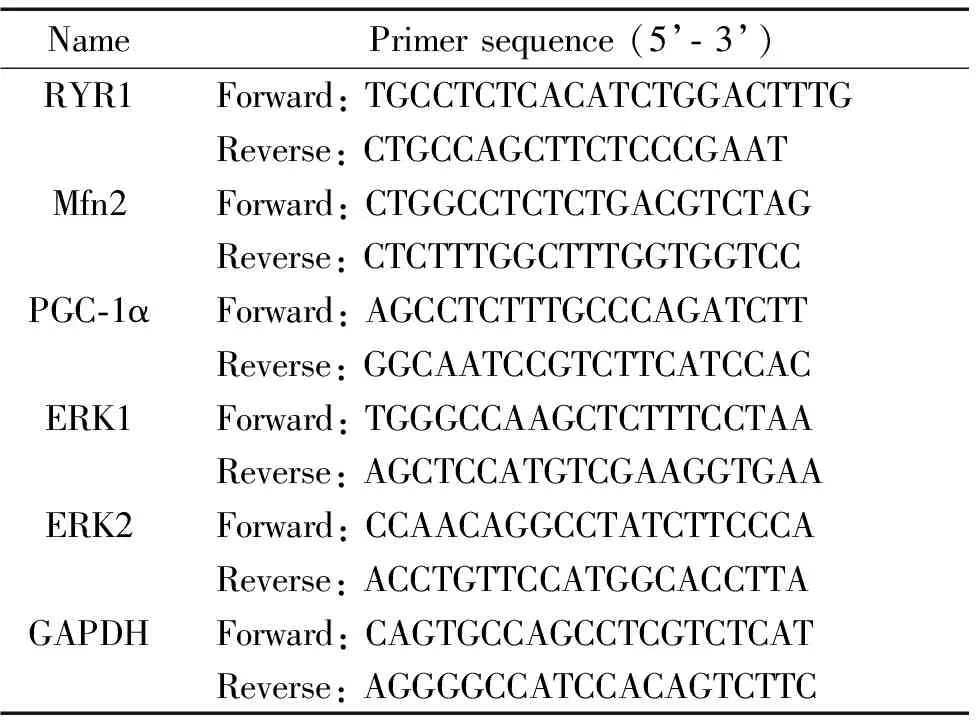
表1 Real-time PCR所用引物序列
2.8Western blot法检测PGC-1α、Mfn2、ERK1/2、p-ERK1/2和GAPDH的蛋白水平 利用RIPA裂解液裂解细胞,提取细胞蛋白,进行聚丙烯酰胺凝胶电泳,转膜、5%脱脂奶粉封闭1 h、 I 抗4 ℃孵育过夜、 II 抗室温孵育1 h后化学发光。应用ImageJ分析软件分析条带光密度值,结果用GAPDH进行校正。
3 统计学处理
数据采用SPSS 20.0统计软件进行处理。结果用均数±标准误(mean±SEM)表示,多组间比较采用单因素方差分析(one-way ANOVA),多组间两两比较采用Tukey检验,以P<0.05为差异有统计学意义。
结 果
1 siRNA转染后RYR1 mRNA表达的改变
Real-time PCR检测RYR1的mRNA表达,结果显示NC组与BC组RYR1的mRNA水平差异无统计学显著性,而KD组RYR1的mRNA表达较NC组明显下降(P<0.01),敲减效率约为70%,见图1。
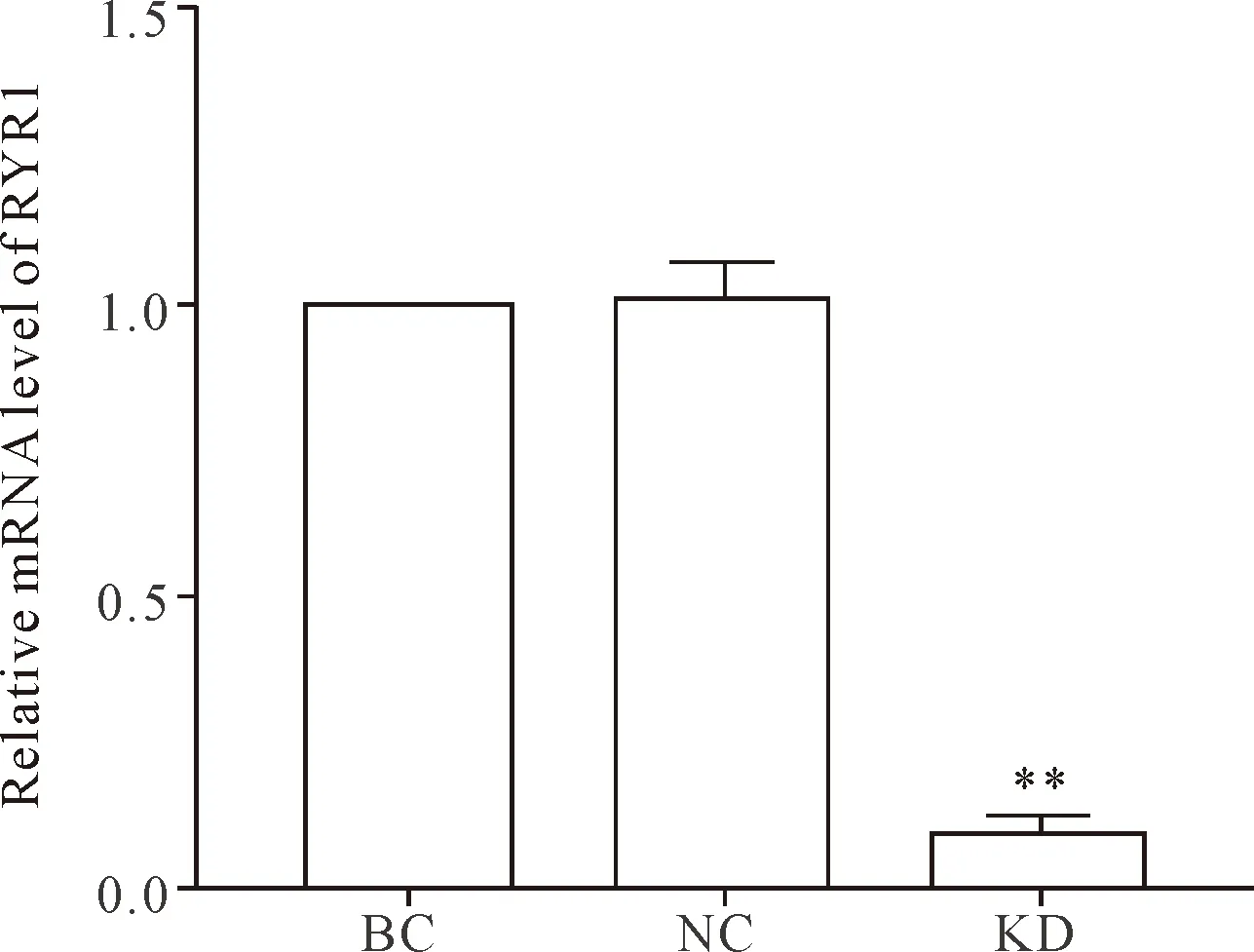
Figure 1.The mRNA expression of RYR1 in the C2C12 cells. Mean±SEM. n=8. **P<0.01 vs NC group.
2 C2C12细胞内线粒体超微结构的变化
电镜下,可见NC组及BC组的线粒体表现为长管状结构,而KD组C2C12细胞内线粒体呈明显碎片化改变,见图2。线粒体体视学分析结果显示,NC组与BC组在线粒体数目、面积、周长、形状因子及最大长宽比等方面,差异无统计学显著性。与NC组相比,KD组线粒体数目呈增加的趋势,但差异并无统计学显著性;线粒体面积和周长均显著减少(P<0.05),而线粒体形状因子和最大长宽比两组间差异无统计学显著性,见表2。
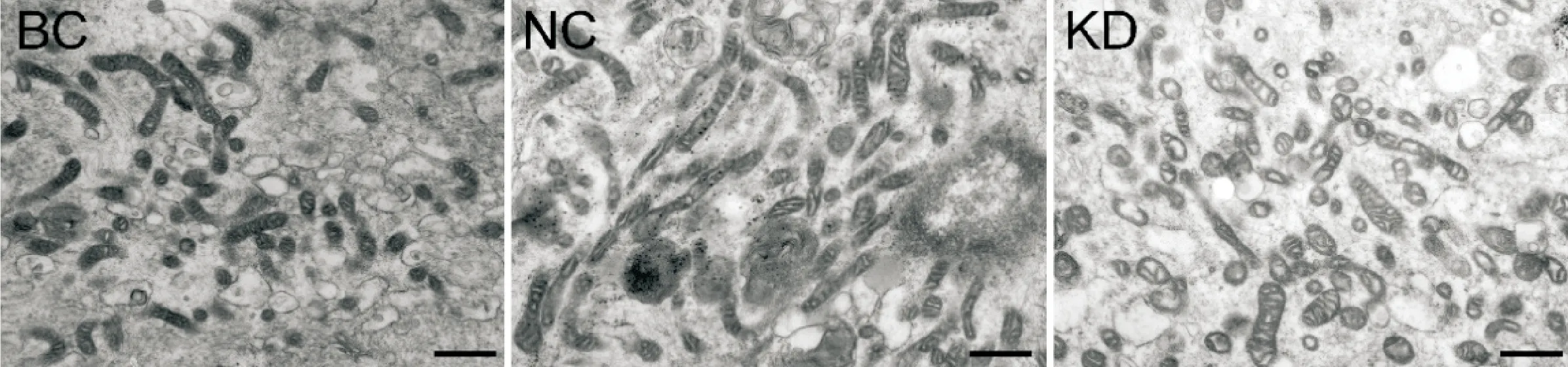
Figure 2.The changes of mitochondrial ultrastructure of the C2C12 cells in KD, NC and BC groups. Scale bar=0.5 μm.
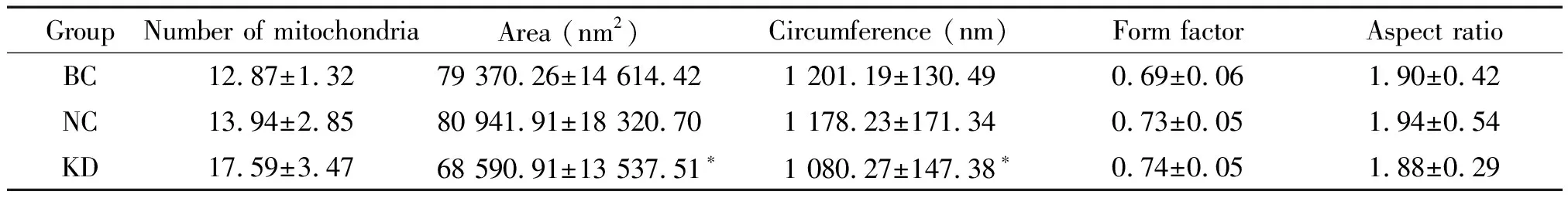
表2 线粒体数目及形态学指标的比较
3 PGC-1α、Mfn2和ERK1/2的mRNA表达水平的变化
Real-time PCR结果显示NC组与BC组PGC-1α、Mfn2、ERK1和ERK2的mRNA水平的表达差异无统计学显著性;而KD组PGC-1α和Mfn2的mRNA水平较NC组显著降低(P<0.01),ERK1和ERK2的mRNA水平与NC组相比差异无统计学显著性,见图3。

Figure 3.The mRNA expression of PGC-1α, Mfn2, ERK1 and ERK2 in the C2C12 cells. Mean±SEM. n=8. **P<0.01 vs NC group.
4 PGC-1α、Mfn2、ERK1/2和p-ERK1/2蛋白水平的变化
与BC组相比,NC组PGC-1α、Mfn2、ERK1/2及p-ERK1/2蛋白水平无明显改变。KD组的Mfn2蛋白水平较NC组显著降低(P<0.01),但PGC-1α的蛋白水平在2组之间的差异无统计学显著性;ERK1/2总蛋白和磷酸化蛋白水平在KD组和NC组间的差异无统计学意义,见图4。
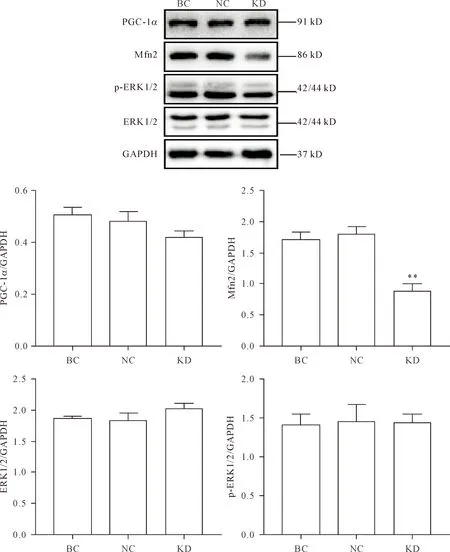
Figure 4.The protein levels of PGC-1α, Mfn2, ERK1/2 and p-ERK1/2 in the C2C12 cells. Mean±SEM. n=8. **P<0.01 vs NC group.
讨 论
临床和动物实验均表明,RYR1变异除了导致肌纤维形态改变,还影响骨骼肌内线粒体的形态和功能。RYR1变异最主要的临床表型为中央轴空病。超微病理检查发现患者骨骼肌的轴空区域内线粒体数目显著减少或缺失[6]。在动物模型中,RyR1敲除纯合突变小鼠的骨骼肌形态学和超微结构显示肌纤维减少、变细、且破坏严重,常在胚胎期或出生后不久即死亡[7-8],杂合突变的小鼠也可见不同程度的肌纤维破坏及线粒体改变[9-11]。RYR1编码的RyR1 蛋白是一种四聚体钙离子通道,主要分布于骨骼肌细胞的终末池,参与调节肌浆网内钙离子的释放。目前认为RYR1突变导致CCD的可能机制主要有钙离子泄漏和兴奋收缩解耦联两种,其中钙离子泄漏多由RyR1蛋白N端突变引起RyR1持续开放所致,由于肌浆网内钙离子持续外流,导致细胞钙超载,继发线粒体损伤和细胞凋亡;而RyR1蛋白C端突变则引起RyR1功能下调,兴奋收缩解耦联,不伴随细胞内钙离子水平的改变[12],其导致线粒体损伤的机制尚不明确。
本研究采用siRNA敲低RYR1转录水平的表达后,可见细胞内线粒体形态呈碎片样改变,再次从细胞层面证实RYR1低表达对线粒体形态的影响,与既往文献报道观点一致。与既往观察不同的是,本研究观察中发现,线粒体数目有增多趋势,未达显著水平,但线粒体周长和面积显著减少。推测碎片化倾向的线粒体可能通过某种途径正在被清除,导致线粒体总体周长和面积还是显著减少的。因此,我们的观察表明,RYR1低表达对线粒体的总体影响是破坏增加。由于线粒体膜是细胞进行能量代谢和其它生物学功能的重要场所,线粒体周长和面积的显著减少可能会影响线粒体功能。
线粒体是不断动态变化的细胞器,多种蛋白参与线粒体的融合、分裂过程,维持体内线粒体的动态平衡[13-14],其中,位于线粒体外膜和肌浆网连接处的Mfn2,介导线粒体与肌浆网及线粒体之间外膜的融合。线粒体的融合有助于物质交换,包括线粒体DNA、脂质、蛋白质和代谢物等,维持线粒体的形态和功能[15]。Mfn2可以提高线粒体膜电位,促进葡萄糖有氧代谢,减小线粒体膜空隙及维持线粒体动态运动等[16]。研究显示运动训练后,骨骼肌中线粒体体积、数量和密度显著增高,线粒体融合增多[17],伴随Mfn2及其上游调节因子PGC-1α表达升高[18]。Ainbinder等[19]研究发现,采用siRNA抑制小鼠趾短屈肌细胞内Mfn2的表达后,细胞中线粒体分布异常伴碎片化改变,钙离子内流减少。而敲除Mfn2后,骨骼肌中呼吸链复合物功能下降,骨骼肌运动耐力降低[20];线粒体和内质网之间的正常连接被打破,继发细胞内钙离子紊乱[21]。本研究结果显示,敲低组中Mfn2在mRNA水平和蛋白水平的表达均显著减低,同时伴随线粒体形态学的异常,提示Mfn2可能参与了RYR1变异所致的线粒体减少和缺失的发生。
PGC-1α是调节线粒体生物发生的最重要的调节因子。PGC-1α可以与雌激素相关受体α(estrogen-related receptor α, ERRα)协同作用,促进Mfn2基因的转录而调控Mfn2的表达,进而调节线粒体形态和功能[22]。暴露于寒冷情况下或体育训练可以提高组织内PGC-1α的表达,上调Mfn2的表达,促进线粒体体积增大,抑制线粒体自噬[3]。而PGC-1α表达下降及其本身乙酰化修饰后,Mfn2表达下调,线粒体稳态被破坏[23]。而在本研究中,敲低组细胞内PGC-1α的mRNA水平明显降低,但蛋白水平未见显著变化,提示在RYR1低表达的C2C12细胞内线粒体形态异常的发生过程中,PGC-1α可能不起主要作用,或者还存在PGC-1α转录后的其它调控机制。
有研究表明氧化应激反应参与了RYR1相关肌病的发生[24]。线粒体是细胞内产生活性氧(reactive oxygen species,ROS)的主要来源,反之,氧化应激也是导致线粒体损伤的重要原因之一[25]。Filipova等[26]对RYR1敲除的胎鼠骨骼肌进行RNA seq检测,发现存在ERK1/2通路表达的异常。Giulivi等[5]发现RYR1基因R163C杂合突变小鼠的骨骼肌内H2O2生成增加伴随磷酸化ERK1/2表达升高,提示ERK1/2氧化应激通路参与了RYR1突变所致的疾病发生过程。Mfn2蛋白N端存在Ras结合位点,能够与Ras结合后抑制其活化,进而使其下游信号蛋白ERK1/2失活,减轻氧化应激对线粒体和细胞的损伤[4]。但是,本研究中未发现敲低组ERK1/2的激活,提示在RYR1低表达的C2C12细胞中,ERK1/2介导的氧化应激反应可能不是导致线粒体形态学异常的主要途径,有待进一步研究其它可能的发生机制。
综上所述,本研究通过敲低C2C12细胞中RYR1转录水平的表达,探讨了RYR1低表达对线粒体数目和形态学改变及其可能的发生机制。研究初步发现RYR1低表达导致线粒体呈碎片化改变倾向,体视学分析显示线粒体面积和周长显著减少。Mfn2表达显著降低,可能参与了RYR1变异所致线粒体异常的发生,PGC-1α的调节及ERK1/2相关的氧化应激反应在此过程中可能并不发挥重要作用。RYR1变异所致线粒体异常的具体发生机制尚待进一步研究。

