运脾和络方通过调控Sirt1/AMPK信号通路并激活自噬而减轻糖尿病肾损伤*
郭 燚, 唐比强, 赵 娜, 柴可夫, 杜月光△
(浙江中医药大学基础医学院 1病理教研室, 2中医临床基础研究所, 浙江 杭州 310053)
糖尿病肾脏疾病(diabetic kidney disease,DKD)是糖尿病最主要的微血管并发症。该病不仅是导致慢性肾衰和终末期肾病的主要原因,并且是心血管疾病的独立危险因素。目前对DKD的治疗主要是基于对血糖、血压和蛋白尿的控制用药,这些治疗虽然可以缓解症状、延缓终末期肾衰的进展,但并不能有效地阻断DKD的发生与发展过程[1]。因此,寻求安全有效的治疗方法和中医药非常必要。
中国传统医学认为,DKD是在消渴的基础上发展,消渴日久导致脾肾虚衰,脾虚则运化无权,土不制水,肾虚则蒸腾气化失司,致水湿内停出现水肿、蛋白尿;同时瘀血始终贯穿糖尿病肾脏疾病病程的始终:因虚而致瘀,瘀血又可致病,日久化毒,毒伤肾络,加重病情,因此,补益脾肾和化淤和络是治疗DKD的主要治法[2]。运脾和络方(Yunpiheluo decoction, YPHL)是柴可夫等人临床常用经验方,主要用于治疗糖尿病及其并发症[3-4]。根据以上病机和治法我们推测运脾和络方对糖尿病肾损伤具有缓解作用。最新研究表明自噬活性受损是DKD的发病机制之一[5]。自噬与DKD的发生发展共同受到Sirt1/AMPK信号通路的调控[6]。为此,本研究采用高脂高糖饮食诱导Zucker糖尿病肥胖(Zucker diabetic fatty, ZDF)大鼠建立Ⅱ型糖尿病肾病大鼠模型,观察运脾和络方对糖尿病肾损伤的缓解作用,及其对肾组织中Sirt1、AMPK和自噬相关蛋白表达的影响,为本方在临床上防治DKD肾损伤提供实验依据。
材 料 和 方 法
1 材料
1.1实验动物及饲料 清洁级8周龄的雄性ZDF大鼠24只[体质量(265±10)g]和清洁级8周龄雄性ZL大鼠8只[体质量(180±10)g],购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2016-0006。饲养于浙江中医药大学动物实验研究中心屏障实验室[SYXK(浙)2013-184],饲养环境温度20~24 ℃,湿度55%~65%,12 h交替照明。大鼠自由饮水,摄食。高脂高糖饲料按如下比例的配方进行加工制造:50%基础饲料、15%蔗糖、15%蛋黄粉、10%全脂奶粉和10%猪油。以上饲料原料及加工制作由南通特洛菲饲料科技有限公司提供和完成。
1.2药物 运脾和络方主要由黄芪15 g、苍术15 g、泽泻15 g、防已9 g、当归9 g、赤芍9 g、玄参12 g和威灵仙6 g组成,购自浙江中医药大学滨江中医门诊部,浙江省中医院药剂室煎制成含生药2×103g/L的浓缩液,4 ℃冰箱密封保存。
1.3试剂与仪器 兔抗鼠Sirt1抗体(Biorbyt,批号为orb19330);兔抗鼠LC3抗体和兔抗鼠p-AMPK(Thr172)抗体(CST,批号分别为CST2535和CST 4108);兔抗鼠AMPKα1抗体、兔抗鼠P62抗体和兔抗鼠GAPDH抗体(Abcam,批号分别为ab3759、ab56416和ab181602);山羊抗小鼠IgG II 抗和山羊抗兔IgG II 抗(Thermo Pierce,批号分别为31160和31210); BAC蛋白浓度测定试剂盒(碧云天生物技术有限公司,批号P0010); RT-qPCR试剂盒购于北京康为世纪生物科技有限公司(型号CW0957M);逆转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser购于宝日医生物技术(北京)有限公司(型号RR047A)。全自动生化分析仪(7020,Hitachi); 多功能酶标仪(Varioskan Flash,Thermo);LightCycler 480(Roche);S1000 Thermal Cycler、Mini-Protein电泳系统及Mini Trans-Blot转印系统(Bio-Rad);紫外分光光度计(Beckman);低温高速离心机(Eppendorf)。
2 方法
2.1分组与给药 取24只ZDF大鼠用高脂高糖饲料喂养4周,每周定时眼眶取血检测空腹血糖,连续4周,4周后空腹血糖值均>7.8 mmol/L,建模成功。将大鼠随机分为:模型(model)组、运脾和络方(YPHL)组和Sirt1过表达(Sirt1-Ov)组,分组后继续高脂高糖喂养。8只ZL大鼠为正常对照(control)组,普通饲料喂养。
Sirt1过表达组大鼠开始时尾静脉注射重组腺病毒Ad-Sirt1,1周后再次注射重组腺病毒Ad-Sirt1。运脾和络方组予以运脾和络方12.5 g·kg-1·d-1灌胃;正常对照组、模型组和Sirt1过表达组大鼠每日给予蒸馏水4 mL。各组大鼠每天灌胃1次,连续10周。
2.2标本收集实验 结束前1 d将大鼠置于代谢笼中,收集24 h尿液,用于测定尿蛋白(urinary protein,UP)和尿白蛋白(urinary albumin,U-ALB)。禁食8 h后,用10%水合氯醛3.5 mg/kg腹腔注射麻醉,行心脏采血,4 ℃、4 000 r/min,离心10 min,收集血清,用于检测生化指标。取大鼠肾脏,去包膜,对切,部分放于10%中性福尔马林溶液固定,用于病理形态检测;部分肾脏快速液氮冷冻,然后置于-80 ℃超低温冰箱保存,用于蛋白及mRNA表达检测。
2.3生化指标检测 用全自动生化分析仪测定空腹血糖(fasting blood glucose,FBG)、血清肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN);放免法测定U-ALB和UP。
2.4肾脏组织病理观察与分析 取一侧肾脏去除包膜,10%中性福尔马林固定,常规乙醇脱水、二甲苯透明、石蜡包埋、切片,行HE染色和Masson染色,光镜下观察肾脏病理形态学改变和纤维化程度。肾小管间质损伤(tubular injury,TI)程度评分[7]:每张切片观察20个视野。TI0为正常肾小管与肾间质,无损伤;TI1为动脉周围纤维化;TI2为肾小管周围纤维化;TI3为透明管型伴局灶纤维化;TI4为局灶纤维化伴大范围成纤维细胞浸润。损伤程度分数根据以下公式计算:损伤分数=(0×number of TI0+1×number of TI1+2×number of TI2+3×number of TI3+4×number of TI4)/(number of TI0+TI1+TI2+TI3+TI4)。
2.5RT-qPCR检测肾组织Sirt1的mRNA表达 按照TRIzol试剂说明书提取肾组织总RNA,测定并计算RNA的纯度和浓度;取RNA在逆转录酶作用下合成cDNA;用SYBR Green嵌合荧光法进行实时PCR扩增。PCR引物序列由上海生工生物工程公司合成,Sirt1的上游引物序列为5′-AGAGTTGCCACCAACACCTC-3′,下游引物序列为5′-ACTGGAACCAACAGCCTTGA-3′,产物长度238 bp;β-actin的上游引物序列为5′-ATGCCATCCTGCGTCTG-3′,下游引物序列为5′-ACTCCTGCTTGCTGATCCACAT-3′,产物长度567 bp。反应条件为95 ℃预变性10 min;95 ℃变性15 s、60 ℃退火延伸1 min,共40个循环。每个样本设置3个复孔。取其循环阈值(Ct)均值,计算各组的ΔCt,以2-ΔΔCt表示mRNA的相对表达量(ΔCt=目的基因Ct值-内参照基因Ct值,ΔΔCt=各实验组ΔCt值-正常对照组ΔCt值)。
2.6Western blot检测肾组织蛋白的水平 将大鼠肾脏标本剪碎后加入适量裂解液,提取总蛋白,采用BCA定量试剂盒进行蛋白浓度定量。行SDS-PAGE,每孔上样量60 μg,电泳2 h左右。完毕后转移至PVDF膜上,转膜结束后,放到T-TBS(含5%脱脂奶粉),室温封闭1 h,加入稀释的I 抗(SIRT1和P62 1∶200;AMPK 1∶500;p-AMPK和LC3 1∶1 000;GAPDH 1∶10 000)孵育过夜,洗膜,加入稀释的 II 抗(1∶5 000),室温孵育2 h,T-TBS洗膜后发光显影,ImageJ软件分析条带的吸光度值。目的蛋白相对表达量=目的蛋白吸光度值/内参照蛋白吸光度值×10表示。
3 统计学处理
采用SPSS 19.0统计软件进行统计学分析。计量数据以均数±标准差(mean±SD)表示,组间的实验数据比较用单因素方差分析,如果差异显著,再用SNK-q检验分析相应两组间的显著性差别。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠的一般情况
正常对照组大鼠饮食正常,反应敏捷,被毛有光泽,粪便成形,颗粒状,质软,尿量正常。实验后期,与正常对照组相比,模型组大鼠体型明显肥胖,被毛干枯无光泽,脱毛严重,灌胃不挣扎,尿多,粪便稀溏;Sirt1过表达组和运脾和络方组大鼠较模型组情况有不同程度改善,精神稍好,不时进行短时间活动,灌胃治疗时偶有挣扎现象,被毛稍有光泽,脱毛减少,粪便成形,偶尔偏溏。
2 各组大鼠空腹血糖和肾功能的变化
与正常对照组比较,模型组大鼠的FBG、UP、U-ALB和SCr均明显升高(P<0.01),但BUN的差异并无统计学显著性(P>0.05)。与模型组比较,Sirt1过表达组的FBG明显降低(P<0.01),运脾和络方组的FBG差异无统计学显著性(P>0.05);Sirt1过表达组和运脾和络方组的SCr和U-ALB均降低(P<0.05),UP与BUN的变化差异无统计学显著性(P>0.05),见表1。

表1 各组大鼠空腹血糖和肾功能指标的变化
3 各组大鼠肾组织病理形态改变及病理评分
HE染色和Masson染色结果显示,正常对照组肾小球和肾小管结构正常;模型组肾小球局灶性纤维增生,肾小管-肾间质呈局灶性病变:肾小管萎缩消失,出现管型,部分肾小管扩张,间质炎细胞浸润、纤维增生,小动脉壁增厚;运脾和络方组和Sirt1过表达组肾小球病变,肾小管扩张、萎缩和间质纤维化程度减轻,见图1、2。

Figure 1.The morphological changes of the renal tissues observed by HE staining in the rats of each group(×400). A: control group; B: model group; C: YPHL group; D: Sirt1-Ov group. The red arrow indicates glomerular atrophy and focal fibrosis. The green arrow indicates renal tubular atrophy, the infiltration of inflammatory cells, and renal interstitial fibrosis.

Figure 2.The morphological changes of the rat renal tissues in each group (Masson staining,×400). A: control group; B: model group; C: YPHL group; D: Sirt1-Ov group. The red arrow indicates renal tubular atrophy, renal interstitial fibrosis. The green arrow indicates tubular type. The yellow arrow indicates renal tubular basement membrane thickening.
肾脏损伤评分提示,与正常组对比,模型组肾小管及间质损伤程度明显升高(P<0.01);与模型组比较,Sirt1过表达组和运脾和络方组肾小管及间质损伤程度明显降低(P<0.01),见图3。
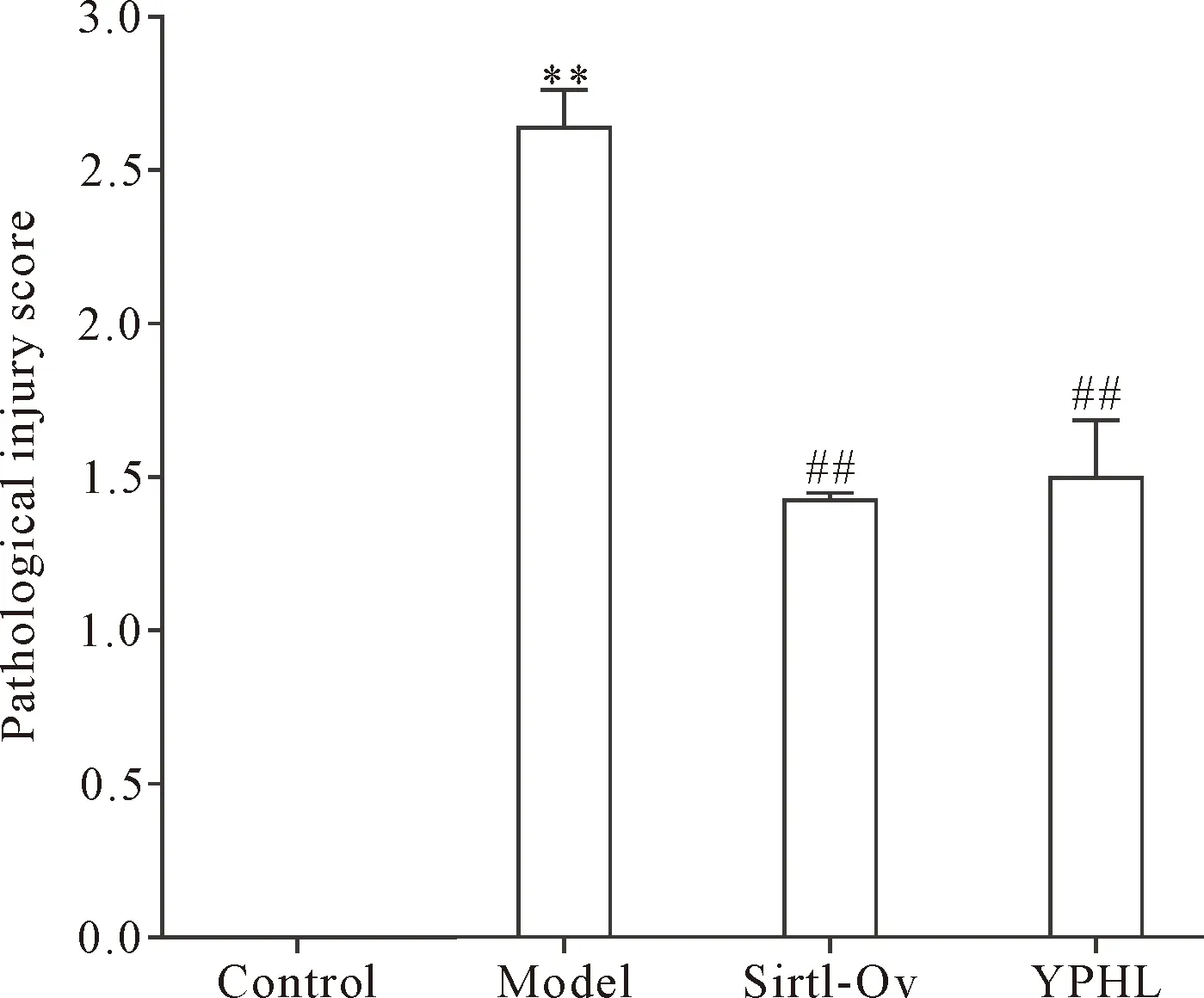
Figure 3.Pathological injury score of the rat in each group. Mean±SD. n=8. **P<0.01 vs control group; ##P<0.01 vs model group.
4 各组大鼠肾组织中Sirt1的mRNA表达变化
与正常对照组比较,模型组Sirt1的mRNA表达降低(P<0.05);与模型组比较,运脾和络方组和Sirt1过表达组Sirt1的mRNA表达增加(P<0.05),见图4。
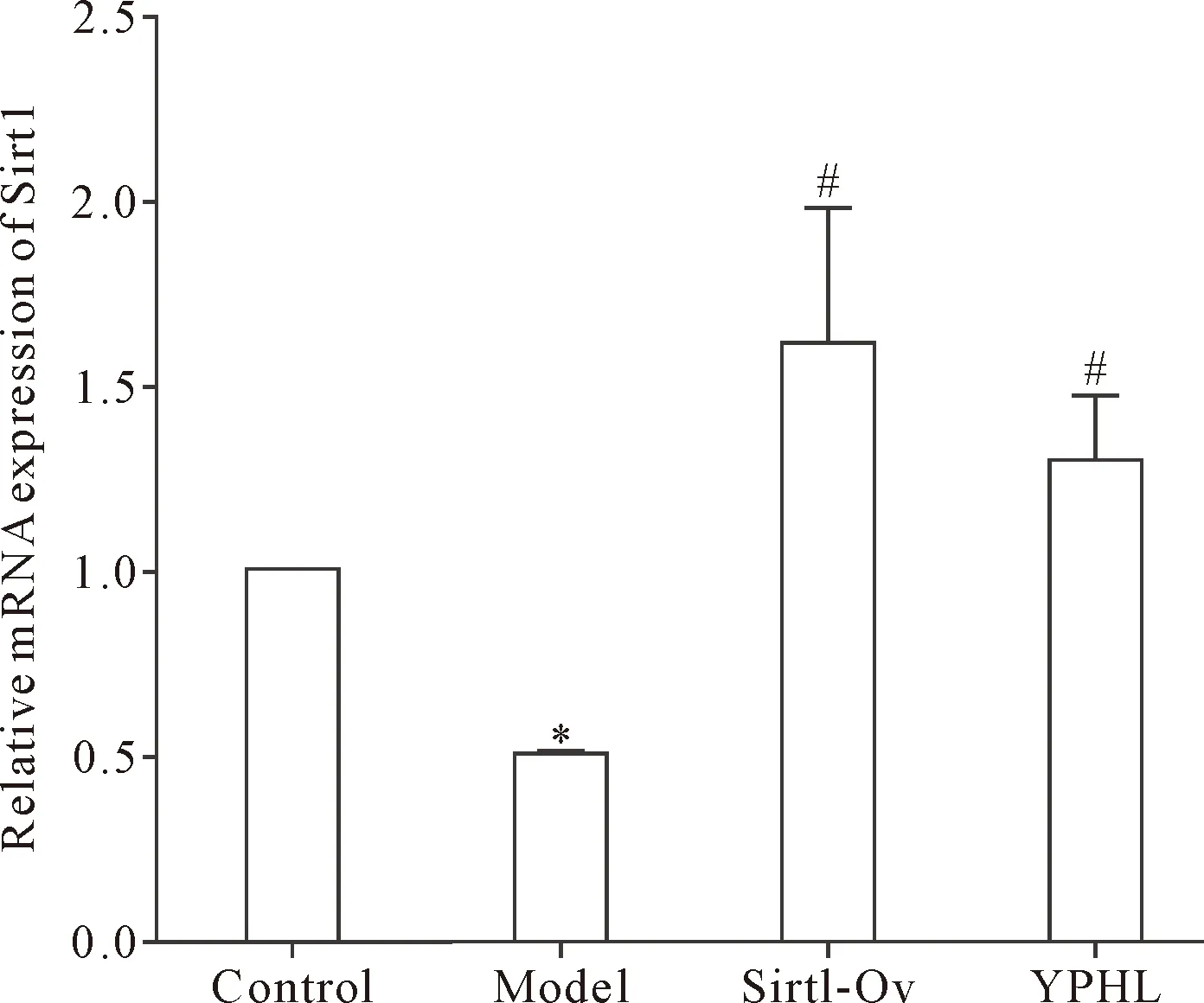
Figure 4.The change of Sirt1 mRNA expression in the rat renal tissues of each group. Mean±SD. n=8. *P<0.05 vs control group; #P<0.05 vs model group.
5 各组大鼠肾组织Sirt1、LC3、P62、AMPK和p-AMPK蛋白水平的变化
与正常对照组比较,模型组Sirt1、AMPK、p-AMPK和LC3-Ⅱ的蛋白水平明显降低(P<0.01),P62表达明显升高(P<0.01);与模型组比较,运脾和络方组和Sirt1过表达组的Sirt1、AMPK、p-AMPK和LC3-Ⅱ蛋白水平明显升高(P<0.01),P62表达明显降低(P<0.01),见图5、6。
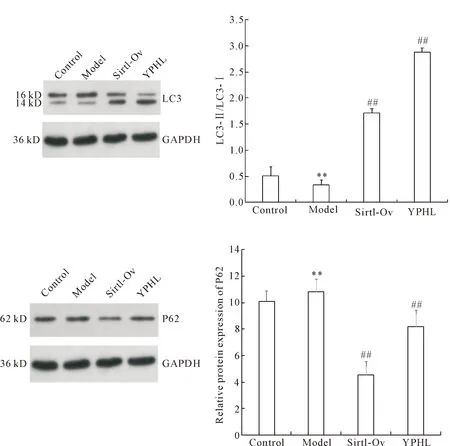
Figure 5.The protein expression of LC3 and P62 in the rat renal tissues of each group. Mean±SD.n=8. **P<0.01 vs control group; ##P<0.01 vs model group.

Figure 6.The protein levels of Sirt1, AMPK and p-AMPK in the rat renal tissues of each group. Mean±SD. n=8. **P<0.01 vs control group; ##P<0.01 vs model group.
讨 论
糖尿病肾脏疾病基本病机为本虚标实,阴虚为本,燥热为标,病位主要涉及脾肾两脏,虚、痰、瘀贯穿疾病始终,久病伤及阴阳气血、脾虚痰瘀内生、伤及络脉,治需培脾益气、祛痰通络。运脾和络方中黄芪补气固表、养血生津、利水消肿;苍术醒脾助运、开郁宽中、疏化水湿;泽泻化浊降脂、泄热、利水渗湿;防已祛风利水;当归补血活血、生津和阴;赤芍活血化瘀、消痈散结、清热凉血;玄参、威灵仙二药配伍化瘀消痰、软坚散结。诸药大多归脾经,配伍后药性平和,共奏益气运脾、祛瘀和络、化湿消痰之功。本课题组前期研究显示运脾和络方可通过抑制神经细胞凋亡减轻糖尿病大鼠神经损伤[4]。本实验结果显示经运脾和络方干预后糖尿病大鼠的清血肌酐和尿白蛋白明显降低;病理形态显示肾小球、肾小管病变减轻,肾小管间质纤维化程度减轻,提示其对糖尿病肾脏有保护作用。但是,本实验中运脾和络方并没有明显降低ZDF大鼠的血糖水平,这一发现与运脾和和络方干预STZ诱导的2型糖尿病大鼠后,空腹血糖降低的结果[8]不一致,可能与不同的实验模型有关。这一结果提示运脾和络方对ZDF大鼠的肾保护作用可能与血糖控制无明显关系。
自噬是细胞中溶酶体蛋白的降解途径,通过清除损伤的蛋白质和细胞器以维持细胞内稳态和细胞的完整性。研究表明自噬与糖尿病肾脏病变的发生密切相关。在糖尿病状态下足细胞和肾小管上皮细胞的自噬活性会发生变化,如邓宇菲等[9]研究发现DN大鼠足细胞自噬活动减低,并且与尿蛋白排泄、系膜增生相关;Ying等[10]发现高糖诱导下肾小管上皮细胞的自噬异常并导致EMT发生。本研究结果显示,ZDF大鼠肾组织自噬标志蛋白LC3-II的表达明显降低,P62表达升高,提示存在自噬的异常,而运脾和络方治疗后可显著升高LC3-II的表达,降低P62的表达,表明运脾和络方通过影响自噬在肾脏保护中起重要作用。
AMPK是一种关键的AMP能量传感器,对自噬起着正向调节作用[11]。研究表明AMPK失活能抑制自噬,参与糖尿病肾病的发病,相反激活AMPK能恢复自噬活性,显著减少蛋白尿并减轻肾脏的病理变化[12]。Sirt1是一种依赖于NAD+的脱乙酰酶,其激活可通过抑制炎症、氧化应激、肾纤维化、细胞凋亡,从而起到改善糖尿病肾病的作用[13]。近年研究发现Sirt1不仅可以保护肾脏细胞并通过调控自噬改善糖尿病肾病的进程[14]。Sirt1与AMPK存在相互调控关系,Sirt1可以去乙酰化和激活LKB1,活化的LKB1又可以磷酸化AMPK,使AMPK激活[15]。有研究发现Sirt1激活可通过LKB1-AMPK信号通路来激活自噬从而避免高脂诱导的内皮细胞损伤[16]。白藜芦醇可通过Sirt1/AMPK信号途径改善自噬免受脊神经细胞损伤[17]。本实验结果显示Sirt1过表达,显著升高LC3-II的表达,降低P62的表达,同时p-AMPK水平升高,进一步提示Sirt1/AMPK信号通路参与自噬的调节,促进自噬。运脾和络方治疗后,Sirt1表达增加,p-AMPK水平升高,提示运脾和络方可使SIRT1激活,通过Sirt1/AMPK信号途径改善自噬。
综上所述,运脾和络方治疗可能是通过增加Sirt1表达,上调AMPK-Sirt1通路,激活细胞自噬,进而减轻肾损伤,发挥对肾脏的保护作用。Sirt1可能是运脾和络方发挥药理作用的重要靶点。

