糖尿病小鼠肾组织中Notch1通过Akt/mTOR通路抑制自噬促进肾小管间质纤维化*
刘兴梅, 张莹莹, 王圆圆, 石明隽, 肖 瑛, 张 帆, 郭 兵△
(1贵州省人民医院检验科, 贵州 贵阳 550004; 2贵州医科大学病理生理学教研室, 贵州省常见慢性疾病发病机制及药物研究重点实验室, 贵州 贵阳 550025)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见且严重的微血管并发症,是导致终末期肾病(end-stage renal disease,ESRD)的主要原因[1-3]。随着病情进展则发生肾间质纤维化。而DN发病过程中,Notch信号通路可通过调控肾小管上皮细胞凋亡,诱导肾脏损伤[4]。Notch通路参与调节细胞分化、增殖和自噬过程。自噬是蛋白质在膜包囊泡中降解的生物学过程,通过对受损细胞器和老化蛋白质等大分子物质进行降解进而维持细胞内环境稳定及细胞的完整性[5]。研究表明[6],体外高糖环境下,肾小管上皮细胞自噬被抑制,小管上皮细胞清除细胞外基质的能力降低,进而促进肾间质纤维化的进程。可见,自噬与DN的发生发展关系密切。然而,Notch信号通路与内环境稳态失衡对肾脏纤维化影响的具体作用机制不甚清楚。因此本研究拟采用db/db糖尿病小鼠模型检测Notch1通路对db/db小鼠肾脏组织自噬水平的影响以及对肾小管间质纤维化的调控,以期为糖尿病肾病的防治提供新的理论与实验依据。
材 料 和 方 法
1 材料
1.1实验动物 6~8周雄性db/db和db/m小鼠,SPF级,体重20±2 g,由南京大学模式动物研究所提供,合格证号为SCXK[苏]2015-0001。
1.2实验试剂 ClarityTMWestern ECL substrate (BIO-RAD);两步法免疫组化检测试剂 (中杉金桥);DAB显色剂 (博士德生物工程有限公司);小鼠抗β-actin抗体 (普美生物);兔抗Notch1 (#3608)、LC3-Ⅰ/-Ⅱ (#12741)、phospho-Akt (Thr308)(#13038)、磷酸化哺乳动物雷帕霉素靶蛋白[phosphorylated mammalian target of rapamycin,phospho-mTOR (Ser2448)](#2971)抗体均购自CST;兔抗第10号染色体缺失的磷酸酶-张力蛋白同源蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)(ab32199)、p62 (ab109012)、 Akt (ab179463)、mTOR (ab32028)抗体购自Abcam; 兔抗Ⅰ型胶原(collagen type Ⅰ, Col-Ⅰ)抗体(Proteintech, 14695-1-AP);兔抗Ⅲ型胶原(collagen type Ⅲ, Col-Ⅲ)抗体(Sigma, SAB4500367)。
2 方法
2.1实验动物分组及处理 所有动物实验程序均经贵州医科大学伦理委员会审核批准。 C57BL/KsJ db/db(约6周龄)雄性小鼠和年龄匹配的db/m小鼠由南京实验动物中心提供。将动物适应性喂养7 d以适应新环境。动物饲养条件控制于温度(20~25 ℃),相对湿度(50%~60%)和12 h光/暗循环。给动物自由进食和饮水。将小鼠随机分为db/m对照组和db/db实验组(每组8只小鼠)。给所有小鼠提供正常饮食和无限量饮用水。饲养12周后腹腔注射戊巴比妥钠(50 mg/kg)麻醉,摘眼球取血,分离血清冻存,用于生化指标检测;颈椎脱臼处死小鼠,取左肾中段1/3肾固定于4%多聚甲醛,用于免疫组织化学检测;余下肾于-80 ℃保存用于Western blot检测。
2.2生化指标的检测 己糖激酶法检测血糖(blood glucose,BG),高效液相色谱法检测糖化血红蛋白(glycosylated hemoglobin,GHb),酶法检测血清肌酐(serum creatinine,SCr)和甘油三酯(triglyceride,TG),胆固醇氧化酶法检测血总胆固醇(total cholesterol,TC)。
2.3肾组织形态学的观察 HE和Masson染色后,光镜观察肾组织病理变化。
2.4免疫组织化学染色 在抗原修复和阻断后,将切片在室温下与Notch1单克隆抗体的最佳稀释液一起温育24 h。用磷酸盐缓冲盐水(PBS)洗涤切片后,加入抗兔 II 抗1 h。然后用PBS洗涤切片,用ABC试剂盒孵育30 min,用DAB显色,并用苏木精复染。
2.5Western blot检测蛋白水平 从肾组织中分离提取蛋白质并转移到膜上,将膜在4 ℃下与兔抗Notch1(1∶1 000)、PTEN(1∶1 000)、LC3(1∶1 000),P62(1∶1 000)、Ⅰ型胶原蛋白(1∶1 000)和Ⅲ型胶原蛋白(1∶800)单克隆抗体,以及小鼠抗β-肌动蛋白(1∶4 000)单克隆抗体孵育过夜。 用含有0.1% Tween-20(TBST)的Tris缓冲液重复洗涤膜,用Tris缓冲液(TBS)洗涤1次,然后用 II 抗孵育1 h。加入ClarityTMWestern ECL底物(BIO-RAD)以显现免疫染色的蛋白质。对于定量测定,通过ImageJ软件分析条带灰度。
3 统计学处理
采用SPSS 19.0统计软件进行数据统计分析,数据均以均数±标准差(mean±SD)表示,数据符合正态分布,且通过方差齐性检验,两组间比较采用两样本独立t检验,多组间比较采用单因素方差分析,相关分析采用Pearson相关法。以P<0.05为差异有统计学意义。
结 果
1 生化指标的变化
与db/m小鼠比较,db/db小鼠的血糖、糖化血红蛋白、血清肌酐、甘油三酯和胆固醇均明显增高(P<0.01),见表1。

表1 db/m和db/db小鼠生化指标的变化
2 小鼠肾组织病理变化
2.1HE染色 HE染色可见db/m组肾小管结构清楚,细胞形态正常,间质无水肿,db/db组肾小管上皮细胞空泡样变性,间质中炎性细胞浸润,肾小管扩张,见图1。
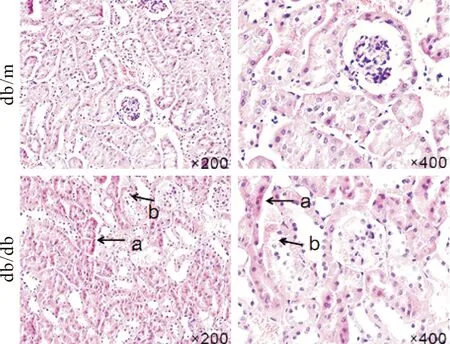
Figure 1.Histological changes of the renal tissues in the db/m and db/db mice were observed with HE staining. a: renal tubular expansion; b: vacuolar degeneration of renal tubular epithelial cells.
2.2Masson染色 Masson染色后,胶原纤维和胞核呈蓝色,胞质和红细胞呈红色。结果显示,db/m组肾脏组织结构正常,肾小球基底膜和间质无胶原纤维堆积;与db/m组相比较,db/db组肾脏组织可见大量胶原纤维样物质沉积于肾小球毛细血管腔内和肾间质,肾小管结构排列紊乱,见图2。

Figure 2.The histological changes of the renal tissues in the db/m and db/db mice were observed with Masson staining. a: collagenous fiber-like substance deposition in the glomerular capillaries; b: collagenous fiber-like substance deposition in the glomerular basement membrane; c: collagenous fiber-like substance deposition in the renal interstitium; d: disarrangement of tubular structure.
3 小鼠肾组织中自噬和纤维化指标的变化
Western blot实验结果显示,与db/m组比较,db/db组的LC3-Ⅱ表达减少(P<0.05),P62表达明显增加(P<0.01);Col-Ⅰ和Col-Ⅲ的表达明显增多(P<0.01),见图3。
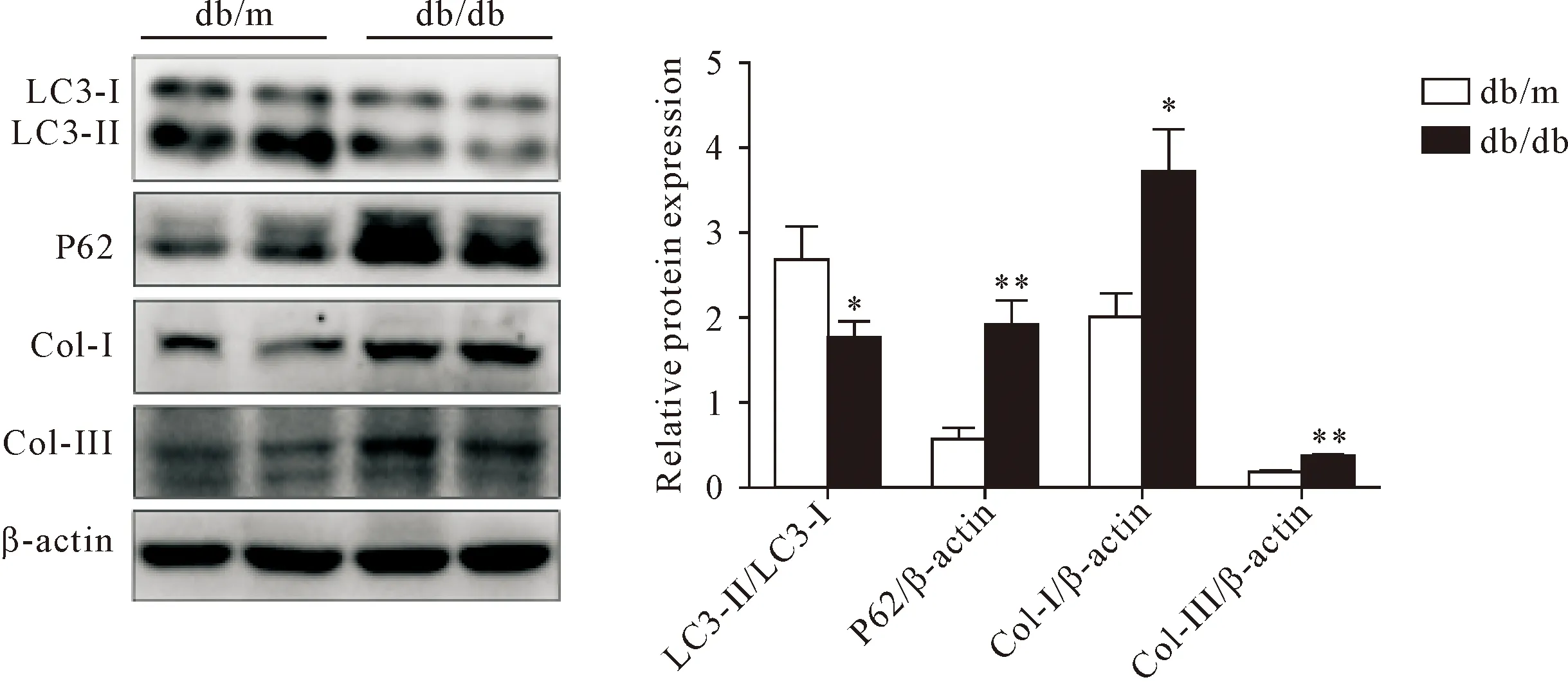
Figure 3.Western blot was used to determine the protein levels of LC3, P62, Col-I and Col-III in the renal tissues of db/m and db/db mice. Mean±SD. n=8. *P<0.05, **P<0.01 vs db/m.
4 小鼠肾组织中PTEN、p-Akt、Akt、p-mTOR和mTOR的蛋白水平变化
Western blot实验结果显示,与db/m组比较,db/db组的PTEN蛋白水平明显减少(P<0.01),p-Akt(Thr308)和p-mTOR(Ser2448)的蛋白水平明显增加(P<0.01),而两组总Akt和mTOR蛋白水平的差异无统计学显著性,见图4。
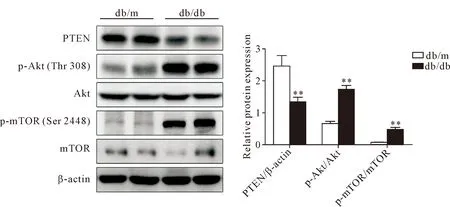
Figure 4.Western blot was used to determine the protein levels of PTEN, p-Akt (Thr308), Akt, p-mTOR (Ser2448) and mTOR in the renal tissues of db/m and db/db mice. Mean±SD. n=8. **P<0.01 vs db/m.
5 免疫组织化学染色检测各组小鼠肾组织Notch1的表达
免疫组织化学染色直观检测Notch1蛋白的表达位置和表达量,显微镜下可见蛋白阳性结果呈棕黄色颗粒,细胞核被染成蓝色。结果显示,db/m组的Notch1在肾小管上皮细胞和肾小球中表达不明显;与db/m组比较,db/db组Notch1在肾小管上皮细胞大量表达,在肾小球也有少量表达,见图5。

Figure 5.The Notch1 expression in the renal tissues in the db/m and db/db mice was detected by immunohistochemical staining (shown by “a” and arrows).
6 小鼠肾组织Notch1的表达变化
Western blot实验结果显示,与db/m组比较,db/db组Notch1蛋白的表达明显增加(P<0.01),见图6。

Figure 6.Western blot was used to determine the protein level of Notch1 in the renal tissues of db/m and db/db mice. Mean±SD. n=8. **P<0.01 vs db/m.
7 小鼠肾组织Notch1和PTEN蛋白的相关性分析
Western blot实验结果显示,与db/m组比较,db/db组Notch1的蛋白表达明显增加而PTEN的蛋白表达降低。利用Pearson相关分析评估两者之间的相关性,结果显示,小鼠肾组织Notch1蛋白与PTEN蛋白呈显著负相关(r=-0.685,P<0.05),见图7。
讨 论
Notch信号通路是一条影响细胞命运、保守而重要的跨膜信号转导通路,在哺乳动物中由4种受体(Notch1、Notch2、Notch3和Notch4)、经典配体和非经典配体构成[7],Notch1在维持肾小管上皮细胞功能中扮演着重要角色[8]。近年来,研究表明激活Notch信号通路可通过加重氧化应激进一步使DN肾纤维化加剧[9]。Tian等[10]又报道,Notch诱导TGF-β信号通路的激活,促进肾小管上皮细胞-间充质转分化、DN肾间质纤维化进程。可见,Notch可通过各种不同机制参与DN纤维化过程。本实验中db/db小鼠肾组织肾小管上皮细胞肿胀、空泡变性,大量胶原纤维样物质沉积于肾小球基底膜和肾间质,Notch1、Col-Ⅰ和Col-Ⅲ蛋白水平明显增加,表明Notch1增加加重了DN肾小管间质纤维化过程。
有研究表明[11],Notch信号通路与自噬能调节足细胞分化,当Notch通路异常激活时,增加自噬水平可减少足细胞分化,减轻足细胞损伤,缓解肾脏功能障碍。还有研究表明[12],在高糖环境中,激活Notch1使足细胞损伤,细胞凋亡与自噬之间的平衡破坏,影响足细胞功能恢复。说明,肾脏内Notch信号通路的激活影响细胞自噬水平,进而使足细胞功能障碍。自噬是进化上保守,通过溶酶体降解受损细胞器和细胞内错误折叠蛋白质,消除细胞毒性蛋白聚集体,使细胞能够循环利用线粒体的能源并维持细胞存活[13]。因此,自噬与肾脏病之间的关系逐渐成为研究的热点。自噬对维持细胞功能起重要作用,自噬异常则导致细胞功能障碍。而肾间质纤维化是DN发展过程中主要的病理特征之一,自噬也参与其中[14]。mTOR信号通路是负性调节自噬的重要机制[15]。mTOR被抑制时可诱导自噬的发生,相反,作为一种关键的反馈机制,mTOR的再激活则进一步抑制自噬并启动溶酶体重组[16]。本研究提示,db/db小鼠肾组织中LC3蛋白水平较db/m组减少,P62、p-Akt(Thr308)和p-mTOR(Ser2448)蛋白水平比db/m组明显增加,自噬被抑制,Akt/mTOR信号通路激活,并且伴随Col-Ⅰ和Col-Ⅲ的大量沉积。自噬受Akt/mTOR信号通路调节[17]。PTEN是迄今为止发现的唯一具有脂质磷酸酶活性和蛋白磷酸酶活性的抑癌基因[18]。PTEN具有很强的抑癌及调节细胞信号转导通路的功能,作为脂质磷酸酶,负性调控PI3K/Akt信号通路[19]。有研究报道,miR-4465通过抑制PTEN的蛋白表达,上调磷酸化的Akt,从而激活mTOR并抑制自噬,进而影响肝癌的发生[20]。在前列腺癌中,miR-146b也通过靶向调控PTEN,激活Akt / mTOR信号通路使自噬被抑制,参与前列腺癌的发生[21]。为了进一步验证,Notch1是否通过自噬促进糖尿病肾病肾小管间质纤维化的进程,实验中观察到db/db小鼠肾组织中PTEN蛋白表达明显减少,Notch1与PTEN呈负相关关系,激活Akt/mTOR信号通路进而抑制自噬,促进肾间质纤维化的发生发展。但是,具体机制还需要进一步深入研究。

