miR-124在肾癌中的表达以及对肾癌786-O细胞生物学行为的影响
胡刚强 费安华△ 李浩勇 宁金卓
(1.湖北省鄂州市中心医院(武汉大学人民医院鄂州医院)泌尿外科,湖北 鄂州 436000;2.武汉大学人民医院泌尿外科,湖北 武汉 433000)
肾细胞癌(renal cell carcinoma,RCC)又称肾癌,是一种起源于肾小管上皮系统的恶性肿瘤,其发病率和死亡率位居泌尿系统肿瘤的第三位[1-2]。清楚肾癌发生发展的机制以及确定其治疗靶点,对于肾癌的诊断和治疗至关重要[3-4]。MicroRNA(miRNA)是一类高度保守的小RNA 分子,可在转录后水平结合基因的3’非翻译区(3’untranslatedregion,3’UTR)调控靶基因表达,从而发挥其生物学作用[5]。miR-124是近年来发现的miRNAs家族中的一个重要分子,miR-124可通过多种信号转导途径调控肿瘤的发生发展过程。本实验旨在研究miR-124在肾癌组织的表达以及过表达miR-124后对肾癌786-O细胞增殖、迁移及侵袭的影响,并进一步探讨miR-124是否通过调控Zeste同源增强子(enhancer of zeste homolog 2,EZH2)来实现其作用。
1 材料与方法
1.1试剂及材料 人肾癌786-O细胞购自中国科学院上海生命科学研究院细胞资源中心;DMEM培养基和胎牛血清,美国Gibco公司;Trizol、Lipofectamine2000试剂、MTT检测试剂盒,美国Invitrogen公司;miR-214 mimics及对照(miR-214 NC)由上海吉玛生物技术公司提供;荧光定量聚合酶链反应(PCR)试剂盒,Takara 生物有限公司;Transwll 小室、Matrigel基质胶,美国Corning公司;EZH2抗体,Abcam公司。
1.2病例标本 收集62例2016年1月至2018年6月在我院手术的患者肾癌病理组织标本及相应癌旁正常组织标本,其中男27例,女35例,年龄43~76岁,平均59.3岁。术中组织液氮冻存后放入-80 ℃液氮中存用。本研究中的所有方案均获得了医院伦理委员会同意并获得批准,术前患者均签署了知情同意书。
1.3细胞培养及转染 肾癌 786-O 细胞在37℃、5% CO2的DMEM培养基中培养,0.25%的胰酶消化传代。2~3 d换液1次,3~5 d传代1次。细胞接种于6孔板中,待细胞融合至70%~80%,肾癌细胞采用无血清的培养基同步化24 h,按照Lipofectamine 2000说明书操作进行转染及后续的实验分析。
1.4细胞增殖水平检测 采用MTT比色法,将成功转染miR-124的肾癌786-O细胞在培养箱中培养24 h后接种于96孔板中,每孔加入5 g/L二苯基溴化四氮唑蓝(MTT)50 μL。孵育后加入DMSO振荡10 min,采用自动酶标仪490 nm读取光密度值(OD)。
1.5Transwell实验测定细胞迁移和侵袭能力 细胞迁移和侵袭实验均使用Corning BioCoatTMMatrigel小室,分为带胶和不带胶小室两种。取对数生长期的miR-124 mimics和miR-124 NC细胞,胰酶消化后加入50 μL含 10 g/L牛血清白蛋白(bovine serum albumin,BSA),调整细胞密度至2×106个/mL,将Transwell小室置入每孔500 μL 10%胎牛血清(FBS)的DMEM培养基的24孔培养板,培养约24 h后观察膜及孔下细胞数。将小室放入1%结晶紫溶液中染色5 min,染色结束后洗脱残余结晶紫溶液,用棉签擦去基质胶和小室内的细胞并拍照计数。
1.6Western blot实验检测EZH2蛋白表达 提取各组细胞蛋白,加入含1%苯甲基磺酰氟(PMSF)的RIPA裂解液,混匀后置于冰上(4 ℃)裂解30 min,采用BCA 试剂盒进行蛋白定量。PVDF膜转膜后用含5%脱脂牛奶室温封闭2 h,加入EZH2抗体,放置于4 ℃孵育过夜。采用羊抗鼠的二抗(1∶5 000)孵育2 h,TBST液洗涤3次,10 min/次,在暗室中滴加 ECL发光液曝光显影。
1.7逆转录聚合酶链反应(RT-PCR)检测miR-124的表达水平 采用Trizol法提取组织中总RNA,按照反转录试剂盒说明书进行操作。以cDNA 为模板,用SYBR Green做荧光染料,RT-PCR法检测miR-124的表达。相应引物序列miR-124 F:5’-ACTCGGCTCGTGGCACTCC-3’,R:5’-ATACCGCGGATTTGGACGCC-3’;U6 为F:5’-TATCCGTCGGCAGCCTAGGGACG-3’,R:5’-ATGCGCAACGTAATGGCTGGCA-3’。目的基因的表达采用相对定量法,即以U6 RNA作为内参,结果数据采用2-△△Ct法分析。
1.8荧光素酶报告实验 利用生物信息预测网站预测miR-124和EZH2的结合片段。将扩增的EZH2 mRNA 的3’端非翻译区(3’UTR)插入到pMIR-reporterTM 的miRNA 表达载体(Applied Biosystems)中,将上述荧光素酶报告载体及突变载体miR-124 NC及miR-124 mimics共同转染至786-O细胞。培养48 h后,采用荧光素酶检测试剂盒测定细胞的荧光素酶活性。

2 结 果
2.1miR-124在肾癌组织及癌旁正常组织中表达 62例肾癌及癌旁正常组织标本中,与癌旁正常组织相比,肾癌组织中miR-124 mRNA表达水平明显降低,差异有统计学意义(P<0.05)。见图1。
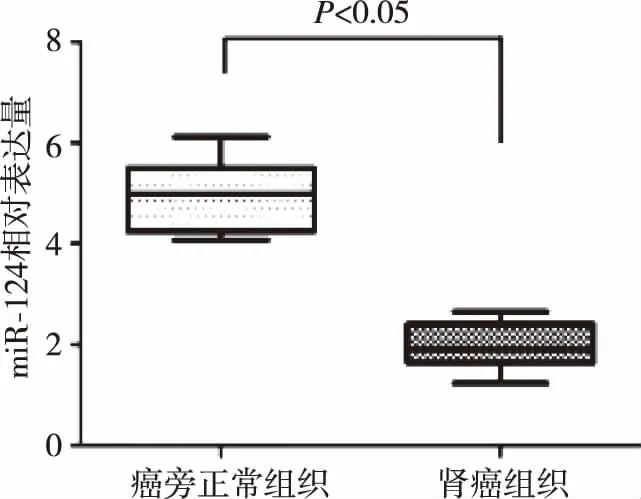
图1 肾癌与癌旁正常组织中miR-124的表达
2.2肾癌组织中miR-124的表达水平与肾癌患者临床病理特征的相关性 根据miR-124在肾癌组织标本中的平均表达量,将入选患者分为miR-124高表达组(28例)和低表达组(34例)。采用χ2检验分析miR-124的表达水平与临床病理特征的相关性,结果显示,miR-124的表达与肿瘤的组织学分级、临床分期以及淋巴结转移密切相关,而与患者的年龄、性别、肿瘤直径、肿瘤数目无统计学相关性。见表1。
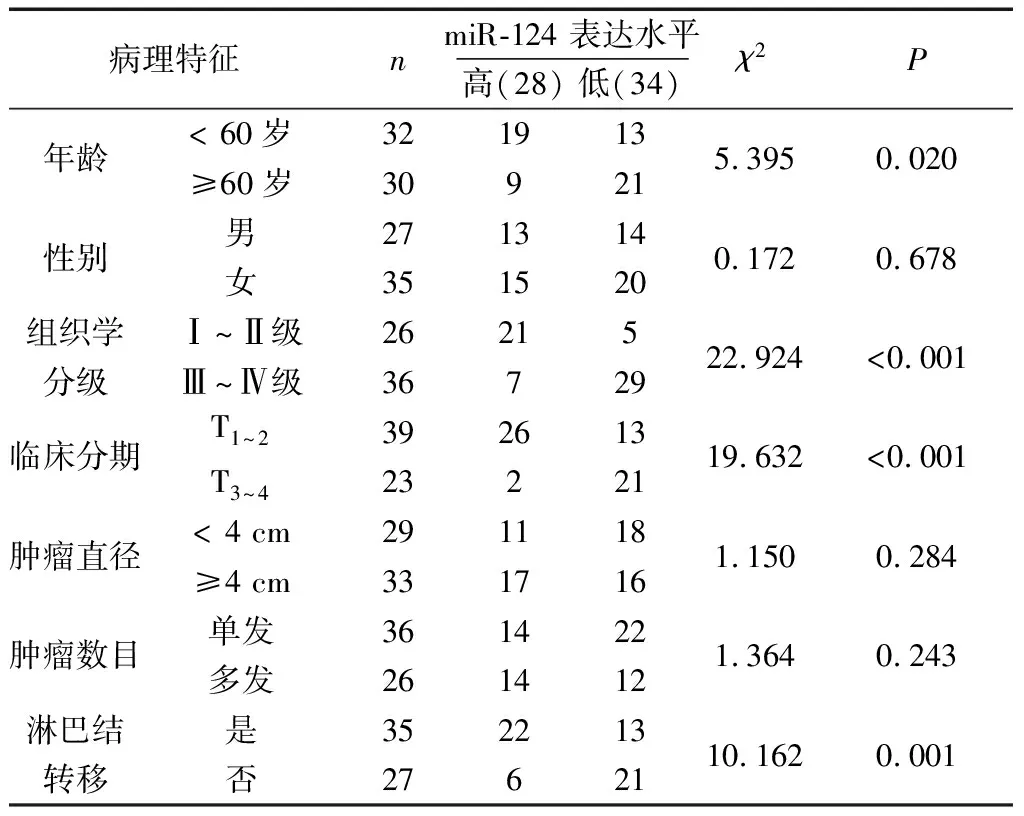
表1 miR-124表达水平与肾癌患者临床病理特征的相关性(n)
2.3过表达miR-124对肾癌786-O细胞增殖、迁移以及侵袭水平的影响 结果显示,与miR-124 NC相比,miR-124 mimics组786-O细胞中增殖、迁移以及侵袭水平明显减少,差异有统计学意义(P<0.05)。见图2。
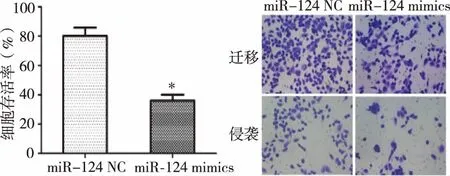
注:与miR-124 NC比较,*P<0.05。
图2过表达miR-124 对786-O细胞增殖、迁移以及侵袭水平的影响
2.4miR-124 与EZH2 mRNA 3’非编码区的互补配对序列 采用靶基因网站对miR-124的靶基因进行预测。结果显示,miR-124与EZH2基因mRNA 3’非编码区之间存在互补配对。荧光素酶报告结果进一步显示,与miR-124 NC相比,miR-124共转染的786-O细胞中,EZH2-WT表达水平明显降低,而EZH2-MUT相对荧光素酶活性无明显变化,表明miR-124是通过结合EZH2基因的3'UTR调节蛋白的表达。见图3。
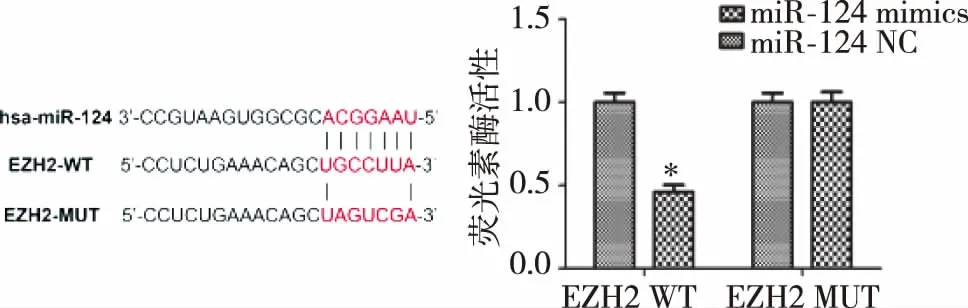
注:与miR-124 NC比较,*P<0.05。
图3miR-124与EZH2 mRNA 3’非编码区的互补配对序列
2.5过表达miR-124对EZH2蛋白表达水平的影响 采用Western blot实验检测过表达miR-124 对肾癌786-O细胞中EZH2蛋白表达的影响。结果显示,与miR-124 NC比较,miR-124 mimics组明显降低了EZH2的表达水平,差异具有统计学意义(P<0.05)。见图4。
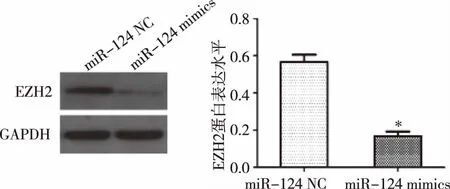
注:与miR-124 NC比较,*P<0.05。
图4过表达miR-124对786-O细胞中EZH2蛋白水平的影响
3 讨 论
肾癌的病理过程较为复杂,其相关的多种危险因素包括吸烟、饮酒、高血压、肥胖以及环境因素等,是一个多阶段及多途径改变的发展过程[6]。尽管外科手术是治疗局限性肾癌的首选方法,但大多数肾癌患者初期症状通常较为隐蔽且没有典型的症状,高达1/3的肾癌患者在诊断时已经转移,而近40%的局部病变患者在手术治疗后复发[7-8]。研究[9]显示miR-124在多种器官的肿瘤组织中异常表达,参与肿瘤的发生发展过程。L.P.Wu等[10]在研究中发现,miR-124在肝癌组织中表达与肿瘤的分级分期呈负相关,通过靶向KLF4抑制肝癌进展并有望成为一种新的诊断标志物;Y.Zhao等[11]研究显示miR-124在头颈部鳞状细胞癌中表达明显低于癌旁组织,并呈外源性表达。miR-124可直接调控细胞中SphK1活性,导致增殖水平减少,集落形成延迟,肿瘤生长减慢;F.Tian等[12]研究表明miR-124通过靶向GATA6基因的表达,使胆管癌细胞的转移和侵袭能力下降。本研究中,我们首先分析检测肾癌组织及癌旁组织中miR-124的表达水平,发现肾癌患者组织中miR-124表达明显低于癌旁正常组织。接下来,我们分析了肾癌组织中miR-124的表达水平与患者临床病理特征的相关性,结果提示低表达水平的miR-124与肿瘤的高组织学分级、高临床分期以及淋巴结转移阳性密切相关,而与患者的性别、年龄、肿瘤直径、肿瘤数目等均无关。此外,在786-O细胞中过表达miR-124后,细胞的增殖、迁移及侵袭能力明显降低,提示miR-124可能与肾癌的发生及发展有关,在肾癌中可能扮演了“抑癌基因”的角色。
EZH2基因也称ENX-1,编码在人体染色体7q35上,是多梳蛋白抑制复合体2(PcG,polycomb group)基因家族重要成员之一。其通过催化组蛋白H327位点的三甲基化(H3K27me3),对相关靶基因发挥转录抑制的作用[13-14]。L.Liu等[15]研究发现EZH2在肾癌中促进了细胞的迁移和侵袭,是晚期肾癌的潜在的治疗靶点;另有文献报道EZH2参与了乳腺癌的进展且高表达的EZH2与患者生存不良明显相关,表明EZH2可作为乳腺癌患者的预后生物标志物和靶点[16]。S.Liu等[17]研究显示EZH2在食管癌S100A4细胞中具有促进迁移和增殖的作用,提示ECH2在食管癌中扮演了“促癌基因”的角色。为进一步探讨miR-124抑制肿瘤发生的机制,本研究通过肾癌786-O细胞实验探讨了miR-124和EZH2的关系,结果发现过表达miR-124后,EZH2蛋白表达下调,提示miR-124可能通过靶向EZH2的表达起到抑制肿瘤的作用。
综上所述,miR-124的异常表达可能与肾癌的发生及发展密切相关,可能是靶向调控EZH2的表达以影响肾癌786-O细胞的增殖、迁移和侵袭能力。本研究可进一步了解miR-124在调节肾癌进展中的功能和分子机制,可对肾癌的临床诊断和治疗提供新的认识。

